解题方法
1 . 近期,我国科学家发现碘酸(化学式: )、亚碘酸(化学式:
)、亚碘酸(化学式: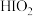 )、硫酸三类物质相互反应形成颗粒物的新机制,可以更好地防控大气污染。以下说法不正确的是
)、硫酸三类物质相互反应形成颗粒物的新机制,可以更好地防控大气污染。以下说法不正确的是
 )、亚碘酸(化学式:
)、亚碘酸(化学式: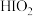 )、硫酸三类物质相互反应形成颗粒物的新机制,可以更好地防控大气污染。以下说法不正确的是
)、硫酸三类物质相互反应形成颗粒物的新机制,可以更好地防控大气污染。以下说法不正确的是| A.碘酸和亚碘酸中碘元素的化合价相同 |
B. 、 、 、 、 、 、 都属于非金属元素 都属于非金属元素 |
C.酸中的阳离子全部是 |
| D.碘原子核外最外层有7个电子,所以与氯原子化学性质相似 |
您最近半年使用:0次
解题方法
2 . 用所学化学知识回答下列问题:
(1)下列表述不正确的是______。
(2)根据下列粒子的结构示意图,回答问题。______ (填数字)种元素。
②化学性质相似的原子有______ (填字母)。
③由B、C、E对应的三种元素组成的常见化合物的化学式为______ 。
(1)下列表述不正确的是______。
| A.蜡烛燃烧后质量减少,说明有些化学变化不遵守质量守恒定律 |
B. 氯酸钾和 氯酸钾和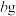 二氧化锰充分加热后,剩余固体质量 二氧化锰充分加热后,剩余固体质量 ,生成的氧气质量为 ,生成的氧气质量为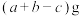 |
C.在化学反应 中,一定 中,一定 |
| D.根据质量守恒定律推断:5g液态水完全蒸发可得到5g水蒸气 |
(2)根据下列粒子的结构示意图,回答问题。

②化学性质相似的原子有
③由B、C、E对应的三种元素组成的常见化合物的化学式为
您最近半年使用:0次
2024-04-19更新
|
56次组卷
|
2卷引用:2024年陕西省西安工业大学附属中学中考第四次模拟化学试题
3 . 2023年冬天,全国各地的朋友因为“哈尔滨”的热情纷至沓来,冰天雪地也是金山银山。中央大街,索菲亚大教堂,冰雪大世界,让每一位游客流连忘返。那么这泼天的富贵与化学有什么关联呢?请回答下列问题:
(1)东北天气寒冷,春秋季节种植蔬菜需要用到塑料大棚,其使用的塑料属于________ 材料(填“合成”或“天然”);
(2)私家车免费接南方小土豆成为热情的哈尔滨人的一大特色,乙醇汽油的使用,在一定程度上减少除一氧化碳外________ (填一条即可)等汽车尾气的污染;
(3)地铁的开通极大的方便了游客的出行:用作铁轨的锰钢应该具有的性质是________;
(4)鄂伦春族、土家族、苗族、羌族……都来哈尔滨的中央大街帮忙宣传,56个民族是一家。化学元素周期表也是一个大家族,通常情况下,元素周期表中同族元素的化学性质相似,但还要根据原子最外层电子数的稳定情况来判断。下列各组元素具有相似化学性质的是________(填序号);
(5)由上述信息可知,硫元素与其同族下一周期的硒元素(Se)具有相似的化学性质,请类比硫酸和碱反应的规律,写出硒酸( )和
)和 溶液发生中和反应的化学方程式
溶液发生中和反应的化学方程式________ 。
(1)东北天气寒冷,春秋季节种植蔬菜需要用到塑料大棚,其使用的塑料属于
(2)私家车免费接南方小土豆成为热情的哈尔滨人的一大特色,乙醇汽油的使用,在一定程度上减少除一氧化碳外
(3)地铁的开通极大的方便了游客的出行:用作铁轨的锰钢应该具有的性质是________;
| A.硬度大 韧性好 | B.密度小 熔点高 |
(4)鄂伦春族、土家族、苗族、羌族……都来哈尔滨的中央大街帮忙宣传,56个民族是一家。化学元素周期表也是一个大家族,通常情况下,元素周期表中同族元素的化学性质相似,但还要根据原子最外层电子数的稳定情况来判断。下列各组元素具有相似化学性质的是________(填序号);
A. 和 和 | B.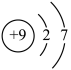 和 和 | C.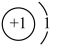 和 和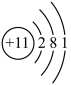 |
(5)由上述信息可知,硫元素与其同族下一周期的硒元素(Se)具有相似的化学性质,请类比硫酸和碱反应的规律,写出硒酸(
 )和
)和 溶液发生中和反应的化学方程式
溶液发生中和反应的化学方程式
您最近半年使用:0次
2024-04-18更新
|
34次组卷
|
2卷引用:黑龙江省哈尔滨市松北区2024年初中升学调研测试(一) 综合试卷-初中化学
4 . 2023年9月份在杭州举办的亚运会秉持“绿色、智能、节俭、文明”的办赛理念,其中“绿色低碳”被摆在首位,所有场馆将实现100%绿电供应、所有亚运会官方指定用车均为新能源汽车等。
(1)绿电主要指光伏发电和风电。绿电与燃煤发电相比其优点是______ (回答一点即可)。为方便新能源汽车,使用了大功率充电桩搭载的新型碳化硅功率器。如图是硅原子的结构示意图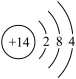 ,硅的原子序数为
,硅的原子序数为______ ,硅元素与碳元素化学性质相似的原因是______ 。
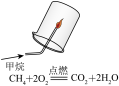
(2)亚运会上使用的甲醇燃料之所以是“零碳”,是因为所用甲醇是综合利用富氢的焦炉气和从工业尾气中捕集的二氧化碳合成的。其反应原理是 ,X的化学式为
,X的化学式为______ 。
(1)绿电主要指光伏发电和风电。绿电与燃煤发电相比其优点是
 ,硅的原子序数为
,硅的原子序数为(2)亚运会上使用的甲醇燃料之所以是“零碳”,是因为所用甲醇是综合利用富氢的焦炉气和从工业尾气中捕集的二氧化碳合成的。其反应原理是
 ,X的化学式为
,X的化学式为
您最近半年使用:0次
2024-04-15更新
|
24次组卷
|
2卷引用:2024年陕西省咸阳市永寿县蒿店中学中考模拟预测化学试题
5 . I.研究化学反应能更好地服务生产、生活和科研领域。请回答下列问题:
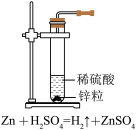
(1)A中反应前后锌元素的化合价分别为___________ ,氢元素的化合价也发生变化。通过比较,发现反应前后有元素的化合价发生变化的还有___________ (填“B”或“C”)。具有这类特征的反应是氧化还原反应,元素化合价发生变化的原因是反应中电子发生了转移,电子转移可形成电流,由此,化学变化在获得物质的同时也实现了能量的转化。
Ⅱ.请根据问题,阅读资料并回答下列问题:
电池是利用氧化还原反应产生电能的装置,可将各种形式的能源以电能的形式稳定、持续输出。
锂二氧化碳电池( 电池)利用
电池)利用 作为正极反应物。
作为正极反应物。 可来源于经处理的工业废气。
可来源于经处理的工业废气。 电池能量密度可达锂离子电池的7倍以上,有望成为锂离子电池的替代。但我国锂的储量较低,锂离子电池尚存在在低温和高温条件下充放电不稳定,高温易燃等安全问题。根据我国钠的储量较高且分布广泛的状况,我国科研工作者将
电池能量密度可达锂离子电池的7倍以上,有望成为锂离子电池的替代。但我国锂的储量较低,锂离子电池尚存在在低温和高温条件下充放电不稳定,高温易燃等安全问题。根据我国钠的储量较高且分布广泛的状况,我国科研工作者将 电池中的锂替换为钠,研制成钠二氧化碳电池(
电池中的锂替换为钠,研制成钠二氧化碳电池( 电池)。
电池)。 电池的应用虽然能弥补锂离子电池的不足,但也存在能量密度较低和循环寿命较短等问题。我国科研工作者一直在电池技术研究路上奋勇前行!
电池的应用虽然能弥补锂离子电池的不足,但也存在能量密度较低和循环寿命较短等问题。我国科研工作者一直在电池技术研究路上奋勇前行!
(2)从环境角度考虑,你认为由锂离子电池转向研制 电池的意义是
电池的意义是___________ (写一条)。
(3)为解决锂储量较低对 电池发展的阻碍,会优先考虑化学性质相似的金属,以钠替代锂的理由是
电池发展的阻碍,会优先考虑化学性质相似的金属,以钠替代锂的理由是___________ (根据下图所示原子结构回答)。 电池的优势和不足
电池的优势和不足___________ (各写一条)。
|
|
|
| A | B | C |
(1)A中反应前后锌元素的化合价分别为
Ⅱ.请根据问题,阅读资料并回答下列问题:
电池是利用氧化还原反应产生电能的装置,可将各种形式的能源以电能的形式稳定、持续输出。
锂二氧化碳电池(
 电池)利用
电池)利用 作为正极反应物。
作为正极反应物。 可来源于经处理的工业废气。
可来源于经处理的工业废气。 电池能量密度可达锂离子电池的7倍以上,有望成为锂离子电池的替代。但我国锂的储量较低,锂离子电池尚存在在低温和高温条件下充放电不稳定,高温易燃等安全问题。根据我国钠的储量较高且分布广泛的状况,我国科研工作者将
电池能量密度可达锂离子电池的7倍以上,有望成为锂离子电池的替代。但我国锂的储量较低,锂离子电池尚存在在低温和高温条件下充放电不稳定,高温易燃等安全问题。根据我国钠的储量较高且分布广泛的状况,我国科研工作者将 电池中的锂替换为钠,研制成钠二氧化碳电池(
电池中的锂替换为钠,研制成钠二氧化碳电池( 电池)。
电池)。 电池的应用虽然能弥补锂离子电池的不足,但也存在能量密度较低和循环寿命较短等问题。我国科研工作者一直在电池技术研究路上奋勇前行!
电池的应用虽然能弥补锂离子电池的不足,但也存在能量密度较低和循环寿命较短等问题。我国科研工作者一直在电池技术研究路上奋勇前行!(2)从环境角度考虑,你认为由锂离子电池转向研制
 电池的意义是
电池的意义是(3)为解决锂储量较低对
 电池发展的阻碍,会优先考虑化学性质相似的金属,以钠替代锂的理由是
电池发展的阻碍,会优先考虑化学性质相似的金属,以钠替代锂的理由是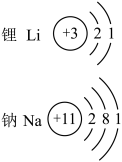
 电池的优势和不足
电池的优势和不足
您最近半年使用:0次
2024-04-13更新
|
31次组卷
|
3卷引用:黑龙江省哈尔滨市平房区2023—2024学年下学期初中学业水平调研测试(一)化学试题
解题方法
6 . 毛泽东主席在《水调歌头·重上井冈山》有:“可上九天揽月,可下五洋捉鳖,谈笑凯歌还。世上无难事,只要肯登攀。”的诗句。现在中国制造“钛”神奇,它能坐底地球最深处马里亚纳海沟,还可远涉遥远的月球、火星。材料化学正改变我们的生活。
(1)工业上常用钛铁矿(主要成分的化学式为FeTiO3)提炼金属钛,FeTiO3中Fe的化合价为+2,则FeTiO3中Ti元素的化合价为______ 价。
(2)如图1是钛元素在元素周期表中的部分信息,图2是钛原子结构示意图,A、B、C、D四种粒子结构示意图。
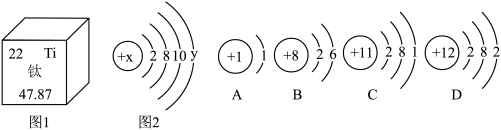
①根据信息钛的相对原子质量为______ 。
②在A、B、C、D四种粒子中,与钛原子化学性质相似的是______ 。(填序号)
③由A、B、D三种元素形成化合物的化学式为______ 。
(3)比较粒子半径大小的一般方法是:先比电子层数,电子层数越多,半径越大;若电子层数相同,则比核电荷数,核电荷数越大,半径越小;若电子层数和核电荷数均相同,则比最外层电子数,最外层电子数越多,半径越大。则O2-、Na+、S2-、S四种粒子半径由大到小顺序是______ 。
(1)工业上常用钛铁矿(主要成分的化学式为FeTiO3)提炼金属钛,FeTiO3中Fe的化合价为+2,则FeTiO3中Ti元素的化合价为
(2)如图1是钛元素在元素周期表中的部分信息,图2是钛原子结构示意图,A、B、C、D四种粒子结构示意图。
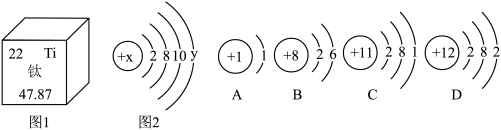
①根据信息钛的相对原子质量为
②在A、B、C、D四种粒子中,与钛原子化学性质相似的是
③由A、B、D三种元素形成化合物的化学式为
(3)比较粒子半径大小的一般方法是:先比电子层数,电子层数越多,半径越大;若电子层数相同,则比核电荷数,核电荷数越大,半径越小;若电子层数和核电荷数均相同,则比最外层电子数,最外层电子数越多,半径越大。则O2-、Na+、S2-、S四种粒子半径由大到小顺序是
您最近半年使用:0次
名校
解题方法
7 . “缺芯”在近两年成为了一场全球性的危机。
(1)2021年10月,半导体芯片封装的关键材料单晶纳米铜实现国产化量产,其成品约为头发丝十分之一细,铜可制成单晶纳米铜是因为其具有优良的_______ 性。
(2)我国的半导体研究和生产是从1957年首次制备出高纯度的锗开始的。图1是锗原子的结构示意图,图中x=_______ 。下列微粒中与锗原子的化学性质相似的是_______ (填序号),B中的粒子符号为_______ 。
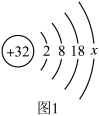
A.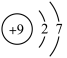 B.
B. C.
C.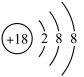 D.
D.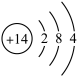
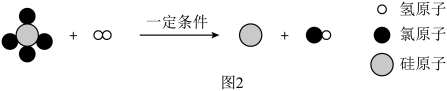
(3)单晶硅是制造芯片的重要材料。工业上制取高纯硅的一个反应的微观示意图如图2,该反应的化学方程式为_______ 。
(4)生产5G芯片的主要原料是第三代半导体材料氮化镓,制取氮化镓的原理为2Ga+2X 2GaN+3H2,则X的化学式为
2GaN+3H2,则X的化学式为_______ 。氧化镓中镓元素的化合价为+3,则氧化镓的化学式为_______ 。
(1)2021年10月,半导体芯片封装的关键材料单晶纳米铜实现国产化量产,其成品约为头发丝十分之一细,铜可制成单晶纳米铜是因为其具有优良的
(2)我国的半导体研究和生产是从1957年首次制备出高纯度的锗开始的。图1是锗原子的结构示意图,图中x=

A.
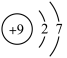 B.
B. C.
C. D.
D.
(3)单晶硅是制造芯片的重要材料。工业上制取高纯硅的一个反应的微观示意图如图2,该反应的化学方程式为

(4)生产5G芯片的主要原料是第三代半导体材料氮化镓,制取氮化镓的原理为2Ga+2X
 2GaN+3H2,则X的化学式为
2GaN+3H2,则X的化学式为
您最近半年使用:0次
名校
解题方法
8 . 含氯消毒剂是家庭中最常见的消毒剂种类之一,这类消毒剂可以杀灭各种微生物,包括病毒、真菌、细菌芽孢等。如图1为氯元素在元素周期表中的相关信息及原子结构示意图。

(1)氯元素的相对原子质量为______ ;
(2)在化学反应中,元素通常通过得电子或失电子形成8电子稳定结构,在图2所示的四个粒子中,与氯元素在反应中同样为易得电子的粒子是______ (填字母)。
(3)84消毒液的主要成分是次氯酸钾(NaClO),其中氯元素的化合价为______ 。

(1)氯元素的相对原子质量为
(2)在化学反应中,元素通常通过得电子或失电子形成8电子稳定结构,在图2所示的四个粒子中,与氯元素在反应中同样为易得电子的粒子是
(3)84消毒液的主要成分是次氯酸钾(NaClO),其中氯元素的化合价为
您最近半年使用:0次
名校
解题方法
9 . 探究金属镁、锌的活动性强弱
(1)请利用金属能与酸反应的性质,自选仪器和药品,探究金属镁、锌的活动性强弱,完成下列实验报告:
(2)写出上述反应中镁与酸反应的化学反应方程式____ ,该反应属于基本反应类型中的_____ ,反应的实质是_____ 。
(3)从原子结构的角度分析,金属原子在化学反应变化中都容易失去电子是因为___ ,但是不同原子失去电子的能力不同,因此金属的活动性不同。
(1)请利用金属能与酸反应的性质,自选仪器和药品,探究金属镁、锌的活动性强弱,完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论 |
| 镁比锌活泼 |
(3)从原子结构的角度分析,金属原子在化学反应变化中都容易失去电子是因为
您最近半年使用:0次
解题方法
10 . 计时器中的化学
时间对人类极为重要,它渗透于人类的生产生活、科学实验、经济建设和国防安全的各个领域。
早在3000多年前,我们祖先就发明了用石片刻制成的“日晷”作为计时器。到了铜器时代,又发明了用青铜制的“漏壶”,取代了“日晷”。15世纪末出现了铁制发条,利用其弹力逐渐松开时产生动力,为钟的小型化及怀表、腕表的发明创造了条件。
2014年,我国自主研制的“NIM5激光冷却-铯原子喷泉钟”实现了2000万年不差一秒,成为国际计量局认可的基准钟之一,参与国际标准时间修正。这意味着NIM5可独立“守住”中国原子时。铯原子喷泉钟的任务是提供“秒”这个时间单位的准确计量,是GPS的基础支撑技术。下一代NIM6将达到6000万年不差一秒,目前已经进入调试阶段。
根据材料回答下列问题:
(1)“日晷”计时:要检验制作“日晷”所用石片中含有碳酸盐,写出实验步骤、现象与结论_ 。
(2)在铜器时代,使用青铜制作漏壶,与使用纯铜制作漏壶相比,最主要的优点是_______ ,铜与青铜的性质不同,主要原因是_______ 。
(3)铁器时代发明了铁制发条。
①铁的冶炼
铁元素在自然界中分布很广,大多以化合物的形式存在于各种铁矿石中,常见的铁矿石有赤铁矿、磁铁矿、黄铁矿(主要成分是FeS2)等,黄铁矿不适宜直接炼铁,主要是因为_______ 黄铁矿也是一种重要的矿石,根据其组成,黄铁矿可用于生产(写出一种酸的化学式)_______ 。
以磁铁矿为例,写出工业炼铁的化学方程式_______ 。
②下表是常见的铁合金及其性能,“发条”中使用的铁合金是_______ 。
③在自然界中,铁元素的含量远高于铜,但是铁器的大规模应用晚于铜器,主要原因是_______ 。
(4)铯原子喷泉钟-下图为铯原子和部分其他原子的结构示意图:
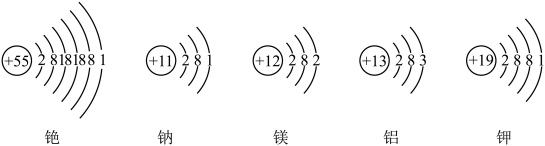
①根据上述信息,铯原子的化学性质与(填写符号)_______ 原子相似,判断的依据是_______ 。可以推测,在一般情况下,金属铯在水溶液中比所选金属(填“不活泼”或“活泼”)_______ 。下列物质间,能发生化学反应的有(填序号)_______ 。
A.氯化铯与铁 B.铯与氯化银 C.铯与盐酸 D.铯与氧气
②钠在空气中极易与氧气反应,能与氮气、二氧化碳反应,能跟水发生剧烈反应。镁在空气中表面会生成一层氧化膜,能与沸水反应。根据以上信息推断,铯原子钟中铯的“工作环境”应当是_______ 。
时间对人类极为重要,它渗透于人类的生产生活、科学实验、经济建设和国防安全的各个领域。
早在3000多年前,我们祖先就发明了用石片刻制成的“日晷”作为计时器。到了铜器时代,又发明了用青铜制的“漏壶”,取代了“日晷”。15世纪末出现了铁制发条,利用其弹力逐渐松开时产生动力,为钟的小型化及怀表、腕表的发明创造了条件。
2014年,我国自主研制的“NIM5激光冷却-铯原子喷泉钟”实现了2000万年不差一秒,成为国际计量局认可的基准钟之一,参与国际标准时间修正。这意味着NIM5可独立“守住”中国原子时。铯原子喷泉钟的任务是提供“秒”这个时间单位的准确计量,是GPS的基础支撑技术。下一代NIM6将达到6000万年不差一秒,目前已经进入调试阶段。
根据材料回答下列问题:
(1)“日晷”计时:要检验制作“日晷”所用石片中含有碳酸盐,写出实验步骤、现象与结论
(2)在铜器时代,使用青铜制作漏壶,与使用纯铜制作漏壶相比,最主要的优点是
(3)铁器时代发明了铁制发条。
①铁的冶炼
铁元素在自然界中分布很广,大多以化合物的形式存在于各种铁矿石中,常见的铁矿石有赤铁矿、磁铁矿、黄铁矿(主要成分是FeS2)等,黄铁矿不适宜直接炼铁,主要是因为
以磁铁矿为例,写出工业炼铁的化学方程式
②下表是常见的铁合金及其性能,“发条”中使用的铁合金是
| 铁合金 | 含碳量 | 性能 |
| 生铁 | 2%-4.3% | 硬而脆,可以铸造但是不能锻轧 |
| 钢 | 0.03%-2% | 强度高、韧性好、耐腐蚀、易加工 |
(4)铯原子喷泉钟-下图为铯原子和部分其他原子的结构示意图:

①根据上述信息,铯原子的化学性质与(填写符号)
A.氯化铯与铁 B.铯与氯化银 C.铯与盐酸 D.铯与氧气
②钠在空气中极易与氧气反应,能与氮气、二氧化碳反应,能跟水发生剧烈反应。镁在空气中表面会生成一层氧化膜,能与沸水反应。根据以上信息推断,铯原子钟中铯的“工作环境”应当是
您最近半年使用:0次