解题方法
1 . 《天工开物》中记载了许多我国古代劳动人民对物质的认识和应用的事例。如:硝石:凡硝刮扫取时,(墙中亦或迸出)入缸内水浸一宿,秽杂之物浮于面上,掠取去时,然后入釜,注水煎炼。硝化水干,倾于器内,经过一宿,即结成硝。
(1)硝石的主要成分是硝酸钾(KNO3),硝酸钾中氮元素的化合价是_______ ,硝酸钾中氮元素的质量分数为_______ (保留3位有效数字),硝石的主要成分还是一种_______ 肥。
(2)经过溶解的硝石,除去“秽杂之物”,实验室中可以通过_______ 的方法(填一种分离方法)。然后经过煎炼浓缩,冷却结晶的方法,可得到硝石晶体,此方法的依据是:_______ 。
(3)硝石也是制造黑火药的主要原料,其反应原理为: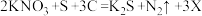 ,其中X的化学式是
,其中X的化学式是_______ 。
(1)硝石的主要成分是硝酸钾(KNO3),硝酸钾中氮元素的化合价是
(2)经过溶解的硝石,除去“秽杂之物”,实验室中可以通过
(3)硝石也是制造黑火药的主要原料,其反应原理为:
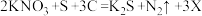 ,其中X的化学式是
,其中X的化学式是
您最近一年使用:0次
解题方法
2 . 阅读下面科普短文。
大豆异黄酮(C15H10O4),浅黄色粉末,气味微苦,略有涩味,是大豆生长中形成的一类次生代谢产物,是一种植物雌激素,可以影响到激素分泌、代谢生物学活性、蛋白质合成、生长因子活性,是天然的癌症化学预防剂。
豆腐中含异黄酮27.74毫克,其干物质含异黄酮200毫克以上。点浆是制作豆腐的关键工序。点浆时常用到的凝固剂有盐类凝固剂,如石膏(主要成分为硫酸钙)或盐卤(如氯化镁等);酸类凝固剂,如葡萄糖酸―δ―内酯(化学式为 C6H10O6,简称 GdL)。
凝固剂种类对豆腐中异黄酮含量有影响。二者的关系如图1所示。
凝固剂添加量对豆腐的品质也有影响。将大豆泡发后,与水按1:4的比例磨成豆浆,以MgCl2为例,研究结果如图2所示。
依据文章内容回答下列问题。
(1)大豆异黄酮的物理性质有___________ (写出一条即可)。
(2)大豆异黄酮中碳元素的质量分数计算式为___________ 。
(3)由图1可知,用___________ 凝固剂制作的豆腐异黄酮含量最高。
(4)判断下列说法是否正确(填“对”或“错”)。
①MgCl2添加的越多,豆腐的保水性越好。___________
②豆腐营养丰富,多吃对身体无害。___________
(5)由图2可知,豆腐产率与MgCl2添加量的关系为:其他条件相同时,MgCl2添加量在0.35%~0.71%之间时,___________ 。
大豆异黄酮(C15H10O4),浅黄色粉末,气味微苦,略有涩味,是大豆生长中形成的一类次生代谢产物,是一种植物雌激素,可以影响到激素分泌、代谢生物学活性、蛋白质合成、生长因子活性,是天然的癌症化学预防剂。
豆腐中含异黄酮27.74毫克,其干物质含异黄酮200毫克以上。点浆是制作豆腐的关键工序。点浆时常用到的凝固剂有盐类凝固剂,如石膏(主要成分为硫酸钙)或盐卤(如氯化镁等);酸类凝固剂,如葡萄糖酸―δ―内酯(化学式为 C6H10O6,简称 GdL)。
凝固剂种类对豆腐中异黄酮含量有影响。二者的关系如图1所示。
凝固剂添加量对豆腐的品质也有影响。将大豆泡发后,与水按1:4的比例磨成豆浆,以MgCl2为例,研究结果如图2所示。

依据文章内容回答下列问题。
(1)大豆异黄酮的物理性质有
(2)大豆异黄酮中碳元素的质量分数计算式为
(3)由图1可知,用
(4)判断下列说法是否正确(填“对”或“错”)。
①MgCl2添加的越多,豆腐的保水性越好。
②豆腐营养丰富,多吃对身体无害。
(5)由图2可知,豆腐产率与MgCl2添加量的关系为:其他条件相同时,MgCl2添加量在0.35%~0.71%之间时,
您最近一年使用:0次
解题方法
3 . 化学在生活生产中有广泛用途,请回答问题:
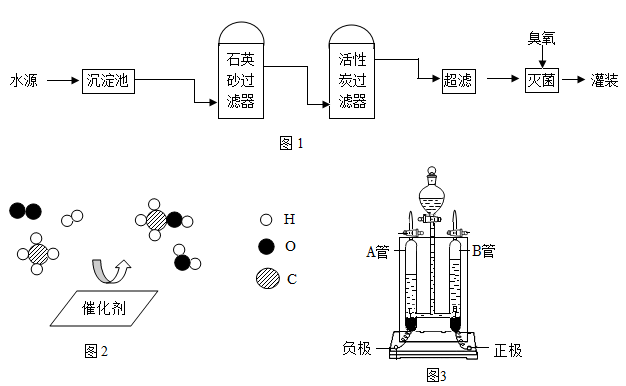
(1)某实践小组参观天津矿泉水厂,该厂矿泉水含钙、钾等矿物质,其生产流程示意图(如图 1)。矿泉水中的钙、钾指的是______ (填“元素”或“单质”);活性炭过滤器中活性炭的作用是______ 。
(2)我国科学家研制了一种新型催化剂,实现了甲烷向重要化工原料甲醇的高效转化,反应过程的微观示意图(如图 2)所示。该反应的化学方程式为______ ;反应物中的一种气体可供呼吸。利用(如图(3)中的电解水装置制取时,它会在______ 管(填字母)中产生。
(3)我国承诺 2030 年前“碳达峰”,2060 年前“碳中和”,体现大国担当。我国科学家在实验室实现以 CO2和 H2为原料人工合成淀粉[(C6H10O5)n],若用 44 g CO2人工合成淀粉(假设反应过程中无含碳物质的加入和损失),理论上制得淀粉的质量为______ g。

(1)某实践小组参观天津矿泉水厂,该厂矿泉水含钙、钾等矿物质,其生产流程示意图(如图 1)。矿泉水中的钙、钾指的是
(2)我国科学家研制了一种新型催化剂,实现了甲烷向重要化工原料甲醇的高效转化,反应过程的微观示意图(如图 2)所示。该反应的化学方程式为
(3)我国承诺 2030 年前“碳达峰”,2060 年前“碳中和”,体现大国担当。我国科学家在实验室实现以 CO2和 H2为原料人工合成淀粉[(C6H10O5)n],若用 44 g CO2人工合成淀粉(假设反应过程中无含碳物质的加入和损失),理论上制得淀粉的质量为
您最近一年使用:0次
解题方法
4 . 能源利用和环境保护是人类共同关注的问题。
(1)目前,人们利用最多的能源是______ 、石油和天然气等化石燃料。
(2)写出甲烷在空气中充分燃烧的化学方程式______ 。
(3)下列叙述正确的是______(填字母序号)。
(4)将23 g乙醇与一定量氧气在密闭容器中点燃,在一定条件下充分反应,生成一氧化碳、二氧化碳和水。恢复到室温,测得一氧化碳和二氧化碳混合气体中氧元素质量分数为70%,则燃烧生成水的质量为______ g;一氧化碳和二氧化碳的质量比为______ 。
(1)目前,人们利用最多的能源是
(2)写出甲烷在空气中充分燃烧的化学方程式
(3)下列叙述正确的是______(填字母序号)。
| A.化学反应伴随着能量变化 |
| B.化学反应过程中都会发生放热的现象 |
| C.人类利用的能源都是通过化学反应获得的 |
您最近一年使用:0次
5 . 中国将在2030年前实现“碳达峰”:2060年前实现“碳中和”。为了实现“双碳”目标,全社会各个领域开始行动起来。其中碳转化和碳封存是实现碳中和的主要途径之一
I、碳转化
(1)科学家已经研究出多种方式来实现二氧化碳的转化。例如我国研发的“液态太阳燃料合成技术”,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。利用二氧化碳和氢气作为原料在纳米纤维催化剂的作用下,生成甲醇(CH3OH)和水,请写出该反应的化学方程式______ 。
Ⅱ、碳封存
化学链燃烧技术是利用载氧体(金属氧化物)将空气中的氧传输至燃料的新技术,利用化学链燃烧技术捕捉甲烷(CH4)燃烧所产生的CO2,再利用NaOH溶液喷淋捕捉CO2的工艺流程图如下:
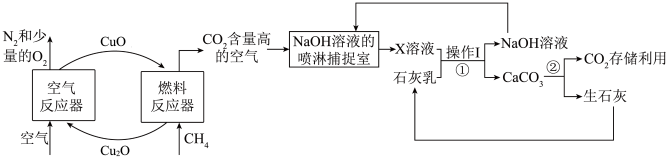
(2)氧元素的质量分数:Cu2O______ CuO(填“>”“<”或“=”)
(3)请写出空气反应器的物质在加热条件下的化学方程式:______ 该反应属于______ (填基本反应类型)。
(4)操作I的名称是______ ,反应②中的化学方程式为______ 。
(5)北京冬奥会速滑馆“冰丝带”制冰采用了世界上最先进的二氧化碳跨临界直冷制冰技术。固态二氧化碳的俗称______ 。
I、碳转化
(1)科学家已经研究出多种方式来实现二氧化碳的转化。例如我国研发的“液态太阳燃料合成技术”,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。利用二氧化碳和氢气作为原料在纳米纤维催化剂的作用下,生成甲醇(CH3OH)和水,请写出该反应的化学方程式
Ⅱ、碳封存
化学链燃烧技术是利用载氧体(金属氧化物)将空气中的氧传输至燃料的新技术,利用化学链燃烧技术捕捉甲烷(CH4)燃烧所产生的CO2,再利用NaOH溶液喷淋捕捉CO2的工艺流程图如下:

(2)氧元素的质量分数:Cu2O
(3)请写出空气反应器的物质在加热条件下的化学方程式:
(4)操作I的名称是
(5)北京冬奥会速滑馆“冰丝带”制冰采用了世界上最先进的二氧化碳跨临界直冷制冰技术。固态二氧化碳的俗称
您最近一年使用:0次
2023-04-24更新
|
514次组卷
|
3卷引用:第06讲 解密工艺流程题(测试)-2023年中考化学二轮复习讲练测
解题方法
6 . 阅读下面科普短文,依据文章内容回答下列问题。
在人体中,钠元素有重要的生理功能:调节水量、维持酸碱平衡、维持血压等。我国居民膳食中每日通过食品或调料获得钠元素的主要来源如图1所示。图2为2015年我国某省份人均每日食盐投入量与国家推荐标准和世界卫生组织(WHO)推荐的国际标准的比对。
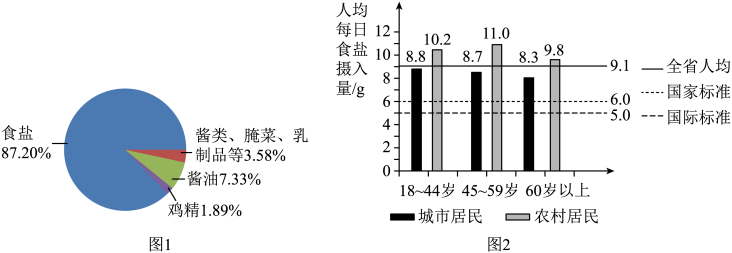
事实证明,中国人的膳食结构中钠元素过多,钾元素过少,这样的情况易导致高血压的发生。为此,以碘盐为基础,加入有咸味的氯化钾,用氯化钾代替部分氯化钠(减钠增钾),使钠、钾比例合理,形成低钠盐。低钠盐有利于防治高血压,通常属于推荐用盐。但高温作业者、重体力劳动强度的工作人员(汗液流失会带走大量钠离子)、肾脏病或高钾血症患者不建议选用。
表一超市中常见的深井岩盐和低钠岩盐成分配料表
(1)NaCl属于人体所需六种营养素中的_________________ ,超市中常见的深井岩盐属于____________ (填“混合物”或“纯净物”)。
(2)食盐中K4Fe(CN)6的主要作用是抗结剂,K4Fe(CN)6是由___________ 种元素组成的。其中钾元素和碳元素的质量比是_____________ (填最简整数比),________________ gK4Fe(CN)6中含有56g铁元素。
(3)食盐中碘酸钾与氯酸钾类似,受热易分解,写出碘酸钾分解的反应方程式_________________ 。
(4)由图2可知,下列说法不正确的是_______________(填字母序号)。
在人体中,钠元素有重要的生理功能:调节水量、维持酸碱平衡、维持血压等。我国居民膳食中每日通过食品或调料获得钠元素的主要来源如图1所示。图2为2015年我国某省份人均每日食盐投入量与国家推荐标准和世界卫生组织(WHO)推荐的国际标准的比对。

事实证明,中国人的膳食结构中钠元素过多,钾元素过少,这样的情况易导致高血压的发生。为此,以碘盐为基础,加入有咸味的氯化钾,用氯化钾代替部分氯化钠(减钠增钾),使钠、钾比例合理,形成低钠盐。低钠盐有利于防治高血压,通常属于推荐用盐。但高温作业者、重体力劳动强度的工作人员(汗液流失会带走大量钠离子)、肾脏病或高钾血症患者不建议选用。
表一超市中常见的深井岩盐和低钠岩盐成分配料表
| 种类 | NaCl(g/100g) | KCl(g/100g) | 碘酸钾K1O3(以I计,mg/kg) | K4Fe(CH)6(以【Fe(CN)4-】计,mg/kg) |
| 深井岩盐 | ≥98.5 | 0 | 18-33 | ≤10 |
| 低钠岩盐 | 65-80 | 20-35 | 18-33 | ≤10 |
(1)NaCl属于人体所需六种营养素中的
(2)食盐中K4Fe(CN)6的主要作用是抗结剂,K4Fe(CN)6是由
(3)食盐中碘酸钾与氯酸钾类似,受热易分解,写出碘酸钾分解的反应方程式
(4)由图2可知,下列说法不正确的是_______________(填字母序号)。
| A.该省份人均每日摄入食盐的量超过了国家推荐的标准 |
| B.我图对食盐摄入量的推荐标准高于世界卫生组织(WHO)推荐的国际标准 |
| C.无论是城市居民还是农村居民,都是年龄越大,人均每日摄入食盐越少 |
| D.在图示的每个年龄段中,农村居民的人均每日食盐摄入量都比城市居民多 |
| E.依据表I,建议外卖小哥在炎热的夏天食用低钠岩盐 |
您最近一年使用:0次
解题方法
7 . 2021年9月,中国科学院天津工业生物技术研究所研究成果“无细胞化学酶系统催化CO2合成淀粉”相关论文在国际学术期刊《Nature》上发表,C3H6O3是合成过程中的一种中间产物。计算:
(1)C3H6O3的相对分子质量为
(2)C3H6O3中碳、氢、氧三种元素质量比为
(3)C3H6O3中碳元素的质量分数为
您最近一年使用:0次
解题方法
8 . 农村推广使用沼气可以改善能源结构和环境卫生,沼气的主要成分(CH4)完全燃烧的化学方程式为_______ 。11g某化合物在氧气中完全燃烧生成22gCO2和9gH2O,若该化合物的相对分子质量为88,则其化学式为_______ 。
您最近一年使用:0次
2023-04-09更新
|
167次组卷
|
4卷引用:专题03 物质的化学变化-【查漏补缺】2024年中考化学复习冲刺过关(全国通用)
(已下线)专题03 物质的化学变化-【查漏补缺】2024年中考化学复习冲刺过关(全国通用)2023年河南省许昌市中考一模化学试题2024年河南省南阳市方城县中考一模化学试题2024年河南省周口市郸城县中考六模化学试卷
名校
解题方法
9 . 我国古代炉甘石(ZnCO3)、赤铜(Cu2O)和足量木炭粉混合加热到约800℃,得到黄铜(铜和锌的合金),现进行模拟,工艺流程如“如图”所示。 2Zn+4Cu+4CO2↑
2Zn+4Cu+4CO2↑
(1)木炭在此过程中充当___________ (填“氧化剂”或“还原剂”);Zn的金属活动性比Cu要___________ (填“强”或“弱”)。
(2)气体A中一定含有CO2,可能含有___________ 。
(3)若用该工艺制备了2000g黄铜产品,其中锌单质的质量分数为32.5%。计算产生这些锌单质所需要碳酸锌的质量(写出计算过程)。
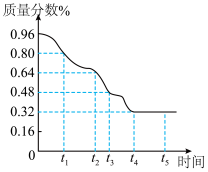
(4)“高温还原冷却”过程,假设产品中氧元素的质量分数随时间的变化如“如图”所示。若(3)中产品是在t4后得到的,且产品中只含有三种元素,则黄铜中含铜元素___________ g(保留整数)。
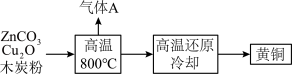
 2Zn+4Cu+4CO2↑
2Zn+4Cu+4CO2↑(1)木炭在此过程中充当
(2)气体A中一定含有CO2,可能含有
(3)若用该工艺制备了2000g黄铜产品,其中锌单质的质量分数为32.5%。计算产生这些锌单质所需要碳酸锌的质量(写出计算过程)。
(4)“高温还原冷却”过程,假设产品中氧元素的质量分数随时间的变化如“如图”所示。若(3)中产品是在t4后得到的,且产品中只含有三种元素,则黄铜中含铜元素

您最近一年使用:0次
解题方法
10 . 乙醇(C2H5OH)俗称酒精,可以用作燃料,将9.2g酒精放入盛有一定量氧气的容器中燃烧,生成二氧化碳、一氧化碳和水,测得二氧化碳的质量是8.8g,那么生成一氧化碳的质量是______ g,该反应的化学方程式为______ 。
您最近一年使用:0次
2023-03-26更新
|
48次组卷
|
3卷引用:2023年河南省中考化学真题变式题(非选择题19~22)
(已下线)2023年河南省中考化学真题变式题(非选择题19~22)河南省驻马店市上蔡县第六初级中学2022-2023学年九年级下学期3月月考化学试题河南省漯河市召陵区青年镇初级中学2022-2023学年九年级下学期3月月考化学试题



