黑龙江省齐齐哈尔市三立高级中学2022-2023学年高三上学期期中考试化学试题
黑龙江
高三
期中
2022-12-09
85次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学反应原理、有机化学基础、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
| A.高品质的白瓷晶莹剔透,属于纯净物 |
| B.瓷器中含有大量的金属元素,因此陶瓷属于金属材料 |
| C.氮化硅陶瓷属于传统无机非金属材料 |
| D."窑变"是高温下釉料中的金属化合物发生氧化还原反应导致颜色的变化 |
【知识点】 含硅的无机非金属材料解读 新型陶瓷解读
| A.鍮石金是铜锌合金 |
| B.炉甘石点化鍮石过程包含分解反应、置换反应 |
| C.可用稀盐酸鉴别鍮石金和黄金 |
| D.炉甘石点化鍮石过程不涉及氧化还原反应 |
【知识点】 氧化还原反应在生活、生产中的应用解读 常见金属的冶炼解读
 。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )A.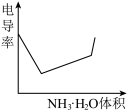 | B.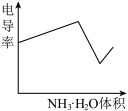 | C.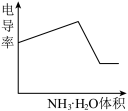 | D.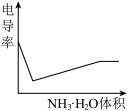 |
【知识点】 酸碱中和滴定原理的应用解读 弱电解质的电离平衡
| A.CO2 | B.H2O | C.HNO3 | D.NaOH |
【知识点】 电解质与非电解质 强电解质和弱电解质的判断 强电解质与弱电解质解读
A. 溶液与少量 溶液与少量 溶液反应: 溶液反应: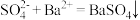 |
B.电解 水溶液: 水溶液: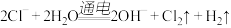 |
C.乙酸乙酯与 溶液共热: 溶液共热: |
D. 溶液中滴加稀氨水: 溶液中滴加稀氨水: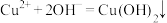 |
| 序号 | 装置 | X溶液 | 现象 |
| Ⅰ | 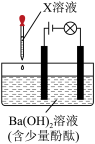 | 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
| Ⅱ | Na2SO4溶液 | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
| Ⅲ | H2SO4溶液 | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |
| A.实验Ⅰ中溶液红色褪去,说明发生了反应:H++OH- = H2O |
| B.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在大量的Na+与OH- |
C.实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应:Ba2++2OH-+2H++SO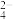 =BaSO4↓+2H2O =BaSO4↓+2H2O |
| D.将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,现象与原实验Ⅱ中的现象相同 |
 、Na+、Al3+、Fe3+、I-、
、Na+、Al3+、Fe3+、I-、 、
、 、
、 、
、 。取该溶液进行以下实验:
。取该溶液进行以下实验:①用pH试纸检验,溶液呈强酸性
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色
③该溶液的焰色反应没有黄色。
根据以上实验结果,下列推断正确的是( )
| A.向该溶液中加入BaCl2不一定能观察到白色沉淀 |
B.可以确定没有Na+、Fe3+、 、 、 ,不能确定是否有 ,不能确定是否有 |
| C.该溶液可能是NH4NO3与HI的混合 |
D.一定没有Al3+、 和 和 |
A. 氨水溶液:Na+、K+、OH-、NO 氨水溶液:Na+、K+、OH-、NO |
B. 盐酸溶液:Na+、K+、SO 盐酸溶液:Na+、K+、SO 、SiO 、SiO |
C. KMnO4溶液:NH KMnO4溶液:NH 、Na+、NO 、Na+、NO 、I- 、I- |
D. AgNO3溶液:NH AgNO3溶液:NH 、Mg2+、Cl-、SO 、Mg2+、Cl-、SO |
【知识点】 限定条件下的离子共存解读
| A.NaH 为共价化合物 | B.该化合物中氢为+1 价 |
| C.NaH 中氢离子半径比锂离子半径小 | D.NaH 中氢离子被氧化为氢气 |
| A.氢气既是氧化产物又是还原产物 |
| B.LiAlH4既是氧化剂又是还原剂 |
| C.若生成标况下4.48 LH2, 则转移0.4 mol 电子 |
| D.还原剂与氧化剂的物质的量之比为2: 1 |
【知识点】 氧化还原反应的应用 氧化还原反应在生活、生产中的应用解读
二、多选题 添加题型下试题
A.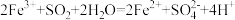 |
B.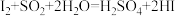 |
| C.H2O2+H2SO4=SO2+O2+2H2O |
D.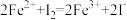 |
三、单选题 添加题型下试题
| A. K2H3IO6发生氧化反应 | B.KI是还原产物 |
| C.生成12.7g I2时,转移0.1mol电子 | D.还原剂与氧化剂的物质的量之比为7:1 |
①水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
②将植物油倒入水中用力搅拌形成油水混合物
③一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路
④往Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
⑤医院里用血液透析的方法治疗肾功能衰竭等疾病引起的血液中毒
⑥FeCl3溶液和氨水混合会产生红褐色沉淀
⑦同一支钢笔先后吸入不同牌子的墨水易造成钢笔堵塞
| A.②④⑥⑦ | B.②⑥ | C.①②④⑦ | D.①③④⑤⑦ |
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.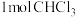 含有 含有 键的数目为 键的数目为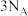 |
B.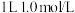 的盐酸含有阴离子总数为 的盐酸含有阴离子总数为 |
C.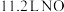 与 与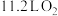 混合后的分子数目为 混合后的分子数目为 |
D.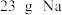 与足量 与足量 反应生成的 反应生成的 分子数目为 分子数目为 |
| A.钠的相对原子质量为11g | B.钠原子在化学反应中易失电子 |
| C.钠由液态变为气态,微粒间间隔变小 | D.人体缺钠会导致甲状腺疾病 |
【知识点】 钠
 变灰暗
变灰暗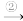 变白色
变白色 出现液滴
出现液滴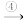 白色固体,则下列说法正确的是
白色固体,则下列说法正确的是| A.①发生氧化还原反应生成了过氧化钠 |
| B.④只发生物理变化 |
| C.③是碳酸钠吸收空气中的水蒸气形成了溶液 |
| D.②④主要是非氧化还原反应 |
【知识点】 钠与氧气等非金属的反应解读 碳酸钠
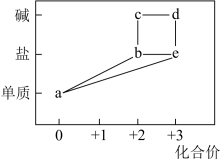
A. 可与 可与 反应生成 反应生成 |
B. 既可被氧化,也可被还原 既可被氧化,也可被还原 |
C.可将 加入浓碱液中制得 加入浓碱液中制得 的胶体 的胶体 |
D.可存在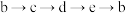 的循环转化关系 的循环转化关系 |
【知识点】 胶体的制备解读 铁三角转化条件分析及判断解读
 的化合物,该化合物可以看作是由
的化合物,该化合物可以看作是由 和
和 组成的复杂化合物,该化合物可以表示为
组成的复杂化合物,该化合物可以表示为A.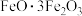 | B. | C.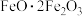 | D. |
| 选项 | 反应情况设想 | 评价 |
| A | 当铁、铜均无剩余时,溶液中一定有 、 、 ,一定无 ,一定无 | 正确, 和Fe、Cu均可反应 和Fe、Cu均可反应 |
| B | 当铁、铜均有剩余时,溶液中一定有 、 、 ,无 ,无 | 正确,Fe和Cu与 都反应,故有 都反应,故有 和 和 ,无 ,无 |
| C | 当铜有剩余,铁无剩余时,溶液中一定只有 ,无 ,无 | 正确,Cu有剩余,故无 |
| D | 当铁有剩余,铜无剩余时,溶液中一定有 、 、 | 不正确,不可能有Fe剩余而无Cu剩余,因为Fe比Cu优先与 反应 反应 |
| A.A | B.B | C.C | D.D |
【知识点】 Fe、Cu与Fe3+反应几种情况分析及判断
四、填空题 添加题型下试题
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并标出电子转移的方向和数目
囗NaIO3+囗NaHSO3→ 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为
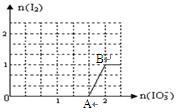
(3)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式
五、解答题 添加题型下试题
(1)现需配制250mL0.1000mol•L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、玻璃棒、烧杯外,还需要
(2)需准确称取Na2S2O3固体的质量为
(3)另取50.00mL废水,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO
 全部转化为Cr2O
全部转化为Cr2O ,再向其中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关反应的离子方程式为Cr2O
,再向其中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关反应的离子方程式为Cr2O +6S2O
+6S2O +14H+==2Cr3++3S4O
+14H+==2Cr3++3S4O +7H2O。则该工厂废水中Ba2+的物质的量浓度为
+7H2O。则该工厂废水中Ba2+的物质的量浓度为探究Ⅰ
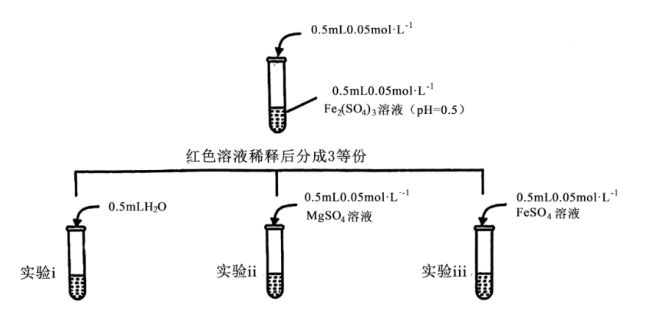
(1)配制FeSO4溶液应使用
(2)已知溶液颜色越深,色度越大。测得实验i,ii,iii色度数据如表:
| 实验 | i | ii | iii |
| 色度 | 0.075 | 0.049 | 0.015 |
探究Ⅱ
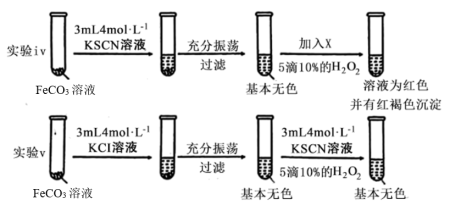
(3)X为
(4)在探究Ⅰ的基础上进行探究Ⅱ的目的为
(5)分析可利用KSCN溶液检测Fe2+、Fe3+混合溶液中Fe3+的原因:
【知识点】 Fe2+的鉴别及其应用解读 铁盐的检验解读 化学实验探究
六、计算题 添加题型下试题
 的金属,就铝的这一特殊性质,回答下列问题:
的金属,就铝的这一特殊性质,回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得
 的体积之比是
的体积之比是(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,产生
 的体积之比是
的体积之比是(3)足量的两份铝分别投入到等体积、一定物质的量浓度的
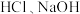 溶液中,二者产生的
溶液中,二者产生的 相等,则
相等,则 和
和 的物质的量浓度之比是
的物质的量浓度之比是(4)甲、乙两烧杯中各盛有
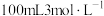 的盐酸和
的盐酸和 溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为
溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为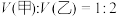 ,则加入铝粉的质量为___________(填字母)。
,则加入铝粉的质量为___________(填字母)。A.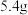 | B.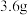 | C.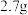 | D.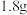 |
试卷分析
试卷题型(共 24题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 含硅的无机非金属材料 新型陶瓷 | |
| 2 | 0.65 | 氧化还原反应在生活、生产中的应用 常见金属的冶炼 | |
| 3 | 0.65 | 酸碱中和滴定原理的应用 弱电解质的电离平衡 | |
| 4 | 0.94 | 电解质与非电解质 强电解质和弱电解质的判断 强电解质与弱电解质 | |
| 5 | 0.4 | 离子方程式的正误判断 强电解质与弱电解质 电解池电极反应式及化学方程式的书写与判断 酯的水解反应机理 | |
| 6 | 0.65 | 物质水溶液的导电性 离子反应在化合物组成的分析、鉴定的应用 物质性质的探究 | |
| 7 | 0.85 | 离子反应在化合物组成的分析、鉴定的应用 离子的检验 常见阳离子的检验 常见阴离子的检验 | |
| 8 | 0.85 | 限定条件下的离子共存 | |
| 9 | 0.65 | 微粒半径大小的比较方法 原子序数与元素在周期表中的位置的关系分析及利用 离子键的实质与形成 | |
| 10 | 0.65 | 氧化还原反应的应用 氧化还原反应在生活、生产中的应用 | |
| 12 | 0.85 | 氧化还原反应的几组概念 常见氧化剂与还原剂 与氧化剂、还原剂有关的计算 电子转移计算 | |
| 13 | 0.85 | 胶体 胶体的性质和应用 | |
| 14 | 0.85 | 阿伏加德罗常数的应用 气体物质与NA相关的推算 物质结构基础与NA相关推算 | |
| 15 | 0.85 | 钠 | |
| 16 | 0.65 | 钠与氧气等非金属的反应 碳酸钠 | |
| 17 | 0.94 | 氯气与碱溶液反应 | |
| 18 | 0.65 | 胶体的制备 铁三角转化条件分析及判断 | |
| 19 | 0.94 | 酸、碱、盐、氧化物的概念及其相互联系 铁的氧化物 探究物质组成或测量物质的含量 | |
| 20 | 0.65 | Fe、Cu与Fe3+反应几种情况分析及判断 | |
| 二、多选题 | |||
| 11 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应的应用 氧化还原反应的规律 | |
| 三、填空题 | |||
| 21 | 0.65 | 氧化还原反应基本概念 氧化还原反应有关计算 氧化还原反应方程式的配平 氧化还原反应的规律 | |
| 四、解答题 | |||
| 22 | 0.65 | 物质的量浓度计算-溶液配制有关计算 酸碱中和滴定原理的应用 配制一定物质的量浓度的溶液实验的仪器 物质含量的测定 | 实验探究题 |
| 23 | 0.65 | Fe2+的鉴别及其应用 铁盐的检验 化学实验探究 | 实验探究题 |
| 五、计算题 | |||
| 24 | 0.65 | 化学方程式计算中物质的量的运用 铝与酸溶液反应 铝与强碱溶液反应 | |



