湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题
湖南
高一
阶段练习
2022-12-15
121次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础
湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题
湖南
高一
阶段练习
2022-12-15
121次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 下列对合金的说法正确的是
| A.合金中至少含有两种金属元素 |
| B.合金中的金属元素以化合物的形式存在 |
| C.黄铜是纯净物 |
| D.合金中也可含非金属元素 |
【知识点】 金属材料的性质及利用
您最近一年使用:0次
2016-12-09更新
|
196次组卷
|
4卷引用:2015-2016学年广东省深圳高级中学高一上期末化学试卷
单选题
|
容易(0.94)
名校
解题方法
2. 下列溶液中的 与50mL 1mol/L FeCl3溶液中的
与50mL 1mol/L FeCl3溶液中的 相等的是
相等的是
 与50mL 1mol/L FeCl3溶液中的
与50mL 1mol/L FeCl3溶液中的 相等的是
相等的是| A.150mL 1mol/L NaCl溶液 | B.100mL 2mol/L NH4Cl溶液 |
| C.150mL 3mol/L KCl溶液 | D.75mL 1mol/L BaCl2溶液 |
【知识点】 物质的量浓度与溶质成分有关的计算解读
您最近一年使用:0次
2022-11-20更新
|
225次组卷
|
6卷引用:2015-2016学年江苏省盐城市第四中学高一上学期期中考试化学试卷
单选题
|
较易(0.85)
名校
3. 下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
| 选项 | A | B | C | D |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Al2O3 |
| Y | FeCl3 | CuCl2 | Al | Fe2O3 |
| Z | Cl2 | Fe | NaOH溶液 | NaOH溶液 |
| A.A | B.B | C.C | D.D |
【知识点】 铁盐、亚铁盐相互除杂解读 物质分离、提纯的常见化学方法解读
您最近一年使用:0次
2018-12-16更新
|
247次组卷
|
4卷引用:【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期12月月考化学试题
单选题
|
较易(0.85)
名校
4. 下列关于1mol/LNa2CO3溶液的说法正确的是(Na2CO3相对分子质量为106)
| A.溶液中含有2molNa+ |
| B.溶液中Na+物质的量浓度为2mol/L |
| C.将106gNa2CO3溶于1L水可配制成该浓度溶液 |
| D.从1L溶液中去除500mL后,剩余溶液的浓度为0.5mol/L |
【知识点】 物质的量浓度
您最近一年使用:0次
2021-10-24更新
|
320次组卷
|
5卷引用:广东省惠州市2020-2021学年高一上学期期末质量检测化学试题
单选题
|
适中(0.65)
名校
5. 下列说法不正确 的是
A. 为白色固体,易被空气氧化 为白色固体,易被空气氧化 |
B.工业上常用 和 和 直接化合的方法生产氯化氢以制得盐酸 直接化合的方法生产氯化氢以制得盐酸 |
C.实验室常用 溶液吸收多余的 溶液吸收多余的 以避免污染 以避免污染 |
D.某溶液中加入 , , 层显紫色,证明原溶液中存在 层显紫色,证明原溶液中存在 |
您最近一年使用:0次
2021-09-16更新
|
424次组卷
|
3卷引用:浙江省宁波市镇海中学2020-2021学年高一上学期期末考试化学试卷
单选题
|
适中(0.65)
名校
解题方法
6. K2FeO4具有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4,其制备的流程如下:

K2FeO4能溶于水,微溶于浓KOH溶液,“转化1”有FeO 生成。下列有关说法正确的是
生成。下列有关说法正确的是

K2FeO4能溶于水,微溶于浓KOH溶液,“转化1”有FeO
 生成。下列有关说法正确的是
生成。下列有关说法正确的是| A.K2FeO4中铁元素的化合价是+3 |
B.“转化1”发生反应的离子方程式为:2Fe3++3ClO—+5H2O=2 +3Cl—+10H+ +3Cl—+10H+ |
| C.“转化2”能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小 |
| D.过滤所得产品可用冷水洗去表面杂质离子 |
您最近一年使用:0次
2021-07-31更新
|
525次组卷
|
5卷引用:黑龙江省大庆实验中学2020-2021学年高二下学期期末化学试题
单选题
|
较易(0.85)
名校
解题方法
7. 下列关于物质用途的说法中,错误的是
| A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2 |
| B.镁铝合金大量用于导弹、飞机部件制造 |
| C.硫酸亚铁可用于生产防治缺铁性贫血的药剂 |
| D.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良 |
您最近一年使用:0次
2021-12-21更新
|
86次组卷
|
2卷引用:湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题
单选题
|
适中(0.65)
名校
8. 已知:①在淀粉KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝;②在上述蓝色溶液中,滴加过量的Na2SO3溶液,蓝色逐渐消失;③取实验②生成的溶液滴加BaCl2溶液,有白色沉淀生成。下列判断正确的是
| A.上述实验证明氧化性:ClO->I2>SO42- |
| B.上述实验③中的白色沉淀是BaSO4,一定不含有BaSO3 |
| C.实验①中硫酸的作用是作氧化剂和酸化剂 |
| D.实验②证明SO32-既有氧化性又有还原性 |
【知识点】 氧化性、还原性强弱的比较解读 氧化还原反应的规律解读
您最近一年使用:0次
2018-01-27更新
|
387次组卷
|
9卷引用:云南省腾冲市第八中学2017-2018学年高一上学期期末考试化学试题
云南省腾冲市第八中学2017-2018学年高一上学期期末考试化学试题2019-2020学年新新教材同步人教版高中化学必修第一册 (模块)质量检测四川省宜宾市第四中学校2019-2020学年高二下学期期中考试化学试题四川省遂宁市船山区第二中学校2019-2020学年高一下学期期中考试化学试题湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题吉林省吉林市2021-2022学年高一上学期期末考试化学试题湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题湖北省襄阳市第五中学2022-2023学年高一上学期12月月考化学试题湖南省常德石门一中2023-2024年上学期高一年级化学期末考试卷(适用湖南地区))
单选题
|
适中(0.65)
名校
解题方法
9. 已知三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,③2KMnO4+16HCl(浓)= 2KCl+2MnCl2+8H2O+5Cl2↑。若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.FeCl3 | D.HCl |
【知识点】 氧化性、还原性强弱的比较解读 氧化还原反应的规律解读
您最近一年使用:0次
2021-07-27更新
|
6107次组卷
|
168卷引用:2010年黑龙江“五校联谊”高一上学期期末考试化学卷
(已下线)2010年黑龙江“五校联谊”高一上学期期末考试化学卷(已下线)2010—2011学年黑龙江省哈六中高一上学期期末考试化学试卷(已下线)2012届山东省微山一中高三第二次质量检测化学试卷(已下线)2012届辽宁省沈阳四校协作体高三上学期12月月考化学试卷(已下线)2012届山东省济宁市邹城二中高三第二次质量检测化学试卷(已下线)2011-2012学年北京四中高一上学期期中考试化学试卷(已下线)2012-2013学年河北省邢台一中高一上学期第三次月考化学试卷(已下线)2012年鲁科版高中化学必修1 3.4海水中的化学元素练习卷(已下线)2012-2013学年黑龙江省集贤县第一中学高一上学期期末考试化学试卷(已下线)2013-2014学年安徽省安庆一中高一上学期期中考试化学试卷(已下线)2013-2014福建省南安一中高二下学期期末考试化学试卷(已下线)2015届福建省四地六校高三上学期第一次月考化学试卷2014-2015学年山东省淄博市高二下学期期末统考化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷2015-2016学年山西省怀仁一中高一12月月考化学试卷2015-2016学年福建省福州八中高一上学期期末化学试卷2015-2016学年浙江乐成寄宿中学高一下3月月考化学试卷2015-2016学年湖北省保康一中高一下第一次月考化学试卷2016-2017学年广东省普宁一中高二上第二次月考化学试卷2016-2017学年黑龙江牡丹江高级中学高一上期中化学卷2016-2017学年山西省怀仁一中高一上月考三化学卷河南省南阳市2016-2017学年高一上学期期终质量评估化学试题2016-2017学年新疆兵团农二师华山中学高一下学期学前考试化学试卷山西省忻州市第一中学2016-2017学年必修一:化学物质及其变化同步练习化学试题贵州省大方县第一中学2018届高三上学期第一次月考化学试题湖南省醴陵二中、醴陵四中2017-2018学年高一上学期期中联考化学试题辽宁省六校协作体2017-2018学年高一上学期期中考试化学试卷山西省运城中学、芮城中学2017-2018学年高一上学期期中联考化学试题辽宁省沈阳铁路实验中学2017-2018学年高一上学期期中考试化学试题湖北省宜昌市第一中学2017-2018学年高一上学期期中考试化学试题2山西省临汾第一中学2017-2018学年高一上学期第二次调研(期中)考试化学试题河北省石家庄市第二中学2017-2018学年高一12月月考化学试题浙江省定海一中2017-2018学年高一第一学期期中考试化学试卷甘肃省武威市第六中学2017-2018学年高一上学期期末考试化学试题湖北省宜昌市第一中学2017-2018学年高一上学期期中考试化学试题3甘肃省嘉峪关市酒钢三中2017-2018学年高一上学期第二次月考化学试题河南省周口市2017-2018学年高一上学期期末考试 化学内蒙古通辽实验中学2017-2018学年高一上学期期末考试化学试题【全国百强校】河北省辛集中学2017-2018学年高二6月月考化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【押题专练】山东省德州市武城县第二中学2019届高三9月月考化学试题陕西省渭南市尚德中学2019届高三上学期第一次教学质量检测化学试题(已下线)2018年10月7日 《每日一题》人教必修1-每周一测【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期期中考试化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高一上学期期中考试化学试题河南省安阳市第二中学2018-2019学年高一上学期期中考试化学试题江西省奉新县第一中学2018-2019学年高一上学期第三次月考化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点步步为赢 高二化学暑假作业:作业三 氧化还原反应湖南省衡阳县第四中学2020届高三366班(实验班)8月月考化学试题鲁科版(2019)新教材化学同步2.3.2 氧化还原反应的应用 练习(已下线)2019年10月6日《每日一题》必修1 —— 每周一测陕西省西安中学2020届高三上学期第一次月考化学试题上海中学2017-2018学年高一(上)期中化学试卷吉林省油田第十一中学2020届高三上学期第一次阶段考试化学试题上海市宝山中学2017-2018学年高三第一学期期中考化学试题天津市南开中学滨海生态城学校2019-2020高一上学期期中考试化学试题甘肃省兰州第一中学2019-2020学年高一上学期期中考试化学试题河北省唐山市第一中学2019-2020学年高一上学期期中考试化学试题云南省玉溪市玉溪一中2019-2020学年高一上学期期中考试化学试题吉林省延边第二中学2019-2020学年高一上学期期中考试化学试题(已下线)【新东方】高中化学5004山东省微山县第二中学2019-2020学年高一上学期第二学段质量检测化学试题黑龙江省鹤岗市第一中学2019-2020学年高一12月月考化学试题江西省抚州市临川区第二中学2019-2020学年高一上学期第二次月考化学试题云南师范大学附属中学2019-2020学年高一上学期期中考试化学试题云南省金平县第一中学2019-2020学年高一上学期期末考试化学试题新疆沙湾一中2019-2020学年高一上学期期末考试化学试题人教版高一化学必修1第二章《化学物质及其变化》测试卷云南省昭通市水富县第二中学2019-2020学年高一上学期期末考试化学试题重庆市云阳县江口中学2019-2020学年高一上学期第二次月考化学试题云南省大理市下关第一中学2019-2020学年高一上学期期末考试化学试题湖南师大附中2019-2020学年高一上期期末考试化学试题安徽省淮北市第一中学2019-2020学年高一下学期2月在线测试化学试题四川省攀枝花市第十五中学2019-2020学年高一下学期第二次月考化学试题陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题(已下线)【新东方】化学巩固练习34四川省凉山州2019-2020学年高二下学期期末检测化学(理)试题(已下线)2.3.2 氧化还原反应的应用 练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第08讲 氧化还原反应的基本概念和规律(精讲)——2021年高考化学一轮复习讲练测辽宁省沈阳市郊联体2019-2020学年高二下学期期末考试化学试题湖南师范大学附属中学2019-2020学年高一上学期期末考试化学试题(已下线)专题04 氧化还原反应(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学苏教版(2020)高一必修第一册专题3第三单元 海洋化学资源的综合利用河南省平顶山市舞钢市第一高级中学2021届高三9月月考化学试题江西省九江市第一中学2019-2020学年高二下学期期末考试化学试题鲁科版(2019)高一必修第一册第二章易错疑难集训(二)(已下线)1.3.3 氧化还原反应的规律及应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 教材帮上海市2019-2020学年高一上学期期中考试化学试题黑龙江省绥化市第一中学2020-2021学年高一上学期第一次月考化学试题北京中国人民大学附属中学2020-2021学年高一上学期第一次检测化学试题吉林省(长春市)榆树市第一高级中学2021届高三10月月考化学试题黑龙江省绥化市第一中学2020-2021学年高一上学期第二次月考化学试题安徽省合肥一中2020-2021学年高一上学期第一次段考化学试题高一必修第一册(苏教2019)专题3 第一单元 氯气及氯的化合物1福建省厦门市湖滨中学2021届高三10月月考化学试题高一必修第一册(苏教2019) 模块综合测评甘肃省张掖市第二中学2020-2021学年高一上学期期中考试化学试题黑龙江省牡丹江市东宁市第一中学2020-2021学年高一上学期月考化学试题安徽省蚌埠第三中学2019-2020学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一上学期期中考试化学试题湖南省常德市第一中学2020-2021学年高一上学期第2次月考化学试题(已下线)【浙江新东方】绍兴qw81(已下线)【浙江新东方】在线化学20甘肃省张掖市2020-2021学年高一上学期期末学业水平质量检测化学试题天津市河东区第八中学2021届高三上学期期中化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00145】(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00137】(已下线)第06讲 氧化还原反应(精讲)-2022年一轮复习讲练测(已下线)专题1.3.3 氧化剂、还原剂(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)第3课时 氧化还原反应的基本规律和配平(课中)——课前、课中、课后同步专题精编(人教版2019必修第一册)山东省济宁市实验中学2022届高三上学期开学考试化学试题甘肃省静宁县第一中学2022届高三上学期第一次月考化学试题(已下线)3.1.3 氧化还原反应-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)黑龙江省双鸭山市第一中学2020-2021学年高一第二次月考化学试题黑龙江省大庆实验中学2021-2022学年高一上学期10月月考化学试题黑龙江省哈尔滨市德强高级中学2021-2022学年高一上学期10月月考化学试题浙江省台州市七校联盟2020-2021学年高一上学期期中联考化学试题天津市南开中学2021-2022学年高一上学期期中考试化学试题(已下线)易错专题08 氧化还原反应规律的应用及相关计算-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)重庆市育才中学校2021-2022学年高一上学期期中考试化学试题 广东省梅州市大埔县虎山中学2021-2022学年高一上学期第一次段考(11月)化学试题(已下线)第07练 氧化还原反应-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)上海市崇明区民本中学2020-2021学年高二上学期期中考试化学试题湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第三次考试化学试题贵州省毕节市第一中学2021-2022学年高一上学期第二次阶段性考试化学试题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题吉林省延边第二中学2022-2023学年高三上学期开学调研考试化学试题吉林省长春市东北师范大学附属中学2022-2023学年高一上学期阶段考试化学试题四川省凉山州西昌天立中学2021-2022学年高二下学期5月月考化学试题浙江省台州市书生中学2022-2023学年高一上学期第一次月考化学试题天津市北辰区2022-2023学年高三上学期第一次联考化学试题广东省广州市育才中学2022-2023学年高一上学期期中考试化学试题陕西省西安市陕西师范大学附属中学2020-2021学年高一上学期期中考试化学试题陕西省西安中学2022-2023学年高一上学期期中考试化学试题湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题安徽省六安中学2021-2022学年高一上学期期中考试化学试题黑龙江牡丹江农管局密山农垦子弟学校2021-2022学年高一上学期期末考试化学试题广西贺州市钟山县钟山中学2020-2021学年高一上学期期末考试化学试题(已下线)第一章 化学物质及其变化 第5练 氧化还原反应的计算与方程式的配平(已下线)题型18 氧化还原反应规律的应用(已下线)【新东方】化学出门测1234重庆市育才中学2021-2022学年高一上学期期中考试化学试题北京市中国人民大学附属中学2020-2021学年高一下学期第一次检测化学试题广东省广州市育才中学2022-2023学年高一上学期期中考试化学试题甘肃省嘉峪关市等3地2022-2023学年高一上学期12月期中考试化学试题广东省普宁市华侨中学2022-2023学年高一上学期(11月)期中考试化学试题(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)微专题(二)——氧化还原反应的简单规律及应用重庆市大足中学2022-2023学年高一上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高一上学期开学考试化学试题浙江省台州市路桥中学2023-2024学年高一上学期10月月考化学试题天津市南开中学2023-2024学年高三上学期第二次考试化学试题浙江省台州市第一中学2022-2023学年高一上学期11月期中考试化学试题浙江省杭州市西湖高级中学2023-2024学年高一上学期10月月考化学试题辽宁省大连市瓦房店市高级中学2022-2023学年高一上学期期中考试化学试卷 天津市第五十四中学2023-2024学年高一上学期第二次月考(12月考)化学试题陕西省咸阳市实验中学2023-2024学年高一上学期段性检测(一)化学试题天津市实验中学滨海学校2023-2024学年高一上学期期中质量调查化学试题
单选题
|
适中(0.65)
名校
解题方法
10. 研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法表示更便于理解。下列表达正确的是
A.Na2CO3溶液和盐酸反应后溶液中的钠盐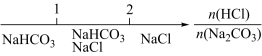 |
B.NaOH溶液与CO2反应后溶液中的钠盐 |
C.常温下钠与氧气的反应生成的氧化物 |
D.AlCl3溶液中滴加氨水后铝元素的存在形式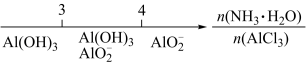 |
您最近一年使用:0次
2021-01-07更新
|
1040次组卷
|
5卷引用:辽宁省五校联考2020-2021学年高一上学期期末考试化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
11. NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,0.1mol H2O所占的体积约为2.24L |
| B.11.2 L CO2的物质的量为0.5 mol |
| C.1mol NH3的质量等于NA个氨分子的质量之和 |
| D.常温下18g水和标准状况下22.4L O2分子数均为NA |
【知识点】 物质的量有关计算
您最近一年使用:0次
2022-11-20更新
|
85次组卷
|
2卷引用:湖南省长沙市明德中学2021-2022学年高一上学期12月第三次月考化学试题
多选题
|
适中(0.65)
名校
解题方法
12. 如图,密闭汽缸被一不漏气可滑动的活塞隔开两部分,左边充有氮气,右边充有H2和O2,在室温下右边的气体点燃,反应后冷却至原室温,活塞最终静止于汽缸的中点(液体体积忽略不计),则原来氢气和氧气的体积比可能是
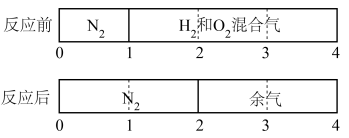

| A.2:7 | B.7:2 | C.4:5 | D.8:1 |
【知识点】 阿伏加德罗定律的应用解读
您最近一年使用:0次
2022-11-20更新
|
84次组卷
|
2卷引用:湖南省长沙市明德中学2021-2022学年高一上学期12月第三次月考化学试题
多选题
|
较易(0.85)
名校
解题方法
13. 为了探究铁单质与水蒸气在高温下的反应,某化学小组设计了如图的实验(夹持装置已略)。下列说法正确的是
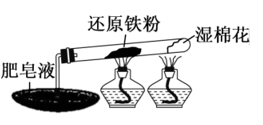

| A.点燃肥皂泡可观察到深蓝色火焰 |
| B.为了使加热效果更好,可使用酒精喷灯 |
| C.该反应中水蒸气作氧化剂 |
| D.实验结束后,得到黑色固体Fe2O3 |
您最近一年使用:0次
2021-02-20更新
|
151次组卷
|
3卷引用:河北省石家庄六县区2020-2021学年高一上学期期末化学联考试题
多选题
|
适中(0.65)
名校
14. 某研究性学习小组从腐蚀印刷电路板的废液(含有FeCl2、FeCl3、CuCl2)中回收铜并制备氯化铁晶体,设计流程如图:
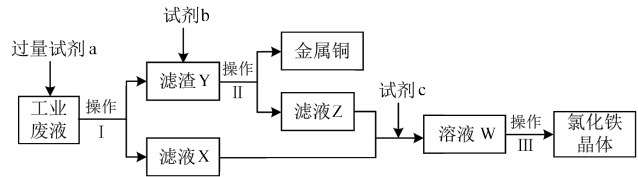
下列说法正确的是

下列说法正确的是
| A.试剂a是铁、试剂b是稀硫酸 |
| B.操作Ⅰ、Ⅱ、Ⅲ都用到玻璃棒 |
| C.若试剂c是双氧水和盐酸,相应的反应为2Fe2++H2O2+2H+=2Fe3++2H2O |
| D.氯化铁晶体溶于水显绿色 |
您最近一年使用:0次
2022-02-20更新
|
136次组卷
|
2卷引用:湖南省常德市鼎城区第一中学2021-2022学年高一上学期12月月考化学试题
三、填空题 添加题型下试题
15. ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得:(已知H2C2O4中的碳为+3价) 。回答下列问题。
。回答下列问题。
(1)该反应中氧化产物的化学式是_______ ;被还原的元素是_______ 。
(2)若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为_______ mol,消耗的还原剂的物质的量为_______ mol。
(3)用双线桥标出上述反应的电子转移情况_____ 。
2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2↑+2H2O
(4)标准状况下44.8mL的ClO2气体恰好能与50mL0.1mol/L的Na2SO3溶液液完全反应,生成Na2SO4,氯元素在产物中的化合价为_______
 。回答下列问题。
。回答下列问题。(1)该反应中氧化产物的化学式是
(2)若反应共产生了4.48L气体(标准状况),则反应转移电子的物质的量为
(3)用双线桥标出上述反应的电子转移情况
2KClO3+H2C2O4+H2SO4=2ClO2+K2SO4+2CO2↑+2H2O
(4)标准状况下44.8mL的ClO2气体恰好能与50mL0.1mol/L的Na2SO3溶液液完全反应,生成Na2SO4,氯元素在产物中的化合价为
您最近一年使用:0次
2021-06-20更新
|
786次组卷
|
4卷引用:四川省成都市实验外国语学校(西区)2019-2020学年高一上学期11月月考化学试题
填空题
|
适中(0.65)
名校
16. 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。氯气、漂白液、漂白粉都是生活中常用的含氯消毒剂。家庭中常常使用的消毒剂主要是84消毒液,可以说化学让生活更美好。下图为84消毒液说明书。请回答下列问题。
(1)84消毒液的有效氯指的是每升含氯消毒剂的氧化能力(得失电子数)相当于多少克Cl2的氧化能力(Cl均转化为Cl-)。若该84消毒液商品的有效氯按53.25g·L-1计算,该消毒液的NaClO的物质的量浓度是___________ 。
(2)常温下用烧碱溶液吸收Cl2制备84消毒液。写出该反应的离子方程式:___________ ,若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为___________ ,从氧化还原角度分析Cl2表现了___________ 性。
(3)家庭用84消毒液用法强调,为家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是(用离子方程式表示)___________ (已知酸性:H2CO3>HClO>HCO )。
)。
(4)游泳池水的消毒多用漂粉精,但酸碱性对漂粉精的消毒效果影响明显。池水碱性过强,杀毒作用会___________ (填“增强”或“减弱”)。
(5)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、84消毒液,主要目的是___________。
 | 药品名称 | 84消毒液 |
| 主要成分 | NaClO,有效氯含量50.00g·L-1~60.00g·L-1 | |
| 注意事项 | 不可与其他洗涤剂或消毒液混合使用 | |
| 用法用量 | 稀释后浸泡或洗刷白色衣物、浴缸等1∶200水溶液 餐饮具、瓜果等1∶100水溶液 |
(2)常温下用烧碱溶液吸收Cl2制备84消毒液。写出该反应的离子方程式:
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(3)家庭用84消毒液用法强调,为家庭物品消毒时,要做适当的稀释,喷洒后也不要急于用清水擦拭,要浸泡,这样效果会更好,原因是(用离子方程式表示)
 )。
)。(4)游泳池水的消毒多用漂粉精,但酸碱性对漂粉精的消毒效果影响明显。池水碱性过强,杀毒作用会
(5)Cl2可直接用于杀菌消毒,但常常把氯气制成漂白粉、84消毒液,主要目的是___________。
| A.增强漂白能力和消毒作用 |
| B.使它转化为较稳定物质,便于保存和运输 |
| C.使它转化为较易溶于水的物质 |
| D.提高氯的质量分数,有利于漂白、消毒 |
您最近一年使用:0次
2021-12-21更新
|
183次组卷
|
2卷引用:湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题
四、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
解题方法
17. 工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。(碱石灰能吸收水和二氧化碳)
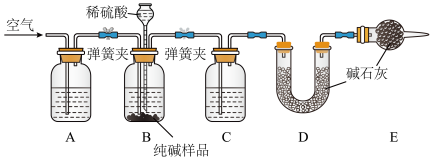
(1)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_______ ,说明装置不漏气。
(2)装置A中的试剂为_______ ,装置C中的试剂为_______ 。
(3)实验结束后通入空气的目的:_______ 。
(4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为_______ (保留小数点后一位);若缺少E装置,会使测定结果_______ (填“偏高”或“偏低”)。

(1)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(2)装置A中的试剂为
(3)实验结束后通入空气的目的:
(4)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2022-11-20更新
|
92次组卷
|
2卷引用:湖南省长沙市明德中学2021-2022学年高一上学期12月第三次月考化学试题
解答题-实验探究题
|
较难(0.4)
名校
18. 氢化钙( )固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
Ⅰ.固体 的部分性质:常温:
的部分性质:常温: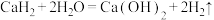
Ⅱ.金属 的部分性质:①
的部分性质:① (固体)②
(固体)② 的金属活动顺序介于K和
的金属活动顺序介于K和 之间
之间
【进行实验】
该小组同学设计的制取装置如图所示(固定装置略),回答下列问题:
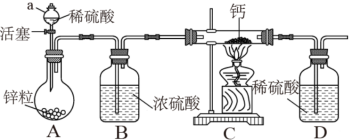
(1)写出 常温遇水发生反应的化学方程式
常温遇水发生反应的化学方程式___________ 。
(2)仪器a的名称___________ ;组装好仪器后,先进行的操作是___________ 。
(3)D中浓硫酸的作用为___________ 。
(4)实验时,先___________ (填“打开A中活塞”或“点燃C中酒精灯”),目的是___________ 。
【实验反思】
(5)实验结束后,甲同学取少量C装置中的固体小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,甲同学据此推断上述实验有 生成,乙同学否定了甲同学的结论原因是
生成,乙同学否定了甲同学的结论原因是___________ 。
该小组同学通过反思提出问题:如何检验制得的 是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
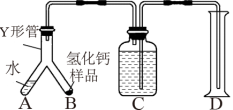
步骤1:检查装置气密性,装入足量的水和质量为mg的 样品,按图连接仪器。
样品,按图连接仪器。
步骤2:倾斜Y形管,使A中的水全部进入B,样品完全反应后,冷却至室温,量筒读数为V 。
。
(6)当
___________  时(用m、
时(用m、 表示),表明制得的
表示),表明制得的 样品是纯净的。(该实验条件下的气体摩尔体积为
样品是纯净的。(该实验条件下的气体摩尔体积为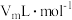 )
)
 )固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。
)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙。【查阅资料】
Ⅰ.固体
 的部分性质:常温:
的部分性质:常温: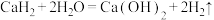
Ⅱ.金属
 的部分性质:①
的部分性质:① (固体)②
(固体)② 的金属活动顺序介于K和
的金属活动顺序介于K和 之间
之间【进行实验】
该小组同学设计的制取装置如图所示(固定装置略),回答下列问题:

(1)写出
 常温遇水发生反应的化学方程式
常温遇水发生反应的化学方程式(2)仪器a的名称
(3)D中浓硫酸的作用为
(4)实验时,先
【实验反思】
(5)实验结束后,甲同学取少量C装置中的固体小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,甲同学据此推断上述实验有
 生成,乙同学否定了甲同学的结论原因是
生成,乙同学否定了甲同学的结论原因是该小组同学通过反思提出问题:如何检验制得的
 是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
是否纯净?他们再次设计实验进行检验,实验步骤如下(固定装置略):
步骤1:检查装置气密性,装入足量的水和质量为mg的
 样品,按图连接仪器。
样品,按图连接仪器。步骤2:倾斜Y形管,使A中的水全部进入B,样品完全反应后,冷却至室温,量筒读数为V
 。
。(6)当

 时(用m、
时(用m、 表示),表明制得的
表示),表明制得的 样品是纯净的。(该实验条件下的气体摩尔体积为
样品是纯净的。(该实验条件下的气体摩尔体积为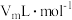 )
)
您最近一年使用:0次
2021-07-07更新
|
1070次组卷
|
4卷引用:广西百色市2020-2021学年高一下学期期末教学质量调研测试化学试题
解答题-无机推断题
|
适中(0.65)
名校
解题方法
19. A、B、C为中学常见单质。通常状况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体,它们之间转化关系如图所示(其中某些反应条件和部分反应物已略去)。请回答下列问题:

(1)写出下列物质的化学式:A_______ 、X_______ ;
(2)反应⑦的化学方程式是_______ ;
(3)D的溶液能腐蚀覆铜板制作印刷电路板,写出其反应的离子方程式_______ ;
(4)保存G溶液时要加入固体A的原因是_______ ;
(5)向G溶液中加入氢氧化钠溶液的现象是_______ ;
(6)向0.02mol A的氧化物中加入45mL 4mol/L硫酸溶液恰好完全反应,得到A的两种不同价态的盐,所得溶液中A2+能恰好被标准状况下672mL氯气氧化。则此A的氧化物的化学式为_______ 。

(1)写出下列物质的化学式:A
(2)反应⑦的化学方程式是
(3)D的溶液能腐蚀覆铜板制作印刷电路板,写出其反应的离子方程式
(4)保存G溶液时要加入固体A的原因是
(5)向G溶液中加入氢氧化钠溶液的现象是
(6)向0.02mol A的氧化物中加入45mL 4mol/L硫酸溶液恰好完全反应,得到A的两种不同价态的盐,所得溶液中A2+能恰好被标准状况下672mL氯气氧化。则此A的氧化物的化学式为
【知识点】 与“铁三角”有关的推断解读
您最近一年使用:0次
2022-11-20更新
|
227次组卷
|
2卷引用:湖南省长沙市明德中学2021-2022学年高一上学期12月第三次月考化学试题
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础
试卷题型(共 19题)
题型
数量
单选题
10
多选题
4
填空题
2
解答题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 金属材料的性质及利用 | |
| 2 | 0.94 | 物质的量浓度与溶质成分有关的计算 | |
| 3 | 0.85 | 铁盐、亚铁盐相互除杂 物质分离、提纯的常见化学方法 | |
| 4 | 0.85 | 物质的量浓度 | |
| 5 | 0.65 | 氯气与非金属单质的反应 氯气与碱溶液反应 溴、碘的性质 氢氧化亚铁的还原性 | |
| 6 | 0.65 | 氧化还原反应方程式的配平 铁盐 有关铁及其化合物转化的流程题型 常见无机物的制备 | |
| 7 | 0.85 | 碳酸钠 亚铁盐 Fe2+的还原性 | |
| 8 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应的规律 | |
| 9 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应的规律 | |
| 10 | 0.65 | 钠与氧气等非金属的反应 碳酸钠与盐酸的反应 氢氧化铝与强碱反应 | |
| 二、多选题 | |||
| 11 | 0.65 | 物质的量有关计算 | |
| 12 | 0.65 | 阿伏加德罗定律的应用 | |
| 13 | 0.85 | 铁与水蒸气的反应 | |
| 14 | 0.65 | 铁与铁离子反应 有关铁及其化合物转化的流程题型 物质分离、提纯的常见化学方法 | |
| 三、填空题 | |||
| 15 | 0.4 | 氧化还原反应的几组概念 单线桥、双线桥分析氧化还原反应 氧化还原反应有关计算 | |
| 16 | 0.65 | 物质的量浓度 氧化还原反应方程式的配平 基于氧化还原反应守恒规律的计算 漂白粉和漂粉精的制备原理 | |
| 四、解答题 | |||
| 17 | 0.65 | 化学方程式计算中物质的量的运用 碳酸钠、碳酸氢钠混合物的有关求算 探究物质组成或测量物质的含量 | 实验探究题 |
| 18 | 0.4 | 氧化还原反应方程式的配平 钠与水反应原理 常见无机物的制备 物质含量的测定 | 实验探究题 |
| 19 | 0.65 | 与“铁三角”有关的推断 | 无机推断题 |



