天津市河东区第八中学2021届高三上学期期中化学试题
天津
高三
期中
2021-01-24
501次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理、认识化学科学、化学实验基础
天津市河东区第八中学2021届高三上学期期中化学试题
天津
高三
期中
2021-01-24
501次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
您最近一年使用:0次
2019-01-30更新
|
2582次组卷
|
24卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷)(已下线)2015届江西省赣州市十二县高三上学期期中化学试卷2015届上海市长宁区高三上学期教学质量检测化学试卷2014-2015山东省临沂市高一上学期期期末统考化学试卷2016届江苏省扬州中学高三上学期10月月考化学试卷2016届江苏省清江中学高三上学期第三次月考化学试卷2016届黑龙江省绥化市第一中学高三上学期期中测试化学试卷2016届辽宁抚顺第一中学高三上第一次模拟考试化学试卷2015-2016学年河北省正定中学高二下期末化学试卷2015-2016学年黑龙江哈尔滨三中高二下期末化学试卷2017届黑龙江牡丹江高级中学高三上期中化学卷河南省南阳市第一中学2018届高三上学期第二次考试化学试题苏教版必修1高考题单元试卷:专题1 化学家眼中的物质世界(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第1讲 物质的分类( 教学案)山东省夏津县第一中学2018-2019学年高一下学期三月月考化学试题四川省南充高级中学2019-2020学年高二下学期期中考试化学试题黑龙江省哈尔滨市第一中学2019-2020 学年高二下学期期末考试化学试题新疆巴音郭楞蒙古自治州第一中学2021届高三上学期期中考试化学试题天津市河东区第八中学2021届高三上学期期中化学试题吉林省长春市第二十中学2020-2021学年高一下学期期末考试化学试题河北省承德隆化存瑞中学2021-2022学年高三上学期期中考试化学试题黑龙江哈尔滨师范大学附属中学2021-2022学年高二下学期期末测试化学试题江西省抚州市资溪县第一中学2022-2023学年高二下学期7月期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
2. 对于可逆反应A(g)+3B(s)  2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是| A.v(A)=0.5 mol·L-1·s-1 | B.v(B)=1.2 mol·L-1·s-1 |
| C.v(D)=0.4 mol·L-1·s-1 | D.v(C)=0.1 mol·L-1·s-1 |
您最近一年使用:0次
2021-01-12更新
|
355次组卷
|
4卷引用:天津市河东区第八中学2021届高三上学期期中化学试题
天津市河东区第八中学2021届高三上学期期中化学试题(已下线)第20讲 化学反应速率(精讲)-2022年一轮复习讲练测(已下线)专题21 化学反应速率(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练上海市吴淞中学2023-2024学年高二上学期第一学段考试化学试题
单选题
|
适中(0.65)
名校
解题方法
3. 工厂排放的废水中可能含有K+、Ag+、NH 、Mg2+、SO
、Mg2+、SO 、Cl-、NO
、Cl-、NO 、HCO
、HCO 等离子。经检测废水呈强碱性,则可确定该厂废水中肯定不含有的离子组合是( )
等离子。经检测废水呈强碱性,则可确定该厂废水中肯定不含有的离子组合是( )
 、Mg2+、SO
、Mg2+、SO 、Cl-、NO
、Cl-、NO 、HCO
、HCO 等离子。经检测废水呈强碱性,则可确定该厂废水中肯定不含有的离子组合是( )
等离子。经检测废水呈强碱性,则可确定该厂废水中肯定不含有的离子组合是( )A.Ag+、K+、NO 、HCO 、HCO | B.K+、NH 、NO 、NO 、SO 、SO |
C.Ag+、NH 、Mg2+、HCO 、Mg2+、HCO | D.K+、Mg2+、SO 、Cl- 、Cl- |
【知识点】 离子反应的发生条件解读 离子共存 离子反应在生活、生产中的应用解读
您最近一年使用:0次
2020-10-23更新
|
365次组卷
|
8卷引用:吉林省辽源市第五中学校2019-2020学年高一期中考试化学试题
单选题
|
较易(0.85)
名校
4. 用NA表示阿伏伽德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2 L SO3含有的分子数为0.5NA |
| B.含有NA个原子的氦气体积约为22.4 L |
| C.25 ℃、1.01×105 Pa时,44 g CO2中含有的氧原子数为2NA |
| D.1 mol NaOH溶解在1 L水中,则其100 mL溶液中Na+数为0.1NA |
您最近一年使用:0次
2019-01-08更新
|
184次组卷
|
4卷引用:河南省周口中英文学校2019届高三上学期第三次月考化学试题
单选题
|
容易(0.94)
名校
解题方法
5. 在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ·mol-1、285.8kJ·mol-1、870.3kJ·mol-1,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
| A.-488.3kJ·mol-1 | B.+488.3kJ·mol-1 |
| C.-191kJ·mol-1 | D.+191kJ·mol-1 |
您最近一年使用:0次
2020-08-20更新
|
2536次组卷
|
63卷引用:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷
(已下线)2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(已下线)2014年高中化学人教版选修四第一章 化学反应与能量练习卷(已下线)2013-2014黑龙江省鹤岗一中高一下学期期中考试化学试卷2015-2016学年黑龙江牡丹江一中高一下期中化学试卷2017届山西省重点中学协作体高三上学期开学考试化学试卷2017届河北邯郸市大名一中高三上学期第二次月考化学试卷2016-2017学年江西省师大附中高二上第一次月考化学试卷2016-2017学年甘肃省天水一中高二上月考一化学试卷2016-2017学年河北省张家口市第一中学高一3月月考(理)化学试卷黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题吉林省扶余一中2016-2017学年高一下学期期末考试化学试题吉林省扶余市第一中学2016-2017学年高一下学期期末考试化学试题2018届高三一轮复习化学:微考点46-盖斯定律的全面应用内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题四川省成都市七中实验学校2018届高三上学期入学考试化学试题河南省杞县2018-2019学年高二上学期10月月考化学试题【全国百强校】广西壮族自治区桂林市第十八中学2018-2019学年高二(理)上学期期中考试化学试题(已下线)2019年9月11日《每日一题》2020年一轮复习—— 反应热的计算辽宁省阜新市第二高级中学2019-2020学年高二上学期第一次月考化学试题山西大学附中2019-2020学年高二上学期第一次月考化学试题辽宁省实验中学东戴河分校2019-2020学年高二10月月考化学试题河北省鹿泉第一中学2019-2020学年高二9月月考化学试题安徽省青阳县第一中学2019-2020学年高二9月月考化学试题四川省武胜烈面中学2019-2020学年高二10月月考化学试题江西省南昌市八一中学、洪都中学、十七中三校2019-2020学年高二10月联考化学试题云南省玉溪市玉溪一中2019-2020学年高二上学期第一次月考化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用2020届高三化学知识点强化训练—化学能与热能江苏省淮安市涟水县第一中学2020届高三上学期第二次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题辽宁省辽阳市辽阳县集美中学2020-2021学年高二上学期第一次月考化学试题(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)山东省临沂市沂水一中2020-2021学年高二9月月考化学试题陕西省渭南市澄城县城关中学2020-2021学年高二上学期第一次月考化学试题陕西省咸阳百灵中学2020-2021学年高二上学期第一次月考化学试题宁夏吴忠中学2020-2021学年高二10月月考理综化学试题湖南省长沙县第九中学2020-2021学年高二上学期第一次月考化学试题广东省深圳市第七高级中学2020-2021学年高二上学期第一学段考试化学试题陕西省西安市第一中学2020-2021学年高二上学期第一次月考化学试题贵州省思南中学2020-2021学年高二上学期期中考试化学试题(已下线)练习1 化学反应的热效应-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)天津市静海区第一中学2020-2021学年高二11月考化学试题天津市河东区第八中学2021届高三上学期期中化学试题河北省衡水市武邑武罗学校2020-2021学年高二上学期期中考试化学试题湖北i省华中师范大学潜江附属中学2020-2021学年高二上学期入学考试化学试题福建省南安市柳城中学2020-2021学年高二上学期第一次月考化学试题河南省开封市五县2021-2022学年高二上学期月考联考化学试题广西南宁市宾阳县宾阳中学2021-2022学年高二上学期10月月考化学试题黑龙江省鸡东县第二中学2021-2022学年高二上学期期中考试化学(理)试题江苏省盐城市伍佑中学2021-2022学年高二下学期第一次阶段考试化学试题(已下线)第1章基础巩固测评卷-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)天津市实验中学滨海学校2021-2022学年高二上学期期中质量监测化学试题河南省南阳市第六完全学校高级中学2022-2023学年高二上学期9月半月考化学试题四川省邻水实验学校2021-2022学年高二上学期期中考试化学试题陕西省延安市黄龙县中学2021-2022学年高二上学期第一次月考化学试题四川省凉山彝族自治州2022-2023学年高二上学期期末检测化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第1单元01讲核心(已下线)专题01 反应热、焓变与热化学方程式【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)浙江省海宁市高级中学2022-2023学年高二上学期10月月考化学试题湖北省十堰市部分普通高中2023-2024学年高二上学期11月期中考试化学试题吉林省东北师范大学连山实验高中2023-2024学年高二上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
6. 已知三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,③2KMnO4+16HCl(浓)= 2KCl+2MnCl2+8H2O+5Cl2↑。若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.FeCl3 | D.HCl |
【知识点】 氧化性、还原性强弱的比较解读 氧化还原反应的规律解读
您最近一年使用:0次
2021-07-27更新
|
6107次组卷
|
168卷引用:2010年黑龙江“五校联谊”高一上学期期末考试化学卷
(已下线)2010年黑龙江“五校联谊”高一上学期期末考试化学卷(已下线)2010—2011学年黑龙江省哈六中高一上学期期末考试化学试卷(已下线)2012届山东省微山一中高三第二次质量检测化学试卷(已下线)2012届辽宁省沈阳四校协作体高三上学期12月月考化学试卷(已下线)2012届山东省济宁市邹城二中高三第二次质量检测化学试卷(已下线)2011-2012学年北京四中高一上学期期中考试化学试卷(已下线)2012-2013学年河北省邢台一中高一上学期第三次月考化学试卷(已下线)2012年鲁科版高中化学必修1 3.4海水中的化学元素练习卷(已下线)2012-2013学年黑龙江省集贤县第一中学高一上学期期末考试化学试卷(已下线)2013-2014学年安徽省安庆一中高一上学期期中考试化学试卷(已下线)2013-2014福建省南安一中高二下学期期末考试化学试卷(已下线)2015届福建省四地六校高三上学期第一次月考化学试卷2014-2015学年山东省淄博市高二下学期期末统考化学试卷2015-2016学年北大附中河南分校高一上9月考化学试卷2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷2015-2016学年山西省怀仁一中高一12月月考化学试卷2015-2016学年福建省福州八中高一上学期期末化学试卷2015-2016学年浙江乐成寄宿中学高一下3月月考化学试卷2015-2016学年湖北省保康一中高一下第一次月考化学试卷2016-2017学年广东省普宁一中高二上第二次月考化学试卷2016-2017学年黑龙江牡丹江高级中学高一上期中化学卷2016-2017学年山西省怀仁一中高一上月考三化学卷河南省南阳市2016-2017学年高一上学期期终质量评估化学试题2016-2017学年新疆兵团农二师华山中学高一下学期学前考试化学试卷山西省忻州市第一中学2016-2017学年必修一:化学物质及其变化同步练习化学试题贵州省大方县第一中学2018届高三上学期第一次月考化学试题湖南省醴陵二中、醴陵四中2017-2018学年高一上学期期中联考化学试题辽宁省六校协作体2017-2018学年高一上学期期中考试化学试卷山西省运城中学、芮城中学2017-2018学年高一上学期期中联考化学试题辽宁省沈阳铁路实验中学2017-2018学年高一上学期期中考试化学试题湖北省宜昌市第一中学2017-2018学年高一上学期期中考试化学试题2山西省临汾第一中学2017-2018学年高一上学期第二次调研(期中)考试化学试题河北省石家庄市第二中学2017-2018学年高一12月月考化学试题浙江省定海一中2017-2018学年高一第一学期期中考试化学试卷甘肃省武威市第六中学2017-2018学年高一上学期期末考试化学试题湖北省宜昌市第一中学2017-2018学年高一上学期期中考试化学试题3甘肃省嘉峪关市酒钢三中2017-2018学年高一上学期第二次月考化学试题河南省周口市2017-2018学年高一上学期期末考试 化学内蒙古通辽实验中学2017-2018学年高一上学期期末考试化学试题【全国百强校】河北省辛集中学2017-2018学年高二6月月考化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【押题专练】山东省德州市武城县第二中学2019届高三9月月考化学试题陕西省渭南市尚德中学2019届高三上学期第一次教学质量检测化学试题(已下线)2018年10月7日 《每日一题》人教必修1-每周一测【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期期中考试化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高一上学期期中考试化学试题河南省安阳市第二中学2018-2019学年高一上学期期中考试化学试题江西省奉新县第一中学2018-2019学年高一上学期第三次月考化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点步步为赢 高二化学暑假作业:作业三 氧化还原反应湖南省衡阳县第四中学2020届高三366班(实验班)8月月考化学试题鲁科版(2019)新教材化学同步2.3.2 氧化还原反应的应用 练习(已下线)2019年10月6日《每日一题》必修1 —— 每周一测陕西省西安中学2020届高三上学期第一次月考化学试题上海中学2017-2018学年高一(上)期中化学试卷吉林省油田第十一中学2020届高三上学期第一次阶段考试化学试题上海市宝山中学2017-2018学年高三第一学期期中考化学试题天津市南开中学滨海生态城学校2019-2020高一上学期期中考试化学试题甘肃省兰州第一中学2019-2020学年高一上学期期中考试化学试题河北省唐山市第一中学2019-2020学年高一上学期期中考试化学试题云南省玉溪市玉溪一中2019-2020学年高一上学期期中考试化学试题吉林省延边第二中学2019-2020学年高一上学期期中考试化学试题(已下线)【新东方】高中化学5004山东省微山县第二中学2019-2020学年高一上学期第二学段质量检测化学试题黑龙江省鹤岗市第一中学2019-2020学年高一12月月考化学试题江西省抚州市临川区第二中学2019-2020学年高一上学期第二次月考化学试题云南师范大学附属中学2019-2020学年高一上学期期中考试化学试题云南省金平县第一中学2019-2020学年高一上学期期末考试化学试题新疆沙湾一中2019-2020学年高一上学期期末考试化学试题人教版高一化学必修1第二章《化学物质及其变化》测试卷云南省昭通市水富县第二中学2019-2020学年高一上学期期末考试化学试题重庆市云阳县江口中学2019-2020学年高一上学期第二次月考化学试题云南省大理市下关第一中学2019-2020学年高一上学期期末考试化学试题湖南师大附中2019-2020学年高一上期期末考试化学试题安徽省淮北市第一中学2019-2020学年高一下学期2月在线测试化学试题四川省攀枝花市第十五中学2019-2020学年高一下学期第二次月考化学试题陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题(已下线)【新东方】化学巩固练习34四川省凉山州2019-2020学年高二下学期期末检测化学(理)试题(已下线)2.3.2 氧化还原反应的应用 练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第08讲 氧化还原反应的基本概念和规律(精讲)——2021年高考化学一轮复习讲练测辽宁省沈阳市郊联体2019-2020学年高二下学期期末考试化学试题湖南师范大学附属中学2019-2020学年高一上学期期末考试化学试题(已下线)专题04 氧化还原反应(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学苏教版(2020)高一必修第一册专题3第三单元 海洋化学资源的综合利用河南省平顶山市舞钢市第一高级中学2021届高三9月月考化学试题江西省九江市第一中学2019-2020学年高二下学期期末考试化学试题鲁科版(2019)高一必修第一册第二章易错疑难集训(二)(已下线)1.3.3 氧化还原反应的规律及应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 教材帮上海市2019-2020学年高一上学期期中考试化学试题黑龙江省绥化市第一中学2020-2021学年高一上学期第一次月考化学试题北京中国人民大学附属中学2020-2021学年高一上学期第一次检测化学试题吉林省(长春市)榆树市第一高级中学2021届高三10月月考化学试题黑龙江省绥化市第一中学2020-2021学年高一上学期第二次月考化学试题安徽省合肥一中2020-2021学年高一上学期第一次段考化学试题高一必修第一册(苏教2019)专题3 第一单元 氯气及氯的化合物1福建省厦门市湖滨中学2021届高三10月月考化学试题高一必修第一册(苏教2019) 模块综合测评甘肃省张掖市第二中学2020-2021学年高一上学期期中考试化学试题黑龙江省牡丹江市东宁市第一中学2020-2021学年高一上学期月考化学试题安徽省蚌埠第三中学2019-2020学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一上学期期中考试化学试题湖南省常德市第一中学2020-2021学年高一上学期第2次月考化学试题(已下线)【浙江新东方】绍兴qw81(已下线)【浙江新东方】在线化学20甘肃省张掖市2020-2021学年高一上学期期末学业水平质量检测化学试题天津市河东区第八中学2021届高三上学期期中化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00145】(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00137】(已下线)第06讲 氧化还原反应(精讲)-2022年一轮复习讲练测(已下线)专题1.3.3 氧化剂、还原剂(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)第3课时 氧化还原反应的基本规律和配平(课中)——课前、课中、课后同步专题精编(人教版2019必修第一册)山东省济宁市实验中学2022届高三上学期开学考试化学试题甘肃省静宁县第一中学2022届高三上学期第一次月考化学试题(已下线)3.1.3 氧化还原反应-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)黑龙江省双鸭山市第一中学2020-2021学年高一第二次月考化学试题黑龙江省大庆实验中学2021-2022学年高一上学期10月月考化学试题黑龙江省哈尔滨市德强高级中学2021-2022学年高一上学期10月月考化学试题浙江省台州市七校联盟2020-2021学年高一上学期期中联考化学试题天津市南开中学2021-2022学年高一上学期期中考试化学试题(已下线)易错专题08 氧化还原反应规律的应用及相关计算-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)重庆市育才中学校2021-2022学年高一上学期期中考试化学试题 广东省梅州市大埔县虎山中学2021-2022学年高一上学期第一次段考(11月)化学试题(已下线)第07练 氧化还原反应-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)上海市崇明区民本中学2020-2021学年高二上学期期中考试化学试题湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第三次考试化学试题贵州省毕节市第一中学2021-2022学年高一上学期第二次阶段性考试化学试题(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题吉林省延边第二中学2022-2023学年高三上学期开学调研考试化学试题吉林省长春市东北师范大学附属中学2022-2023学年高一上学期阶段考试化学试题四川省凉山州西昌天立中学2021-2022学年高二下学期5月月考化学试题浙江省台州市书生中学2022-2023学年高一上学期第一次月考化学试题天津市北辰区2022-2023学年高三上学期第一次联考化学试题广东省广州市育才中学2022-2023学年高一上学期期中考试化学试题陕西省西安市陕西师范大学附属中学2020-2021学年高一上学期期中考试化学试题陕西省西安中学2022-2023学年高一上学期期中考试化学试题湖南省攸县第三中学2022-2023年高一上学期第三次月考化学试题安徽省六安中学2021-2022学年高一上学期期中考试化学试题黑龙江牡丹江农管局密山农垦子弟学校2021-2022学年高一上学期期末考试化学试题广西贺州市钟山县钟山中学2020-2021学年高一上学期期末考试化学试题(已下线)第一章 化学物质及其变化 第5练 氧化还原反应的计算与方程式的配平(已下线)题型18 氧化还原反应规律的应用(已下线)【新东方】化学出门测1234重庆市育才中学2021-2022学年高一上学期期中考试化学试题北京市中国人民大学附属中学2020-2021学年高一下学期第一次检测化学试题广东省广州市育才中学2022-2023学年高一上学期期中考试化学试题甘肃省嘉峪关市等3地2022-2023学年高一上学期12月期中考试化学试题广东省普宁市华侨中学2022-2023学年高一上学期(11月)期中考试化学试题(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)微专题(二)——氧化还原反应的简单规律及应用重庆市大足中学2022-2023学年高一上学期第一次月考化学试题江西省宜春市宜丰中学2023-2024学年高一上学期开学考试化学试题浙江省台州市路桥中学2023-2024学年高一上学期10月月考化学试题天津市南开中学2023-2024学年高三上学期第二次考试化学试题浙江省台州市第一中学2022-2023学年高一上学期11月期中考试化学试题浙江省杭州市西湖高级中学2023-2024学年高一上学期10月月考化学试题辽宁省大连市瓦房店市高级中学2022-2023学年高一上学期期中考试化学试卷 天津市第五十四中学2023-2024学年高一上学期第二次月考(12月考)化学试题陕西省咸阳市实验中学2023-2024学年高一上学期段性检测(一)化学试题天津市实验中学滨海学校2023-2024学年高一上学期期中质量调查化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
 CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是| A.体系的体积不再发生变化 | B.v正(CO)=v逆(H2O) |
| C.生成n mol CO的同时生成n mol H2 | D.1 mol H-H键断裂的同时断裂2 mol H-O键 |
【知识点】 化学平衡状态的判断方法解读
您最近一年使用:0次
2020-10-29更新
|
126次组卷
|
3卷引用:四川省自贡市江姐中学2020-2021学年高二上学期第一次月考化学试题
单选题
|
适中(0.65)
8. 下列化学反应的离子方程式正确的是
| A.将铝片加入烧碱溶液中:2Al+2OH-+2H2O→2AlO2-+3H2↑ |
| B.将少量金属钠放入冷水中:Na+2H2O→Na++2OH-+H2↑ |
| C.向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+→SO2+H2O |
| D.向澄清石灰水中通入过量的二氧化碳:Ca2++2OH-+CO2→CaCO3↓+H2O |
【知识点】 离子方程式的正误判断解读
您最近一年使用:0次
2017-04-08更新
|
174次组卷
|
2卷引用:2017届上海市黄浦区高三下学期4月等级考调研测试化学试卷
单选题
|
较易(0.85)
名校
9. 氢气用于烟气的脱氮、脱硫的反应:4H2(g)+2NO(g)+SO2(g) N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
 N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )
N2(g)+S(l)+4H2O(g)ΔH<0。下列有关说法正确的是( )| A.当v(H2)=v(H2O)时,达到平衡 |
| B.升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动 |
| C.使用高效催化剂可提高NO的平衡转化率 |
D.化学平衡常数表达式为K= |
【知识点】 化学平衡常数的概念及表达方式解读
您最近一年使用:0次
2019-12-14更新
|
368次组卷
|
8卷引用:广东省湛江市第一中学2017-2018学年高二上学期期末考试化学试题
广东省湛江市第一中学2017-2018学年高二上学期期末考试化学试题(已下线)考点12 化学反应速率化学平衡——《备战2020年高考精选考点专项突破题集》广东省湛江市第二十一中学2019-2020学年高二上学期期中考试化学试题广东省湛江市2017-2018学年高二上学期期末考试化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(精练)-2021年高考化学一轮复习讲练测(已下线)【浙江新东方】绍兴qw122天津市河东区第八中学2021届高三上学期期中化学试题江西省赣州市兴国县第三中学2020-2021学年高二上学期第二次月考(兴国班)化学试题
单选题
|
较易(0.85)
名校
10. 在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g)  2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
 2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )| A.2molH2(g)和1molI2(g) | B.3molHI(g) |
| C.2molH2(g)和2molI2(g) | D.1molI2(g)和2molHI(g)[来科 |
您最近一年使用:0次
2018-04-17更新
|
268次组卷
|
4卷引用:2015-2016学年河南省安阳三十六中高二上学期期中考试化学试卷
单选题
|
适中(0.64)
名校
11. 利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是
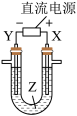

| A.氯碱工业中,X电极上反应式是4OH--4e-=2H2O+O2↑ |
| B.电解精炼铜时,Z溶液中的Cu2+浓度不变 |
| C.在铁片上镀铜时,Y是纯铜 |
| D.制取金属镁时,Z是熔融的氯化镁 |
【知识点】 电解池
您最近一年使用:0次
2016-12-09更新
|
536次组卷
|
21卷引用:2015-2016学年湖南省株洲十八中高二上学期期末理化学试卷
2015-2016学年湖南省株洲十八中高二上学期期末理化学试卷2017届广东省茂名市信宜中学高三上学期8月月考化学试卷安徽省淮北市濉溪中学2017-2018学年高二上学期开学考试化学试题宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题高二人教版选修4 第四章 第三节 电解池宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高二上学期第二次月考化学试题陕西省西安中学2019-2020学年高二上学期期末考试化学试题2020届高三化学化学二轮复习——电解池的基本原理【精编选择24题】(已下线)专题6.3 电解池 金属的腐蚀与防护(讲)——2020年高考化学一轮复习讲练测黑龙江省大庆市第四中学2019-2020学年高二上学期第一次检测化学试题福建省福州市八县(市)协作校2020-2021学年高二上学期期中考试化学试题天津市河东区第八中学2021届高三上学期期中化学试题山西省吕梁市2020-2021学年高二上学期期末考试化学试题新疆乌鲁木齐市第八中学2018-2019学年高二上学期期末考试化学试题(已下线)专题六 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)江苏省泰州中学2021-2022学年高二上学期第二次质量检测化学试题新疆呼图壁县第一中学2021-2022学年高二上学期期中考试化学试题河南省南阳市第六完全学校高级中学2022-2023学年高二上学期9月半月考化学试题天津市第八中学2021-2022学年高二上学期12月月考化学试题新疆维吾尔自治区塔城地区2022-2023学年高二下学期开学考试化学试题第2课时 电解原理的应用
单选题
|
适中(0.65)
12. Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是
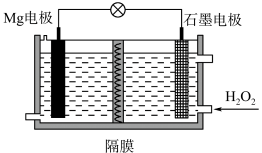

| A.Mg 电极是该电池的正极 |
| B.H2O2在石墨电极上发生氧化反应 |
| C.石墨电极附近溶液的pH 增大 |
| D.溶液中Cl-向正极移动 |
【知识点】 原电池 原电池电极反应式书写解读
您最近一年使用:0次
2019-01-30更新
|
3172次组卷
|
54卷引用:2013年全国普通高等学校招生统一考试化学(江苏卷)
2013年全国普通高等学校招生统一考试化学(江苏卷)(已下线)2013-2014天津市天津一中第二学期期中检测高一化学试卷(已下线)2014秋河北省唐山一中高二上学期期中化学试卷2015届福建省福州八中高三第四次质检理综化学试卷2014-2015福建省福州市第八中学高二下学期期中化学试卷2016届江苏省淮安市淮海中学高三上学期11月月考化学试卷2015-2016学年山西省太原五中高二上12月月考化学试卷12015-2016学年山西省太原五中高二上12月月考化学试卷22015-2016学年福建省连江县尚德中学高二上期中考试化学试卷2016届天津市河东区高考一模考试理科综合化学试卷2015-2016学年河北省邢台一中高一下期中化学试卷2015-2016学年甘肃省天水一中高一下期中理科化学试卷2015-2016学年吉林省实验中学高一下期末化学试卷2016-2017学年西藏林芝一中高二上期末化学试卷2016-2017学年河北省张家口市高二上学期期末考试化学试卷2016-2017学年河北省邯郸市高二上学期期末考试化学试卷安徽省安庆市第一中学2016-2017学年高二下学期期中考试化学试题陕西省西安市高新一中2016-2017学年高二上学期第一次月考化学试题广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题新疆兵团第二师华山中学2017-2018学年高一下学期期中考试化学试题云南省曲靖市沾益二中2017-2018学年高一下学期期末考试化学试题(已下线)2019年3月24日 《每日一题》 必修2 每周一测步步为赢 高一化学暑假作业:作业七 化学能与电能云南省峨山彝族自治县第一中学2018-2019学年高二6月月考化学试题黑龙江省大庆十中2018-2019学年高一下学期期末考试化学试题新疆奎屯市第一高级中学2018-2019学年高二下学期期末考试化学试题新疆巴州焉耆县第三中学2018-2019学年高二上学期期末考试化学试题安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题西藏自治区拉萨市那曲第二高级中学2018-2019学年高二下学期第一次月考化学试题2019-2020人教版高中化学必修2第二章《化学反应与能量》测试卷河北省沧州市肃宁县第一中学2019-2020学年高二上学期第三次月考化学试题云南省昆明市寻甸县第三中学2019-2020学年高二上学期期末考试化学山西省忻州市第一中学2019-2020学年高一下学期(远程)目标检测(6)化学试题上海市奉贤区2015届高三上学期期中调研测试化学试题山东省实验中学2019-2020学年高一下学期4月线上考试化学试题甘肃省张掖市山丹县第一中学2019-2020学年高一下学期期中考试化学试题江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题黑龙江省哈尔滨市双城区兆麟中学2019-2020学年度高一下学期期中考试化学试题甘肃省庆阳市第一中学2019-2020学年高一下学期期中考试化学试题河北省沧州市肃宁县第一中学2020-2021学年高二上学期第一次月考化学试题湖北省武汉市江夏区金口中学2019-2020学年高一上学期月考化学试题安徽省示范高中培优联盟2020-2021学年高二上学期冬季联赛化学试题天津市河东区第八中学2021届高三上学期期中化学试题湖北省襄阳市第五中学2019-2020学年高一下学期6月月考化学试题河北省张家口宣化一中2020-2021学年高一下学期4月月考化学试题河北保定市博野县实验中学2020-2021学年高一下学期期中考试化学试题甘肃省武威市民勤县第四中学2020-2021学年高二下学期期中考试化学(实验班)试题(已下线)模块八 电化学基础(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)河北正定中学2020-2021学年高三第一次半月考化学试题云南省玉溪第三中学2021-2022学年高三上学期期末考试化学试题云南省宣威市第三中学2021-2022学年高二下学期3月份考试化学试题浙江省吴兴高级中学2021-2022学年高一下学期学考模拟化学试题 山东省泰安市2022-2023学年高一下学期期末统考化学试题江苏省射阳中学2022-2023学年高一下学期3月月考化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
13. 按要求填空:
(1)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一、
①氢气是清洁燃料,其燃烧产物为___________ 。
②NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为___________ ,反应消耗1 mol NaBH4时转移的电子数目为___________ 。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:___________
_____Ce3++_____ H2O2+ ___ H2O= Ce(OH)4↓+_______
(3)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是___________ 。
(4)Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg=Mg2++2Ag+2Cl-
①电池的负极材料为___________ ,发生的电极反应为___________ 。
②电池正极发生的电极反应为___________ 。
(5)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。C(s)+
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ·mol-1。写出焦炭与水蒸气反应的热化学方程式:
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1。写出焦炭与水蒸气反应的热化学方程式:___________ 。
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为___________ 。
(1)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一、
①氢气是清洁燃料,其燃烧产物为
②NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
_____Ce3++_____ H2O2+ ___ H2O= Ce(OH)4↓+_______
(3)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
(4)Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg=Mg2++2Ag+2Cl-
①电池的负极材料为
②电池正极发生的电极反应为
(5)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。已知:H2(g)+
 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。C(s)+
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1。C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ·mol-1。写出焦炭与水蒸气反应的热化学方程式:
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1。写出焦炭与水蒸气反应的热化学方程式:(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO
 ,常用作脱氯剂,该反应的离子方程式为
,常用作脱氯剂,该反应的离子方程式为
您最近一年使用:0次
三、 添加题型下试题
|
较难(0.4)
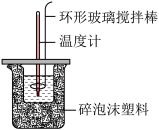
14. 利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________ 。
(2)倒入NaOH溶液的正确操作是__________ (填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是________ (填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L−1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为________________ 。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(6)______ (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________ 。

①用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L−1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度 |
| |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=
(6)
【知识点】 中和热的测定与误差分析解读
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
名校
解题方法
15. 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移_____ mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4)∶n(KMnO4) ≥_____________ 。
(2)探究温度对化学反应速率影响的实验编号是___________ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____________ 。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ mol•L-1•min-1。
(4)已知50℃时c(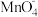 )~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(
)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(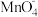 )~t的变化曲线示意图。
)~t的变化曲线示意图。

_____________
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/ mol•L-1 | 体积/mL | 浓度/ mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(2)探究温度对化学反应速率影响的实验编号是
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(4)已知50℃时c(
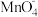 )~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(
)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(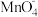 )~t的变化曲线示意图。
)~t的变化曲线示意图。
您最近一年使用:0次
2016-12-09更新
|
1586次组卷
|
8卷引用:2013届广东省广州市高三调研测试理综化学试卷
解答题-工业流程题
|
较难(0.4)
名校
解题方法
16. NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。其一种生产工艺如下:
(1) 写出“反应”步骤中生成ClO2的化学方程式:_________________________________ 。
(2) “电解”中阴极反应的主要产物是____ 。
(3) “电解”所用食盐水由粗盐水精制而成。精制时,为除去Mg2+和Ca2+,要加入的试剂分别为______ 溶液、____ 溶液。(填化学式)
(4) “尾气吸收”是吸收“电解”过程排出的少量ClO2。写出“尾气吸收”的离子方程式:____ 。此吸收反应中,氧化剂与还原剂的物质的量之比为____ 。
(5) “有效氯含量”可用来衡量含氯消毒剂的消毒能力。其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____ g(计算结果保留两位小数)。

(1) 写出“反应”步骤中生成ClO2的化学方程式:
(2) “电解”中阴极反应的主要产物是
(3) “电解”所用食盐水由粗盐水精制而成。精制时,为除去Mg2+和Ca2+,要加入的试剂分别为
(4) “尾气吸收”是吸收“电解”过程排出的少量ClO2。写出“尾气吸收”的离子方程式:
(5) “有效氯含量”可用来衡量含氯消毒剂的消毒能力。其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为
您最近一年使用:0次
2017-03-07更新
|
498次组卷
|
4卷引用:2017届江苏省苏州市高三上学期期末考试化学试卷
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学反应原理、认识化学科学、化学实验基础
试卷题型(共 16题)
题型
数量
单选题
12
填空题
1
1
解答题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 氨的物理性质 二氧化硅的用途 明矾的净水作用及原理 | |
| 2 | 0.65 | 化学反应速率的定量表示方法 化学反应速率与化学计量数之间的关系 | |
| 3 | 0.65 | 离子反应的发生条件 离子共存 离子反应在生活、生产中的应用 | |
| 4 | 0.85 | 阿伏加德罗常数的应用 气体物质与NA相关的推算 物质结构基础与NA相关推算 | |
| 5 | 0.94 | 燃烧热概念 表示燃烧热的热化学方程式书写 盖斯定律与热化学方程式 盖斯定律的应用 | |
| 6 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应的规律 | |
| 7 | 0.65 | 化学平衡状态的判断方法 | |
| 8 | 0.65 | 离子方程式的正误判断 | |
| 9 | 0.85 | 化学平衡常数的概念及表达方式 | |
| 10 | 0.85 | 等效平衡 等效平衡的建立 | |
| 11 | 0.64 | 电解池 | |
| 12 | 0.65 | 原电池 原电池电极反应式书写 | |
| 二、填空题 | |||
| 13 | 0.65 | 氧化还原反应方程式的配平 盖斯定律及其有关计算 电解池电极反应式及化学方程式的书写与判断 | |
| 三、 | |||
| 14 | 0.4 | 中和热的测定与误差分析 | |
| 四、解答题 | |||
| 15 | 0.65 | 氧化还原反应有关计算 影响化学反应速率的因素 化学反应速率计算 外因对化学反应速率影响的综合分析 | 原理综合题 |
| 16 | 0.4 | 氧化还原反应方程式的配平 与氧化剂、还原剂有关的计算 电解原理的应用 物质分离、提纯的常见化学方法 | 工业流程题 |