天津市实验中学滨海学校2022-2023学年高三上学期期中质量调查化学试题
天津
高三
期中
2022-12-16
244次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、化学反应原理、物质结构与性质、化学实验基础、认识化学科学、有机化学基础
天津市实验中学滨海学校2022-2023学年高三上学期期中质量调查化学试题
天津
高三
期中
2022-12-16
244次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、化学反应原理、物质结构与性质、化学实验基础、认识化学科学、有机化学基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. 中华文化源远流长、博大精深,河北省馆藏文物是中华文化的重要代表。下列文物主要是由硅酸盐类材料构成的是
| 文物 |  |  |  |  |
| 藏品 | 河北省博物馆中的长信宫灯 | 邯郸博物馆中的文字缸 | 邢台博物馆中的汉错金四神几何纹长颈铜壶 | 保定博物馆中的汉代铜马 |
| 选项 | A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-15更新
|
397次组卷
|
5卷引用:河北省部分学校2022-2023学年高三上学期大数据应用调研联合测评化学试题
河北省部分学校2022-2023学年高三上学期大数据应用调研联合测评化学试题河北省2022-2023学年高三联合测评化学试题(已下线)化学(广东B卷)-学易金卷:2023年高考第一次模拟考试卷天津市实验中学滨海学校2022-2023学年高三上学期期中质量调查化学试题海南省琼海市四校2022-2023学年高三上学期大联考化学试题
单选题
|
容易(0.94)
解题方法
2. 化学与生产生活息息相关,下列说法正确的是
| A.用热的纯碱溶液可清洗衣物上的汽油污渍 |
| B.二氧化硫有毒,禁止用作食品添加剂 |
C.新冠疫苗使用的中硼硅玻璃瓶含有的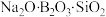 是一种复杂的氧化物 是一种复杂的氧化物 |
| D.硫酸工业中,利用热交换器预热反应物,可降低能耗提高生产效率 |
【知识点】 二氧化硅的化学性质解读 化学科学对人类文明发展的意义解读
您最近一年使用:0次
2022-10-13更新
|
161次组卷
|
2卷引用:湖北省部分重点中学2022-2023学年高三上学期10月联考化学试题
单选题
|
适中(0.65)
3. 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确 的是
| A.醋酸钠是强电解质 |
| B.醋酸钠晶体与冰都是离子晶体 |
C.常温下,醋酸钠溶液的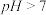 |
| D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出 |
您最近一年使用:0次
2022-09-08更新
|
6816次组卷
|
19卷引用:2022年北京市高考真题化学试题
2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题1-14(已下线)易错点23 弱电解质的电离平衡-备战2023年高考化学考试易错题北京市第一六一中学2022-2023学年高三上学期期中考试化学试题北京一零一中学2022-2023学年高三上学期统练六化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测天津市实验中学滨海学校2022-2023学年高三上学期期中质量调查化学试题北京市北京师范大学附属中学2022-2023 学年高三上学期月考2化学试题北京市八一学校2022-2023学年高三上学期12月月考化学试题江西省宜春市丰城第九中学重点班2022-2023学年高二下学期开学质量检测化学试题北京市第二中学2022-2023学年高二下学期3月月考化学试题(已下线)2022年北京高考真题化学试题变式题(选择题1-5)(已下线)2022年北京高考真题化学试题变式题(选择题1-5)(已下线)专题01 化学与STSE 物质的组成、性质和用途-2023年高考化学真题题源解密(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)(已下线)第29讲弱电解质的电离北京师范大学附属中学2023-2024学年高三上学期统练七(12月考)化学试题北京市第一六一中学2023-2024学年高二上学期期中阶段练习化学试题(已下线)热点06 物质的聚集状态与晶体的常识
单选题
|
适中(0.65)
4. 适时推动沧州市海兴核电站项目有助于实现“双碳”目标,目前核电站主要通过铀—235的裂变反应释放的能量进行发电。其变化过程包括: 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是| A.上述变化过程属于化学变化 | B. 与 与 的原子序数相差55 的原子序数相差55 |
C. 与 与 互为同位素 互为同位素 | D.Ba属于过渡金属元素 |
您最近一年使用:0次
2022-10-15更新
|
356次组卷
|
3卷引用:河北省部分学校2022-2023学年高三上学期大数据应用调研联合测评化学试题
单选题
|
较易(0.85)
5. 下列实验中,不能 达到实验目的的是
| 由海水制取蒸馏水 | 萃取碘水中的碘 | 分离粗盐中的不溶物 | 由 制取无水 制取无水 固体 固体 |
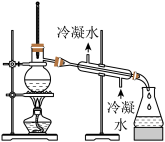 | 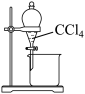 | 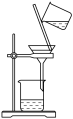 | 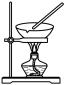 |
| A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-09-08更新
|
10401次组卷
|
17卷引用:2022年北京市高考真题化学试题
2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题1-14甘肃省武威市凉州区部分校联考2022-2023学年高三上学期第二次诊断化学试题(已下线)易错点32 物质的分离、提纯与检验-备战2023年高考化学考试易错题天津市实验中学滨海学校2022-2023学年高三上学期期中质量调查化学试题(已下线)【知识图鉴】单元讲练测必修第二册第五单元 02基础练福建省质优生“筑梦”联考2022-2023学年高二下学期化学试题(已下线)2022年北京高考真题化学试题变式题(选择题1-5)(已下线)2022年北京高考真题化学试题变式题(选择题1-5)(已下线)专题13 化学实验基础(已下线)专题13 化学实验基础(已下线)第08练 实验仪器的选用与基本操作 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)广东省东莞市众美中学2022-2023学年高三上学期10月月考化学试题(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)安徽省蚌埠市2023-2024学年高二上学期1月期末化学试题黑龙江省鸡西实验中学2023-2024学年高三上学期期末考试化学试题
单选题
|
适中(0.65)
名校
6. 甲是一种口腔清洁剂,其结构如图所示。已知W、X、Y、Z为原子序数依次递增的前20号元素。下列说法错误的是


| A.原子半径:Z>Y>X | B.Y的价电子排布式为 |
| C.甲具有较强的氧化性 | D.X、Z能形成既含离子键又含共价键的化合物 |
【知识点】 元素非金属性强弱的比较方法解读 微粒半径大小的比较方法解读
您最近一年使用:0次
2022-10-15更新
|
1050次组卷
|
6卷引用:河北省部分学校2022-2023学年高三上学期大数据应用调研联合测评化学试题
单选题
|
容易(0.94)
名校
解题方法
7. 下列化学用语或图示表达正确的是
A.基态氮原子价电子的轨道表示式: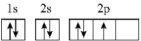 |
B. 的电子式: 的电子式: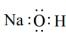 |
C. 的空间填充模型: 的空间填充模型: |
D.顺式聚异戊二烯的结构简式: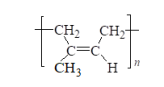 |
您最近一年使用:0次
2022-10-14更新
|
216次组卷
|
2卷引用:北京首都师范大学附属中学2023届高三上学期10月份月考化学试题
单选题
|
适中(0.65)
名校
解题方法
8. 下列离子方程式与所给事实相符的是
A.向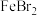 中通入过量 中通入过量 : : |
B. 溶液加入足量 溶液加入足量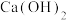 溶液: 溶液: |
C.铝溶于 溶液: 溶液: |
D. 和浓硫酸加热条件下反应: 和浓硫酸加热条件下反应: |
您最近一年使用:0次
2022-10-14更新
|
244次组卷
|
2卷引用:北京首都师范大学附属中学2023届高三上学期10月份月考化学试题
9. 下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是K2CO3 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量MgO粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 | 说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| D | NaAlO2溶液与NaHCO3溶液混合,有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-10-14更新
|
489次组卷
|
3卷引用:辽宁省沈阳市东北育才学校高三上学期10月第一次模拟考试化学试题
单选题
|
较易(0.85)
10. 下列物质混合后,因发生氧化还原反应使溶液 减小的是
减小的是
 减小的是
减小的是A.向 溶液中加入少量 溶液中加入少量 溶液,生成白色沉淀 溶液,生成白色沉淀 |
B.向 和 和 的悬浊液中通入空气,生成红褐色沉淀 的悬浊液中通入空气,生成红褐色沉淀 |
C.向 溶液中加入少量 溶液中加入少量 溶液,生成蓝绿色沉淀 溶液,生成蓝绿色沉淀 |
D.向 溶液中通入氯气,生成黄色沉淀 溶液中通入氯气,生成黄色沉淀 |
您最近一年使用:0次
2022-09-08更新
|
6280次组卷
|
17卷引用:2022年北京市高考真题化学试题
2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题1-14福建省三明第一中学2022-2023学年高三上学期第二次月考化学试题浙江省东阳市横店高级中学2022-2023学年高三上学期10月份检测化学试题宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题(尖子班)天津市实验中学滨海学校2022-2023学年高三上学期期中质量调查化学试题(已下线)专题四 氧化还原反应-实战高考·二轮复习核心突破湖南省永州市第一中学2022-2023学年高一上学期期末阶段性考试化学试题(已下线)2022年北京高考真题化学试题变式题(选择题6-10)(已下线)【知识图鉴】单元讲练测必修第一册第一单元02基础练广东省东莞市众美中学2022-2023学年高三上学期10月月考化学试题(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题陕西省西安市西北工业大学附属中学2023-2024学年高一上学期第二次月考化学试题北京市第十三中学2023-2024学年高三下学期开学测试化学试题北京市第三十五中学2023-2024学年高一下学期3月月考化学试卷
单选题
|
适中(0.65)
名校
解题方法
11. 某化学实验探究小组用电磁搅拌加热器(温度最高可达65℃)加热饱和NaHCO3溶液,并利用CO2传感器检测溶液中CO2的含量,其含量随温度变化如图所示:

下列有关叙述错误的是

下列有关叙述错误的是
| A.ab段溶液中CO2的含量降低的原因是温度升高,溶解的CO2气体逸出 |
B.bc段溶液中CO2的含量升高的原因是溶液中 受热分解生成CO2气体 受热分解生成CO2气体 |
| C.实验室可用加热饱和NaHCO3溶液的方法制取少量CO2气体 |
| D.由图象可知,NaHCO3固体受热分解的温度为48.2℃ |
【知识点】 碳酸氢钠的不稳定性解读 物质性质实验方案的设计解读 碳元素及其化合物
您最近一年使用:0次
2022-08-17更新
|
702次组卷
|
6卷引用:第二章 海水中的重要元素——钠和氯 ★综合拔高练
单选题
|
适中(0.65)
名校
解题方法
12. 铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝土矿形式存在(主要成分是Al2O3)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝。主要的工艺流程如图所示:

下列说法正确的是

下列说法正确的是
| A.碱溶①后,溶液中主要含有的阳离子为Na+和Al3+ |
B.酸化②通足量的CO2反应的离子方程式为:2 +CO2+3H2O=2Al(OH)3↓+ +CO2+3H2O=2Al(OH)3↓+ |
| C.Al(OH)3受热分解,生成高熔点物质和水,常用作塑料的阻燃剂 |
| D.灼烧③一般在坩埚中进行,电解④添加冰晶石(Na3AlF6),目的是增强导电性 |
您最近一年使用:0次
2022-08-11更新
|
520次组卷
|
4卷引用:江苏省扬州市宝应县2021-2022学年高一下学期期中检测化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
13. 科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。请回答下列问题:
I.氯气的制备(装置如图所示)

(1)装置G的名称为_______ ,装置F的作用为_______ 。
(2)从图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为_______ (填写仪器下方字母)。
II.漂白粉的制备( 装置如图所示)
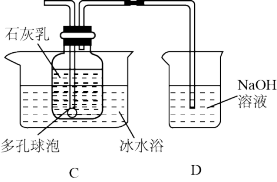
查阅资料可知:①氯气与碱反应放出热量;
②6Cl2+6Ca(OH)2 CaCl2+Ca(ClO3)2+6H2O。
CaCl2+Ca(ClO3)2+6H2O。
(3)装置C中发生反应的化学方程式为_______ 。
(4)多孔球泡的作用是_______ ,使用冰水浴的目的是_______ 。
(5)测定装置C中Ca(ClO)2物质的量浓度的方法如下:取C中溶液10.0mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应ClO-+2I-+2H+=I2+Cl- +H2O。用0.1000 mol·L-1Na2S2O3标准溶液滴定该锥形瓶中的溶液,滴入2~3滴淀粉指示剂,当加入最后一滴 Na2S2O3标准溶液时,其现象为_______ 达到滴定终点,此时消耗Na2S2O3溶液的体积为20.00mL。 (已知: I2+2S2O =2I- +S4O
=2I- +S4O 。该漂白粉溶液中Ca(ClO)2的物质的量浓度为
。该漂白粉溶液中Ca(ClO)2的物质的量浓度为_______ mol/L。(保留4位有效数字)
I.氯气的制备(装置如图所示)

(1)装置G的名称为
(2)从图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为
II.漂白粉的制备( 装置如图所示)

查阅资料可知:①氯气与碱反应放出热量;
②6Cl2+6Ca(OH)2
 CaCl2+Ca(ClO3)2+6H2O。
CaCl2+Ca(ClO3)2+6H2O。(3)装置C中发生反应的化学方程式为
(4)多孔球泡的作用是
(5)测定装置C中Ca(ClO)2物质的量浓度的方法如下:取C中溶液10.0mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应ClO-+2I-+2H+=I2+Cl- +H2O。用0.1000 mol·L-1Na2S2O3标准溶液滴定该锥形瓶中的溶液,滴入2~3滴淀粉指示剂,当加入最后一滴 Na2S2O3标准溶液时,其现象为
 =2I- +S4O
=2I- +S4O 。该漂白粉溶液中Ca(ClO)2的物质的量浓度为
。该漂白粉溶液中Ca(ClO)2的物质的量浓度为
您最近一年使用:0次
2022-09-30更新
|
873次组卷
|
4卷引用:贵州省六校联盟2022-2023学年高三上学期高考实用性联考(一)理科综合化学试题
解答题-结构与性质
|
较易(0.85)
解题方法
14. 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____ 。Ti在元素周期表中的位置____ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____ 。
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是____ ;金属离子与氧离子间的作用力为____ ,Ca2+的配位数是____ 。
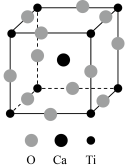
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是

您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
真题
解题方法
15. 你注意到汽车加油站内的标牌了吗?某些省市加油站提供的汽油标号由90号、93号换成了E90、E93,后者是在汽油中加入了10%的燃料乙醇而制得的乙醇汽油。
1. 燃料乙醇的生产过程可由下图表示:

(1)粉碎玉米的目的是:___________________________________ 。
(2)生产过程中为了检验淀粉水解是否完全,可使用试剂是____________________ 。
(3)步骤a的操作是( ) 。
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:_______ 。
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示:(C6H10O5)n(淀粉)+nH2O nC6H12O6(葡萄糖),C6H12O6
nC6H12O6(葡萄糖),C6H12O6 2CH3CH2OH+2CO2↑,
2CH3CH2OH+2CO2↑,
根据上述反应式,可以算出100kg淀粉理论上可生产无水乙醇________________ kg。(相对原子质量:C-12 H-1 O-16)
2. 到目前为止,我国已有上百个城市使用乙醇汽油。
(1)为了便于区分燃料乙醇和食用乙醇,常在燃料乙醇中添加少量煤油,这里利用了煤油的物理性质是:_______________________________________ 。
(2)含10%乙醇的汽油在储存和运输过程中应特别注意防水,如果混入了水,汽油中会出现的现象是______________________________________________ 。
3. 右图是燃料乙醇的生产和消费过程示意图。虽然燃料乙醇的使用缓解了汽车能源的紧张状况,但仍存在一些问题。由此可知,燃料乙醇( )

A. 是最理想的绿色能源
B. 提供的能量来自于太阳能
C. 生产和消费过程对空气没有任何影响
D. 生产过程中将消耗大量粮食,以避免粮食过剩
4.除了燃料乙醇,二甲醚(CH3OCH3)和甲醇(CH3OH)也可作为汽车燃料,其中与乙醇互为同分异构体的是______________________________________ 。
1. 燃料乙醇的生产过程可由下图表示:

(1)粉碎玉米的目的是:
(2)生产过程中为了检验淀粉水解是否完全,可使用试剂是
(3)步骤a的操作是
A. 蒸发 B. 萃取 C. 蒸馏 D. 分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示:(C6H10O5)n(淀粉)+nH2O
 nC6H12O6(葡萄糖),C6H12O6
nC6H12O6(葡萄糖),C6H12O6 2CH3CH2OH+2CO2↑,
2CH3CH2OH+2CO2↑,根据上述反应式,可以算出100kg淀粉理论上可生产无水乙醇
2. 到目前为止,我国已有上百个城市使用乙醇汽油。
(1)为了便于区分燃料乙醇和食用乙醇,常在燃料乙醇中添加少量煤油,这里利用了煤油的物理性质是:
(2)含10%乙醇的汽油在储存和运输过程中应特别注意防水,如果混入了水,汽油中会出现的现象是
3. 右图是燃料乙醇的生产和消费过程示意图。虽然燃料乙醇的使用缓解了汽车能源的紧张状况,但仍存在一些问题。由此可知,燃料乙醇

A. 是最理想的绿色能源
B. 提供的能量来自于太阳能
C. 生产和消费过程对空气没有任何影响
D. 生产过程中将消耗大量粮食,以避免粮食过剩
4.除了燃料乙醇,二甲醚(CH3OCH3)和甲醇(CH3OH)也可作为汽车燃料,其中与乙醇互为同分异构体的是
您最近一年使用:0次
2016-12-09更新
|
716次组卷
|
2卷引用:2008年普通高等学校招生统一考试综合试题(理科使用)化学部分(上海卷)
解答题-工业流程题
|
适中(0.65)
解题方法
16. 硫酸亚铁(FeSO4)是中学化学常用试剂,可用于治疗缺铁性贫血症。
(1)实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是_______ (填一种)。
(2)以FeSO4为原料可制备碱式硫酸铁[ ]、铁红、硫酸亚铁铵[
]、铁红、硫酸亚铁铵[ ,俗名摩尔盐],转化关系如图1所示。
,俗名摩尔盐],转化关系如图1所示。

①制备 时,若
时,若 过高会导致碱式硫酸铁的产率偏低,其原因是
过高会导致碱式硫酸铁的产率偏低,其原因是_______ 。
②制备 时,向
时,向 溶液中加入过量的
溶液中加入过量的 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为_______ ;铁红的化学式为_______ 。
③制备摩尔盐时将反应物混合,经蒸发浓缩、冷却结晶、_______ 、洗涤、干燥得到产品。
(3)隔绝空气条件下, 分解时的物质转化关系如图2:
分解时的物质转化关系如图2:

①关于M的成分提出三种猜想:
猜想1:M是 ;
;
猜想2:M是_______ ;
猜想3:M是 和
和 。
。
②已知三种气体的部分性质如表所示:
利用图3装置探究硫酸亚铁部分分解产物。能否将低温浴槽A的温度控制在 ?
?_______ (填“能”或“否”),理由是_______ 。C中试剂可能是_______ 。

(1)实验室配备FeSO4溶液时为防止硫酸亚铁变质,常采用的措施是
(2)以FeSO4为原料可制备碱式硫酸铁[
 ]、铁红、硫酸亚铁铵[
]、铁红、硫酸亚铁铵[ ,俗名摩尔盐],转化关系如图1所示。
,俗名摩尔盐],转化关系如图1所示。
①制备
 时,若
时,若 过高会导致碱式硫酸铁的产率偏低,其原因是
过高会导致碱式硫酸铁的产率偏低,其原因是②制备
 时,向
时,向 溶液中加入过量的
溶液中加入过量的 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为③制备摩尔盐时将反应物混合,经蒸发浓缩、冷却结晶、
(3)隔绝空气条件下,
 分解时的物质转化关系如图2:
分解时的物质转化关系如图2:
①关于M的成分提出三种猜想:
猜想1:M是
 ;
;猜想2:M是
猜想3:M是
 和
和 。
。②已知三种气体的部分性质如表所示:
| 物质 |  |  |  |
| 熔点/℃ | 16.8 | -72.4 | -210 |
| 沸点/℃ | 44.8 | -10 | -195.8 |
 ?
?
您最近一年使用:0次
2022-10-10更新
|
196次组卷
|
2卷引用:山东省百校联考2023届高三上学期10月联考化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学与STSE、化学反应原理、物质结构与性质、化学实验基础、认识化学科学、有机化学基础
试卷题型(共 16题)
题型
数量
单选题
12
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 硅酸盐工业 金属与合金性能比较 | |
| 2 | 0.94 | 二氧化硅的化学性质 化学科学对人类文明发展的意义 | |
| 3 | 0.65 | 强电解质与弱电解质 盐类水解规律 晶体类型判断 | |
| 4 | 0.65 | 元素周期表结构分析 原子中相关数值及其之间的相互关系 元素、核素、同位素 | |
| 5 | 0.85 | 制备与水解有关的物质 蒸馏与分馏 萃取和分液 过滤 | |
| 6 | 0.65 | 元素非金属性强弱的比较方法 微粒半径大小的比较方法 | |
| 7 | 0.94 | 化学用语综合判断 有机物的结构式、结构简式、比例模型、球棍模型、最简式 原子、离子、原子团及其电子式的书写与判断 轨道表示式 | |
| 8 | 0.65 | 离子方程式的正误判断 氧化还原反应的规律 铝与强碱溶液反应 | |
| 9 | 0.65 | 盐类水解的应用 沉淀转化 物质分离、提纯的常见化学方法 离子的检验 | |
| 10 | 0.85 | 氧化还原反应的规律 | |
| 11 | 0.65 | 碳酸氢钠的不稳定性 物质性质实验方案的设计 碳元素及其化合物 | |
| 12 | 0.65 | 离子方程式的书写 电解法制取铝 氧化铝与碱溶液反应 氢氧化铝的制备 | |
| 二、解答题 | |||
| 13 | 0.65 | 氯气的实验室制法 氯气与碱溶液反应 常见无机物的制备 探究物质组成或测量物质的含量 | 实验探究题 |
| 14 | 0.85 | 电子排布式 元素性质与电负性的关系 离子配位数 | 结构与性质 |
| 15 | 0.65 | 影响化学反应速率的因素 糖类生产乙醇 物质分离、提纯的常见物理方法 石油能源现状及其产品的利用 | 原理综合题 |
| 16 | 0.65 | 离子方程式的书写 有关铁及其化合物转化的流程题型 常见无机物的制备 探究物质组成或测量物质的含量 | 工业流程题 |



