2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
广东
高三
阶段练习
2017-07-27
358次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、有机化学基础、化学实验基础、物质结构与性质、化学反应原理
2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
广东
高三
阶段练习
2017-07-27
358次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、有机化学基础、化学实验基础、物质结构与性质、化学反应原理
一、单选题 添加题型下试题
单选题
|
容易(0.94)
1. 下列说法错误的是
| A.为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 |
| B.PM2.5表面积大,能吸附大量的有毒、有害物质 |
| C.高纯硅在太阳能电池及信息高速传输中有重要应用 |
| D.从海水中提取物质不一定要通过化学反应实现 |
您最近一年使用:0次
2016-12-09更新
|
86次组卷
|
2卷引用:2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
单选题
|
适中(0.64)
2. NA为阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,22.4LCl2完全溶于水时转移的电子数为NA |
| B.1 mol 羟基(-OH)含有的电子数为9NA |
| C.100g30%醋酸溶液中氢原子数为2NA |
| D.100mL水中OH-的个数是10-8NA |
【知识点】 化学计量
您最近一年使用:0次
2016-12-09更新
|
70次组卷
|
2卷引用:2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
单选题
|
较难(0.4)
3. 下列离子反应方程式正确的是
| A.向Ca(HCO3)2溶液加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B.向NH4HCO3溶液中滴入少量NaOH溶液:NH4++OH-=NH3·H2O |
| C.FeSO4溶液在空气中变黄色:4Fe2++O2+4H+=4Fe3++2H2O |
| D.用NaOH溶液吸收NO2气体:3NO2+2NaOH=2NaNO3+NO↑+H2O |
【知识点】 离子反应的发生及书写
您最近一年使用:0次
2016-12-09更新
|
126次组卷
|
2卷引用:2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
单选题
|
较难(0.4)
4. 在下列条件下,一定能大量共存的微粒组是:
| A.甲基橙呈黄色的溶液中:K+、Na+、SO42-、S2O32- |
| B.能与Al反应生成H2的溶液:Na+、Ba2+、NO3-、I- |
| C.常温下水电离出的OH-为1×10-7mol/L的溶液中:K+、Na+、SO42-、AlO2- |
| D.常温下pH=7的溶液中:NH4+、K+、CH3COO-、NO3- |
【知识点】 离子共存
您最近一年使用:0次
2016-12-09更新
|
96次组卷
|
2卷引用:2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
单选题
|
适中(0.64)
5. 2015年10月5日诺贝尔医学奖授予中国女药学家屠呦呦及美国科学家威廉·坎贝尔和日本大村智,以表彰他们在寄生虫疾病治疗方面取得的成就。屠呦呦1971 年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命。青蒿素分子结构如图。下列说法错误的是:


| A.青蒿素的分子式为C15H22O5 |
| B.青蒿素是芳香族化合物 |
| C.青蒿素可以发生水解反应 |
| D.青蒿素不能使酸性KMnO4溶液褪色 |
您最近一年使用:0次
2019-01-30更新
|
30次组卷
|
2卷引用:2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
单选题
|
适中(0.65)
名校
6. 下列分离或提纯有机物的方法正确的是
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 乙烷 | 乙烯 | 酸性KMnO4溶液,洗气 |
| B | MgCl2溶液 | FeCl3 | MgO,过滤 |
| C | HCl气体 | Cl2 | 饱和食盐水,洗气 |
| D | 乙醇 | 水 | 生石灰,过滤 |
| A.A | B.B | C.C | D.D |
【知识点】 有机物分离提纯的几种常见操作 物质的分离、提纯
您最近一年使用:0次
2016-01-18更新
|
1000次组卷
|
5卷引用:2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷2016届广东省七校联合体高三上学期第二次联考理综化学试卷甘肃省甘谷第一中学2020届高三上学期第一次检测化学试题会做实验2020届高三化学实验复习——过滤、蒸馏、冷凝、结晶、洗气的再练习 【选择突破】(已下线)专题11 实验必拿分数-【微专题·大素养】备战2022年高考化学讲透提分要点
二、未知 添加题型下试题
未知-未知
|
较难(0.4)
7. 六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E,B与F同主族,E与F同周期;D的核电荷数是F的最外层电子数的2倍;B的最高正价与最低负价的代数和为0;常温下单质A与E的状态不同。下列判断正确的是
| A.A、D两种元素形成的化合物中只含有极性键 |
| B.A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性 |
| C.原子半径由大到小的顺序是F>E>C>D |
| D.最高价氧化物对应水化物酸性最强的元素是C |
【知识点】 元素周期表 元素周期律
您最近一年使用:0次
三、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
名校
解题方法
8. 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr  NaHSO4+HBr↑,CH3CH2OH+HBr
NaHSO4+HBr↑,CH3CH2OH+HBr CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:

(1)A装置的名称是_____________ 。
(2)实验中用滴液漏斗代替分液漏斗的优点为________________________ 。
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式_____________________ 。
(4)给A加热的目的是_________________ ,F接橡皮管导入稀NaOH溶液,其目的主要是______________ 。
(5)图中C中的导管E的末端须在水面以下,其目的是_____________________ 。
(6)为了除去产品中的主要杂质,最好选择下列_____ (选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。
①在上述提纯过程中每次分液时产品均从分液漏斗的_____________ (上口或下口)取得。
②从乙醇的角度考虑,本实验所得溴乙烷的产率是______________ 。
 NaHSO4+HBr↑,CH3CH2OH+HBr
NaHSO4+HBr↑,CH3CH2OH+HBr CH3CH2Br+H2O。有关数据见下表:
CH3CH2Br+H2O。有关数据见下表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g·cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |

(1)A装置的名称是
(2)实验中用滴液漏斗代替分液漏斗的优点为
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式
(4)给A加热的目的是
(5)图中C中的导管E的末端须在水面以下,其目的是
(6)为了除去产品中的主要杂质,最好选择下列
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。
①在上述提纯过程中每次分液时产品均从分液漏斗的
②从乙醇的角度考虑,本实验所得溴乙烷的产率是
您最近一年使用:0次
2019-01-30更新
|
191次组卷
|
3卷引用:2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
解答题-工业流程题
|
较难(0.4)
解题方法
9. 硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一,其原理是利用预焙烧破坏铍矿物(绿柱石—3BeO· Al2O3·6SiO2及少量FeO等)的结构与晶型,再采用硫酸酸解含铍矿物,使铍、铝、铁等酸溶性金属进入溶液相,与硅等脉石矿物初步分离,然后将含铍溶液进行净化、除杂,最终得到合格的氧化铍( 或氢氧化铍) 产品,其工艺流程如右图。

已知:(1)铝铵矾的化学式是NH4Al(SO4)2·12H2O
(2)铍元素的化学性质与铝元素相似
根据以上信息回答下列问题:
(1)熔炼物酸浸前通常要进行粉碎,其目的是:______________
(2)“蒸发结晶离心除铝”若在中学实验室中进行,完整的操作过程是______________ 洗涤、过滤。
(3)“中和除铁”过程中“中和”所发生反应的离子方程式是__________________ ,用平衡原理解释“除铁”的过程___________________________ 。
(4)加入的“熔剂”除了流程中的方解石外,还可以是纯碱、石灰等。其中,石灰具有价格与环保优势,焙烧时配料比( m石灰/ m绿柱石) 通常控制为1:3,焙烧温度一般为1400℃—1500℃ 。若用纯碱作熔剂,SiO2与之反应的化学方程式是__________________________ ,若纯碱加入过多则Al2O2、BeO2也会发生反应,其中BeO与之反应的化学方程式是_______________________ ,从而会导致酸浸时消耗更多硫酸,使生产成本升高,结合离子方程式回答成本升高的原因___________________________ 。

已知:(1)铝铵矾的化学式是NH4Al(SO4)2·12H2O
(2)铍元素的化学性质与铝元素相似
根据以上信息回答下列问题:
(1)熔炼物酸浸前通常要进行粉碎,其目的是:
(2)“蒸发结晶离心除铝”若在中学实验室中进行,完整的操作过程是
(3)“中和除铁”过程中“中和”所发生反应的离子方程式是
(4)加入的“熔剂”除了流程中的方解石外,还可以是纯碱、石灰等。其中,石灰具有价格与环保优势,焙烧时配料比( m石灰/ m绿柱石) 通常控制为1:3,焙烧温度一般为1400℃—1500℃ 。若用纯碱作熔剂,SiO2与之反应的化学方程式是
您最近一年使用:0次
四、填空题 添加题型下试题
填空题
|
较难(0.4)
10. 某硫酸厂用以下几种方法处理SO2尾气。

(1)活性炭还原法
反应原理:恒温恒容2C (s)+2SO2(g) S2(g)+2CO2(g) 。
S2(g)+2CO2(g) 。
反应进行到不同时间测得各物质的浓度如图:
①第一次出现平衡的时间是第_________ min;
②0~20min反应速率表示为V(SO2)=________ ;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________________ ;40min时,平衡常数值为__________ 。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为_______________________ ;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____ (填序号)
a.c(Na+)+c(H+) >c(SO )+c(HSO
)+c(HSO )+ c(OH-)
)+ c(OH-)
b.c(Na+) = c(SO ) + c(HSO
) + c(HSO )+ C(H2SO3)
)+ C(H2SO3)
c.c(Na+)> c(SO )> c(OH-)>c(H+)
)> c(OH-)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
如图所示,Pt(1)电极的反应式为_____________________ ;碱性条件下,用Pt(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体___ mol。


(1)活性炭还原法
反应原理:恒温恒容2C (s)+2SO2(g)
 S2(g)+2CO2(g) 。
S2(g)+2CO2(g) 。反应进行到不同时间测得各物质的浓度如图:
①第一次出现平衡的时间是第
②0~20min反应速率表示为V(SO2)=
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是
a.c(Na+)+c(H+) >c(SO
 )+c(HSO
)+c(HSO )+ c(OH-)
)+ c(OH-)b.c(Na+) = c(SO
 ) + c(HSO
) + c(HSO )+ C(H2SO3)
)+ C(H2SO3)c.c(Na+)> c(SO
 )> c(OH-)>c(H+)
)> c(OH-)>c(H+)d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
如图所示,Pt(1)电极的反应式为

您最近一年使用:0次
2016-12-09更新
|
116次组卷
|
3卷引用:2015届四川省成都市高三第一次诊断性检测理综化学试卷
五、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
11. 水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl﹣和SO42﹣。则该硬水属于_____ (填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加______ 后加___________ 。
(2)我国规定饮用水的硬度不能超过25度,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10mg CaO称为1度,某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT﹣(铬黑T)═MEBT+
蓝色 酒红色
M2+(金属离子)+Y4﹣(EDTA)═MY2﹣
MEBT++Y4﹣(EDTA)═MY2﹣+EBT﹣(铬黑T )
实验过程:
①取地下水样品25.00mL进行预处理,写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:_______________ 。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是______________ 。
③将处理后的水样转移到250mL的锥形瓶中,加入氨水﹣氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00mol•L﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为________________ 。
(3)某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为______________________ 。
②含Cr3+废水需进一步处理,请你设计一个处理方案:________________________ 。
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl﹣和SO42﹣。则该硬水属于
(2)我国规定饮用水的硬度不能超过25度,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10mg CaO称为1度,某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT﹣(铬黑T)═MEBT+
蓝色 酒红色
M2+(金属离子)+Y4﹣(EDTA)═MY2﹣
MEBT++Y4﹣(EDTA)═MY2﹣+EBT﹣(铬黑T )
实验过程:
①取地下水样品25.00mL进行预处理,写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是
③将处理后的水样转移到250mL的锥形瓶中,加入氨水﹣氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00mol•L﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为
(3)某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为
②含Cr3+废水需进一步处理,请你设计一个处理方案:
【知识点】 离子反应的发生及书写 中和滴定解读 化学实验方案的设计与评价 硬水软化解读
您最近一年使用:0次
2016-12-09更新
|
324次组卷
|
6卷引用:2015届陕西省西安市第八十三中学高三下学期二模考试理综化学试卷
解答题-结构与性质
|
较难(0.4)
解题方法
12. 化学选修:物质结构与性质(太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等。回答下列问题:
(1)二价铜离子的电子排布式为_______ ,已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释_______ 。

(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为_______ 。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______ 。
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为_______ ,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N=C=S)的沸点。其原因是_______ 。
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3,在BF3•NH3中B原子的杂化方式为_______ ,B与N之间形成配位键,氮原子提供_______ 。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为_______ 。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞结构如下图所示,晶胞边长为361.5pm,立方氮化硼的密度是_______ g/cm3。(只要求列算式)。

(1)二价铜离子的电子排布式为

(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3,在BF3•NH3中B原子的杂化方式为
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为

您最近一年使用:0次
2017-02-17更新
|
625次组卷
|
6卷引用:2016届广东省中山市第一中学等七校联合体高三上学期12月联合化学试卷
解答题-有机推断题
|
较难(0.4)
13. 醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为:

醋硝香豆素可以通过以下方法合成(部分反应条件省略)。
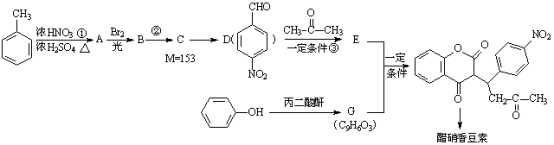
已知: + H2O
+ H2O
回答以下问题:
(1)反应①的反应类型是_____________ 。
(2)从A到B引入的官能团名称是___________ 。
(3)反应②的化学方程式为_________________________ 。
(4)反应③的化学方程式为_________________________ 。
(5)关于E物质,下列说法正确的是_________ (填字母序号)。
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(6)写出G的结构简式_____________________ 。
(7)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有____________ 种。
①可与氯化铁溶液发生显色反应;
②可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的同分异构体的结构简式为_____________________ 。

醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知:
 + H2O
+ H2O回答以下问题:
(1)反应①的反应类型是
(2)从A到B引入的官能团名称是
(3)反应②的化学方程式为
(4)反应③的化学方程式为
(5)关于E物质,下列说法正确的是
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(6)写出G的结构简式
(7)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有
①可与氯化铁溶液发生显色反应;
②可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的同分异构体的结构简式为
您最近一年使用:0次
2016-12-09更新
|
508次组卷
|
3卷引用:2015届北京市海淀区高三年级3月适应性训练理综化学试卷
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、有机化学基础、化学实验基础、物质结构与性质、化学反应原理
试卷题型(共 13题)
题型
数量
单选题
6
未知
1
解答题
5
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 新型无机非金属材料 光导纤维与硅芯片 化学在农业中的应用 | |
| 2 | 0.64 | 化学计量 | |
| 3 | 0.4 | 离子反应的发生及书写 | |
| 4 | 0.4 | 离子共存 | |
| 5 | 0.64 | 有机物的结构特点 酯 | |
| 6 | 0.65 | 有机物分离提纯的几种常见操作 物质的分离、提纯 | |
| 二、未知 | |||
| 7 | 0.4 | 元素周期表 元素周期律 | 未知 |
| 三、解答题 | |||
| 8 | 0.4 | 卤代烃 物质分离、提纯综合应用 常见有机物的制备 物质含量的测定 | 实验探究题 |
| 9 | 0.4 | 影响化学反应速率的因素 盐类水解在生活、生产中的应用 对角线规律 物质分离、提纯综合应用 | 工业流程题 |
| 11 | 0.65 | 离子反应的发生及书写 中和滴定 化学实验方案的设计与评价 硬水软化 | 实验探究题 |
| 12 | 0.4 | 晶胞的有关计算 | 结构与性质 |
| 13 | 0.4 | 根据要求书写同分异构体 卤代烃的水解反应 羧酸酯化反应 有机推断综合考查 | 有机推断题 |
| 四、填空题 | |||
| 10 | 0.4 | 化学平衡 盐类的水解 电解池 | |



