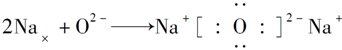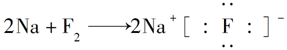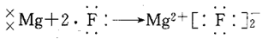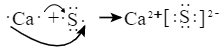河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题
河南
高一
阶段练习
2021-04-02
231次
整体难度:
适中
考查范围:
物质结构与性质、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础
河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题
河南
高一
阶段练习
2021-04-02
231次
整体难度:
适中
考查范围:
物质结构与性质、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 在“HI(s)→HI(g)→H2和I2”的变化过程中,被破坏的作用力依次是( )
| A.范德华力、范德华力 | B.共价键、离子键 |
| C.范德华力、共价键 | D.共价键、共价键 |
您最近一年使用:0次
2019-05-28更新
|
725次组卷
|
18卷引用:【区级联考】上海市杨浦区2019届高三上学期高考一模化学试题
【区级联考】上海市杨浦区2019届高三上学期高考一模化学试题【区级联考】上海市杨浦区2019届高三上学期等级考试模拟(期末)化学试题【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题安徽省亳州市第二中学2018-2019学年高二下学期5月月考化学试题上海交通大学附属中学2018-2019学年高一下学期摸底化学试题第4节 分子间作用力与物质性质——A学习区 夯实基础(鲁科版选修3)山东省泰安市2019-2020学年高二下学期期末考试化学试题上海市金山中学2019-2020学年高二上学期期末考试(等级)化学试题(已下线)山西省原平市范亭中学2018-2019学年高二4月月考化学试题吉林省辽源市第五中学2019-2020学年高一下学期期末考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质 第2课时 分子间作用力与分子的手性鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第4节 分子间作用力河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题上海市第二中学2021-2022学年高二下学期(等级班)期末考试化学试题上海市金山中学2022-2023学年高二下学期期末考试(等级)化学试题2.3.2 分子间作用力 分子的手性-随堂练习
单选题
|
适中(0.65)
名校
2. 物质的下列性质能肯定该物质为离子化合物的是
| A.水溶液能导电的化合物 | B.由金属元素和非金属元素组成的化合物 |
| C.在熔化状态下能导电的化合物 | D.熔点高的物质 |
【知识点】 化学键基本概念
您最近一年使用:0次
2016-12-09更新
|
630次组卷
|
9卷引用:2012-2013学年山东省济宁市任城一中高一3月质量检测化学试卷
(已下线)2012-2013学年山东省济宁市任城一中高一3月质量检测化学试卷2016-2017学年安徽省怀远县第二中学高一下学期期中考试化学试卷【全国百强校】山东省师范大学附属中学2018-2019学年高一下学期第一阶段学习监测化学试题河北省临漳县第一中学2018-2019学年高一下学期第一次月考化学试题【全国百强校】山东省师范大学附属中学2018-2019学年高一下学期3月月考化学试题【全国百强校】山东省师范大学附属中学2018-2019学年高一第一学期阶段性测试化学试题2020年春季鲁教版高中化学必修2第2章《化学键 化学反应与能量》测试卷河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题山东省济宁市特殊教育学校2023-2024学年高三上学期期末化学试卷
单选题
|
较难(0.4)
名校
解题方法
3. 固体A的化学式为NH5,其所有原子的最外电子层结构都符合相应稀有气体元素原子的最外电子层结构,则下列有关说法不正确的是( )
| A.1 mol NH5中含有5NA个N—H键(设NA表示阿伏加 德罗常数的值) |
| B.NH5中既有共价键又有离子键 |
C.NH5的电子式为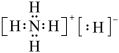 |
| D.NH5与水反应的离子方程式为NH4++H-+H2O=NH3·H2O+H2↑ |
您最近一年使用:0次
2020-03-26更新
|
1073次组卷
|
22卷引用:2013届辽宁省东北育才双语学校高三第五次模拟化学试卷
(已下线)2013届辽宁省东北育才双语学校高三第五次模拟化学试卷(已下线)2014高考化学名师知识点精编 专题6原子结构化学键练习卷2014-2015学年黑龙江省龙东南四校高一下学期期末联考化学试卷2015-2016学年吉林省前郭县五中高一下学期第一次月考化学试卷2015-2016学年四川省成都市新都一中高一下4月月考化学试卷2017届重庆市巴蜀中学高三上学期开学考试化学试卷2017届河北省定州中学高三上第三次月考化学试卷2016-2017学年辽宁省实验中学北校高一3月月考化学试卷2016-2017学年重庆市南川区三校高一下学期期中考试化学试卷黑龙江省鹤岗第一中学2016-2017学年高一下学期期中考试化学试卷黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题安徽省定远重点中学2017-2018学年高一下学期教学段考化学试题【全国百强校】安徽省合肥市第一六八中学2018-2019学年高一下学期期中考试化学试题天津市七校(静海一中、宝坻一中、杨村一中等)2020届高三上学期期中联考化学试题山西省运城市永济涑北中学2019-2020学年高一下学期3月月考化学试题吉林省长春外国语学校2020-2021学年高二上学期期初考试化学试题(已下线)4.3.1 离子键(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)4.3.1 离子键-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)天津市第八中学2021届高三上学期第三次统练化学试题(已下线)练习8 化学键2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题福建省龙岩市武平县第一中学2020-2021学年高二下学期化学月考试题
单选题
|
较易(0.85)
解题方法
4. W、X、Y、Z是互不同族且原子序数依次增大的短周期主族元素,其中X、Y为两种金属元素,W与X、Y与Z这两对原子的最外层电子数之和均为9。下列说法不正确的是
| A.W的最高价氧化物的水化物的酸性比Z的强 |
| B.X的单质在空气中燃烧,至少得到三种产物 |
| C.将Y、Z形成的二元化合物放入水中,会有特殊气味的气体逸出 |
| D.W、X、Y的简单离子半径:W>X>Y |
【知识点】 盐类双水解反应解读 元素周期律、元素周期表的推断
您最近一年使用:0次
单选题
|
适中(0.65)
名校
5. 根据表中(部分短周期元素的原子半径及主要化合价)信息,判断下列叙述正确的是( )
| 元素代号 | X | Y | Z | Q | W |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A.W2-与Y3+的核外电子数不可能相等 |
| B.离子半径大小:X+<Q2- |
| C.最高价氧化物对应水化物的碱性:X<Z |
| D.简单氢化物的稳定性:Q>W |
您最近一年使用:0次
2020-08-23更新
|
451次组卷
|
16卷引用:内蒙古杭锦后旗奋斗中学2016-2017学年高一下学期期中考试化学试题
内蒙古杭锦后旗奋斗中学2016-2017学年高一下学期期中考试化学试题(已下线)2018年9月5日《每日一题》一轮复习-微粒半径大小的比较【全国百强校】山西省平遥中学校2018-2019学年高二下学期期中考试化学试题(已下线)2019年6月5日 《每日一题》 必修2 微粒半径的大小比较(已下线)第05天 元素周期律——《2019年暑假作业总动员》高二化学河南省鹤壁市高级中学2018-2019学年高一下学期第二次段考化学试题(已下线)上海市华东师范大学第二附属中学2018-2019学年高二上学期期末考试化学试题河南省新乡市长垣市第十中学2019-2020学年高一下学期 5月份月考化学试题贵州省兴仁市凤凰中学2019-2020学年高一下学期第一次月考化学试题(已下线)第04章 物质结构 元素周期律(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)安徽省霍邱县第二中学2019-2020学年高一下学期段考化学试题四川省威远中学2020-2021学年高二上学期第一次月考化学试题(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河北省石家庄市第二中学2020-2021学年高一上学期1月份月考化学试题河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题河南省南阳市第六完全学校高级中学2021-2022学年高一下学期第一次考试化学试题
单选题
|
适中(0.65)
6. 下列变化只需要破坏离子键的是
| A.加热氯化铵 | B.干冰汽化 | C.NaCl熔化 | D.浓H2SO4溶于水 |
【知识点】 离子键 共价键 分子间作用力 氢键 化学键与化学反应本质联系解读
您最近一年使用:0次
单选题
|
较易(0.85)
名校
7. 下列选项中的所有元素组合,既能形成共价化合物,又能形成离子化合物的是( )
| A.H、N、O | B.Na、Cl、O |
| C.H、S、O | D.K、C、O |
【知识点】 化学键与物质类别关系的判断解读
您最近一年使用:0次
2020-04-09更新
|
183次组卷
|
4卷引用:第1节 化学键与物质构成——A学习区 夯实基础(鲁科版(2019)第二册)
单选题
|
较易(0.85)
解题方法
您最近一年使用:0次
2016-12-09更新
|
733次组卷
|
6卷引用:2014年高一化学人教版必修二 1-3-1离子键练习卷
单选题
|
适中(0.65)
名校
9. 已知质量数为A的某阳离子Rn+, 核外有X个电子,则核内中子数为:
| A.A-X | B.A-X- n | C.A-X+n | D.A+X-n |
【知识点】 原子中相关数值及其之间的相互关系解读
您最近一年使用:0次
2016-04-20更新
|
471次组卷
|
24卷引用:2010—2011学年广东惠阳高级中学高一第二学期期末考试化学试卷
(已下线)2010—2011学年广东惠阳高级中学高一第二学期期末考试化学试卷(已下线)2010—2011学年山东省梁山一中高一下学期期末考试化学试卷(已下线)2012-2013学年福建省晋江市季延中学高一下学期期中考试化学试卷(已下线)2012-2013学年山东省菏泽市牡丹区高一下学期期末考试化学试卷(已下线)2013-2014山东省兰陵县下学期期中考试高一化学试卷2015-2016学年上海市理工大学附属中学高二上学期期中测试化学试卷2015-2016学年福建省四地六校高一下学期第一次联考化学试卷2015-2016学年福建省厦门市翔安一中高一下3月月考化学试卷2015-2016学年福建省龙海市程溪中学高一下学期期中化学试卷2015-2016学年湖南省株洲十八中高一下期中理科化学试卷苏教版2017-2018学年高一化学必修1:1.3 人类对原子结构的认识 同步测试【校级联考】福建省平和一中、南靖一中等五校2018-2019学年高一下学期期中联考化学试题陕西省子洲中学2018-2019学年高一下学期期中考试化学试题河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题兰州市第二十七中学2020-2021学年高一下学期期中考试化学试题陕西省渭南市尚德中学2020-2021学年高一下学期第一次质量检测化学试题广西南宁市宾阳县宾阳中学2020-2021学年高一下学期期中考试化学(文)试题云南省丽江市2020-2021学年高一上学期期末教学质量监测化学试题上海市上海中学东校2021-2022学年高一上学期第一次月考化学试题山东省济南市章丘区第四中学2021-2022学年高一下学期第一次质量检测化学试题云南省玉溪市民族中学2021-2022学年高一上学期期末考试化学试题云南省曲靖市宣威市第七中学2021-2022学年高一下学期3月份考试化学试题上海市华东师范大学松江实验高级中学2021-2022学年高一上学期期中考试化学试题山东省昌乐及第中学2021-2022学年高一下学期开学考试化学试题
单选题
|
适中(0.65)
真题
名校
10. 已知33As、35Br位于同一周期,下列关系正确的是
| A.原子半径:As>Cl>P | B.热稳定性:HCl>AsH3>HBr |
| C.还原性:As3->S2->Cl- | D.酸性:H3AsO4>H2SO4>H3PO4 |
您最近一年使用:0次
2019-01-30更新
|
2769次组卷
|
55卷引用:2012年普通高等学校招生全国统一考试化学卷(北京)
2012年普通高等学校招生全国统一考试化学卷(北京)(已下线)2013届浙江省宁波市效实中学高三上学期期中考试化学试卷(已下线)2012-2013学年广东省揭阳一中高一下学期期中考试化学理科试卷(已下线)2013届上海市松江区高三上学期期末考试化学试卷(已下线)2014年高一下学期化学必修2 1-2-2 元素周期律练习卷(已下线)2014高考名师推荐化学元素周期律及化学键(已下线)2013-2014天津市天津一中第二学期期中检测高一化学试卷(已下线)2013届山西省平遥中学高三上学期12月质检考试化学试卷2015届上海市五校高三上学期联合教学质量调研化学试卷2014-2015学年山西省山西大学附中高一4月月考化学试卷2015-2016学年安徽省六安一中高二上第二次阶段测化学卷2016届陕西省西安中学高三上学期第四次质检化学试卷22015-2016学年福建省师大附中高二上学期期末化学试卷2016届湖北省七校高三下学期2月联考理综化学试卷2015-2016学年陕西西安长安一中高一下第一次月考化学卷2015-2016学年吉林省前郭县五中高一下学期第一次月考化学试卷2015-2016学年浙江省杭州市七校高一下学期期中化学试卷2015-2016学年黑龙江省齐齐哈尔一中高一下期中化学试卷2015-2016学年山西省太原五中高一下期末化学试卷2015-2016学年安徽省阜阳市红旗中学高一下第二次月考化学试卷2016-2017学年河南郑州外国语学校高二上开学考试化学2015-2016学年贵州省黔南州高一下学期期末化学试卷2016-2017学年河北省辛集中学高一下学期第二次月考化学试卷西藏山南地区第二高级中学2016-2017学年高一下学期期中考试化学试题黑龙江省伊春市第二中学2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题五课时跟踪训练--元素周期律和元素周期表【全国百强校】北京101中学2017-2018学年高一下学期期中考试化学试题河北省衡水市景县梁集中学2017-2018学年高一下学期期中考试化学试题河北景县梁集中学2017-2018学年高一下学期期中考试化学试题【全国百强校】北京市第四中学2017-2018学年高一下学期期末考试化学(选考)试题山西省实验中学2017-2018学年高一下学期第一次月考化学试题【全国百强校】北京四中2018-2019学年高一下学期期中测试化学试题辽宁省辽河油田第二高级中学2018-2019学年高二下学期期中考试化学试题新疆自治区阿克苏地区沙雅县第二中学2018-2019学年高一下学期期中考试化学试题福建省泉州第十六中学2018-2019学年高一下学期期中考试化学试题上海市同济中学2016届高三上学期期中考试化学试题北京市昌平区新学道临川学校2020届高三上学期期中考试化学试题天津市静海区第一中学2020届高三3月统练化学试题(已下线)上海建平中学2013年2月高三开学模拟考试化学试题(已下线)上海市崇明县2014届高三高考第二次模拟考试化学试题辽宁省朝阳市喀左县蒙古族第四高级中学2019-2020学年高一下学期线上考试化学试题湖北省黄冈中学2020届高三化学测试河南省开封市第二十五中2019-2020高一下学期初分科考试化学试卷北京市昌平区昌平区第一中学2020届高三下学期第三次模拟考试化学试题北京市怀柔一中2020-2021学年高二上学期9月月考化学试题湖南省常德市石门县第六中学2019-2020学年高一下学期期末考试化学试题江西省宜春市宜丰二中2020-2021学年高一下学期第一次月考化学试题江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题吉林省长春市第二实验中学2020-2021学年高二下学期4月月考化学试题(已下线)4.2元素周期律-同步学习必备知识四川省南充市白塔中学2020-2021学年高一下学期4月月考化学试题吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题海南省琼海市嘉积中学2022-2023学年高二上学期期末考试化学试题湖北省华中师范大学第一附属中学2024届高三上学期化学独立作业(9月23日)试题
单选题
|
较易(0.85)
名校
11. 重水(D2O)是重要的核工业原料,下列说法错误的是( )
| A.1mol D2O含有10NA个电子 | B.1H与D互称同位素 |
| C.H2O与D2O互称同素异形体 | D.1H→D通过化学变化不能实现 |
您最近一年使用:0次
2018-05-04更新
|
107次组卷
|
2卷引用:广西南宁市第三中学2017-2018学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
名校
12. 下列各组微粒半径大小的比较中,不正确的是( )
| A.r(K)>r(Na)>r(Li) | B.r(Mg2+)>r(Na+)>r(F-) |
| C.r(Na+)>r(Mg2+)>r(Al3+) | D.r(Br-)>r(Cl-)>r(F-) |
您最近一年使用:0次
2019-06-25更新
|
494次组卷
|
9卷引用:福建省晋江市南侨中学2018-2019学年高一下学期第二次月考化学试题
福建省晋江市南侨中学2018-2019学年高一下学期第二次月考化学试题第1章原子结构与元素周期律第2节课时1 元素周期律第一单元原子核外电子排布与元素周期律 课时2 元素周期律鲁科版(2019)必修第二册第一章第2节 课时1 元素周期律(已下线)4.2.2 元素周期表和元素周期律的应用(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)4.2.2 元素周期表和元素周期律的应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)练习7 原子结构与元素周期律2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题(已下线)4.2.2 元素周期表和元素周期律的应用-2021-2022学年高一化学10分钟课前预习练(人教版2019必修第一册)(附参考答案)
单选题
|
较易(0.85)
名校
13. 以下有关原子结构、元素周期律及元素周期表的叙述正确的是
| A.所有主族元素原子的最外层电子数都等于元素的最高正化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较低 |
| C.第ⅦA族元素从上到下,单质的熔点逐渐降低 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
您最近一年使用:0次
2021-01-08更新
|
216次组卷
|
3卷引用:河北省辛集中学2020-2021学年高一上学期12月阶段检测化学试题
单选题
|
适中(0.65)
14. 四种主族元素的离子aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,对下列叙述的判断正确的是
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
①a-b=n-m
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
| A.②③ | B.只有④ | C.①②③④ | D.①②③ |
您最近一年使用:0次
单选题
|
较难(0.4)
名校
15. 下图是氯气的制备以及氯、溴、碘的非金属性比较实验,充分反应一段时间后,打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察实验现象,下列说法正确的是


| A.F2不能与NaCl溶液反应置换出氯气 |
| B.装置B中可盛放水吸收氯气中的HCl气体 |
| C.装置E下层呈现紫红色 |
| D.装置E中有机试剂层呈现紫红色,能说明非金属性Br>I |
您最近一年使用:0次
2016-12-09更新
|
873次组卷
|
8卷引用:2014-2015四川省雅安中学高一4月月考化学试卷
2014-2015四川省雅安中学高一4月月考化学试卷2016届江西省南昌市第二中学高三上学期第三次考试化学试卷内蒙古赤峰市2019-2020学年高一下学期期末联考化学(A卷)试题(已下线)练习12 原子结构与元素的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题福建省厦门英才学校2020-2021学年高一下学期第一次月考化学试题安徽省合肥一六八中学2020-2021学年高一下学期期中考试化学试题(已下线)5.1.3 同主族元素的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)
单选题
|
容易(0.94)
16. 下列有关化学用语表示正确的是
A.质量数为31的磷原子: |
B.氟原子的结构示意图: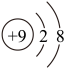 |
C.CaCl2的电子式: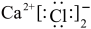 |
| D.明矾的化学式:Al2(SO4)3 |
您最近一年使用:0次
2020-03-17更新
|
2853次组卷
|
37卷引用:河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题
河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题2017年全国普通高等学校招生统一考试化学(江苏卷精编版)《课时同步君》2017-2018学年高一化学人教必修2-1.3 化学键(已下线)《周末培优君》2017-2018学年高一下学期化学-第03周 化学键(已下线)【段考模拟】高一化学下学期第一次月考(3月)原创A卷(已下线)《考前20天终极攻略》6月2日 专项二 化学用语(已下线)解密07 物质结构和元素周期律(教师版)——备战2018年高考化学之高频考点解密(已下线)学科网2019年高考化学一轮复习讲练测2.1 物质的组成、性质及分类 练【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二上学期开学考试(8月月考)化学试题【全国百强校】福建省三明市第一中学2019届高三第二次返校考试化学试题(已下线)2019高考备考二轮复习精品资料-专题1 物质的组成、性质、分类与化学用语(教学案)(已下线)考点06 原子结构 化学键——备战2019年浙江新高考化学考点吉林省白城市第十四中学2020届高三上学期期中考试化学试题新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题(已下线)专题二 物质的分类、组成和变化 化学用语(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训2020届湖南省湘潭市高三教学质量监测卷化学试题2020届浙江省杭州学军中学高三教学质量监测卷化学试题河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题辽宁省沈阳东北育才中学2020年高中毕业班教学质量监测卷理科综合化学试题江苏省震泽中学2019-2020学年高一下学期期中考试(杨班)化学试题甘肃省靖远县第四中学2019-2020学年高一下学期期中考试化学(普通班)试题甘肃省天水市第一中学2019-2020学年高一下学期第一学段考试化学试题(文)(已下线)小题必刷02 常见化学用语——2021年高考化学一轮复习小题必刷(通用版)湖南师范大学附属中学2021届高三上学期第一次月考化学试题新疆生产建设兵团第四师第一中学2019-2020学年高一下学期期中考试化学试题河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题四川省遂宁市射洪中学2020—2021学年高一下学期期中考试化学试题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题甘肃白银市第九中学2020-2021学年高一下学期月考化学试题(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点06 原子结构 化学用语-备战2022年高考化学一轮复习考点帮(浙江专用)湖北省公安县第三中学2020-2021学年高三上学期11月月考化学试题黑龙江省大庆中学2022届高三上学期第一次月考化学试题(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题04 物质结构 元素周期律-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省大庆市东风中学2022-2023学年高三上学期第一次月考化学试题四川省泸州市龙马潭区2023-2024学年高一下学期5月期中考试化学试题
二、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
17. 短周期元素A、B、C、D的原子序数依次增大, A、B同主族, A的原子核外电子数等于其电子层数, C为元素周期表中原子半径最小的金属元素, D的原子最外层电子数是其电子层数的3倍。填写下列空白:
①微粒半径比较: A-_______ (填“>”或“<”)B+。
②A与D能组成化合物A2D和A2D2,A2D的沸点比D的同主族其他元素与A组成的化合物的沸点高,原因是_______ 。
③已知:I.3Mg+N2 Mg3N2;
Mg3N2;
II.在元素周期表中,有些元素的化学性质与其相邻左上方或右下方的另一主族元素的化学性质相似。
①C构成的单质_______ (填“能”或“不能”)与强碱溶液反应。
②B构成的单质在空气中充分燃烧的产物可能是_______ 。
①微粒半径比较: A-
②A与D能组成化合物A2D和A2D2,A2D的沸点比D的同主族其他元素与A组成的化合物的沸点高,原因是
③已知:I.3Mg+N2
 Mg3N2;
Mg3N2;II.在元素周期表中,有些元素的化学性质与其相邻左上方或右下方的另一主族元素的化学性质相似。
①C构成的单质
②B构成的单质在空气中充分燃烧的产物可能是
您最近一年使用:0次
解答题-无机推断题
|
适中(0.65)
名校
18. 有A、B、C、D、E五种短周期元素,其元素特征信息如下表。
回答下列问题。
(1)写出下列元素的名称:C_______ ,E_______ 。
(2)写出A、B、C形成的化合物的化学式_______ 。
(3)B、C、D的简单离子半径由大到小的顺序是_______ (用化学式表示)。
(4)①写出E单质与A、B、C形成的化合物反应的化学方程式:_______ 。
②写出D单质与A、B、C形成的化合物的水溶液反应的离子方程式:_______ 。
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B 可以形成两种氧化物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期中最小 |
(1)写出下列元素的名称:C
(2)写出A、B、C形成的化合物的化学式
(3)B、C、D的简单离子半径由大到小的顺序是
(4)①写出E单质与A、B、C形成的化合物反应的化学方程式:
②写出D单质与A、B、C形成的化合物的水溶液反应的离子方程式:
您最近一年使用:0次
2021-04-01更新
|
43次组卷
|
2卷引用:河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题
解答题-无机推断题
|
适中(0.65)
名校
19. 化学的特征之一是从微观的层面认识物质。通过结合元素周期表与周期律,建立“位置一结构一性质”思维模型,我们可以更好地认识物质世界。
(一)X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:
(1)X在周期表中的位置是_______ ;Y、Q各自形成的简单离子中,半径较大的是_______ (填离子符号)。W和R按原子个数比1:4构成的阳离子中所含的化学键类型为_______ 。
(2)M与Z相比,非金属性较强的是_______ (填元素名称),两元素最高价氧化物的水化物中,酸性较强的是_______ (填化学式)。
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是_______ 。
(4)下列关于铍的判断正确的是( )
A.氧化铍的化学式为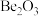 B.
B. 易溶于水
易溶于水
C. 是离子化合物 D.
是离子化合物 D.  具有两性
具有两性
(5) 和
和 可用试剂
可用试剂_______ 鉴别。
(一)X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:
| 元素代号 | X | Y(铝) | Z | M | W | Q | R |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.070 | 0.074 | 0.037 |
| 主要化合价 | +1 | +3 | +6,-2 | +7,-1 | +5,-3 | -2 | +1 |
(2)M与Z相比,非金属性较强的是
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是
(4)下列关于铍的判断正确的是
A.氧化铍的化学式为
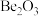 B.
B. 易溶于水
易溶于水C.
 是离子化合物 D.
是离子化合物 D.  具有两性
具有两性(5)
 和
和 可用试剂
可用试剂
您最近一年使用:0次
2021-04-01更新
|
113次组卷
|
2卷引用:河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题
解答题-实验探究题
|
适中(0.65)
解题方法
20. 某校化学学习小组设计了相关实验来探究元素周期律。该组同学为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程及现象:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸;
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹;
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a;
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后 层溶液变为紫红色。
层溶液变为紫红色。
请回答下列有关问题。
(1)B中溶液由黄色变为棕红色时发生反应的离子方程式为______ 。
(2)验证氯气的氧化性强于碘的实验现象是______ 。
(3)B和C仪器口放置浸有 溶液的棉花的作用是
溶液的棉花的作用是______ 。
(4)由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐______ (填“减弱”或“增强”)。

实验过程及现象:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸;
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹;
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a;
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后
 层溶液变为紫红色。
层溶液变为紫红色。请回答下列有关问题。
(1)B中溶液由黄色变为棕红色时发生反应的离子方程式为
(2)验证氯气的氧化性强于碘的实验现象是
(3)B和C仪器口放置浸有
 溶液的棉花的作用是
溶液的棉花的作用是(4)由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐
您最近一年使用:0次
2020-03-02更新
|
744次组卷
|
5卷引用:第一节 元素周期表 课时2 元素的性质与原子结构
三、填空题 添加题型下试题
填空题
|
较易(0.85)
名校
解题方法
21. (1)请用下列4种物质的序号填空:
①O2 ②NH4NO3 ③K2O2 ④NH3,既有离子键又有极性键的是_______ 。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为___ 。
(3)现有a~g 7种短周期元素,它们在元素周期表中的位置如图,请据此回答下列问题:
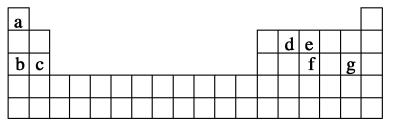
①元素的原子间反应最容易形成离子键的是_______ 。
A.c和f B.b和g C.d和g D.b和e
②d与g元素形成的分子中所有原子_______ (填“是”或“不是”)都满足最外层为8电子结构。
①O2 ②NH4NO3 ③K2O2 ④NH3,既有离子键又有极性键的是
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为
(3)现有a~g 7种短周期元素,它们在元素周期表中的位置如图,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和e
②d与g元素形成的分子中所有原子
【知识点】 “定位法”在推断中的应用解读
您最近一年使用:0次
2021-04-02更新
|
128次组卷
|
3卷引用:河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题
河南省驻马店经济开发区高级中学2020-2021学年下第一次月考化学试题河北省石家庄市第二中学2019~2020学年高一下学期3月月考化学试题(已下线)第13练 元素周期律-2022年【寒假分层作业】高一化学(人教版2019)
试卷分析
整体难度:适中
考查范围:物质结构与性质、认识化学科学、化学反应原理、常见无机物及其应用、化学实验基础
试卷题型(共 21题)
题型
数量
单选题
16
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 化学键与化学反应本质联系 范德华力对物质性质的影响 化学键与分子间作用力 | |
| 2 | 0.65 | 化学键基本概念 | |
| 3 | 0.4 | 离子方程式的正误判断 离子键概念及判断 共价键概念及判断 | |
| 4 | 0.85 | 盐类双水解反应 元素周期律、元素周期表的推断 | |
| 5 | 0.65 | 金属与非金属在周期表中位置及其性质递变的规律 微粒半径大小的比较方法 由元素性质的递变规律进行相关推断 | |
| 6 | 0.65 | 离子键 共价键 分子间作用力 氢键 化学键与化学反应本质联系 | |
| 7 | 0.85 | 化学键与物质类别关系的判断 | |
| 8 | 0.85 | 离子键的实质与形成 | |
| 9 | 0.65 | 原子中相关数值及其之间的相互关系 | |
| 10 | 0.65 | 同周期元素性质递变规律理解及应用 同主族元素性质递变规律理解及应用 | |
| 11 | 0.85 | 元素、核素、同位素 几组常见同素异形体 | |
| 12 | 0.65 | 同周期元素性质递变规律理解及应用 同主族元素性质递变规律理解及应用 | |
| 13 | 0.85 | 元素周期表结构分析 同主族元素性质递变规律 元素性质与原子结构的关系 核外电子运动 | |
| 14 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 15 | 0.4 | 氯气与还原性化合物的反应 溴、碘的性质 元素金属性、非金属性强弱探究实验 化学实验方案的设计与评价 | |
| 16 | 0.94 | 有关粒子结构的化学用语 化学用语综合判断 原子结构示意图、离子结构示意图 | |
| 二、解答题 | |||
| 17 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 “位构性”关系理解及应用 | 无机推断题 |
| 18 | 0.65 | 元素周期律、元素周期表的推断 由元素性质的递变规律进行相关推断 根据物质性质进行元素种类推断 结合物质计算的元素周期律、元素周期表相关推断 | 无机推断题 |
| 19 | 0.65 | 元素周期律、元素周期表的推断 对角线规律 由元素性质的递变规律进行相关推断 “位构性”关系理解及应用 | 无机推断题 |
| 20 | 0.65 | 氯气的制法 同主族元素性质递变规律探究实验 元素金属性、非金属性强弱探究实验 物质性质的探究 | 实验探究题 |
| 三、填空题 | |||
| 21 | 0.85 | “定位法”在推断中的应用 | |