2017年全国普通高等学校招生统一考试化学(江苏卷精编版)
江苏
高三
高考真题
2017-08-08
12933次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、常见无机物及其应用、化学实验基础、物质结构与性质、化学反应原理、有机化学基础
一、单选题 添加题型下试题
| A.夏天设定空调温度尽可能的低 | B.推广使用一次性塑料袋和纸巾 |
| C.少开私家车多乘公共交通工具 | D.对商品进行豪华包装促进销售 |
A.质量数为31的磷原子: |
B.氟原子的结构示意图: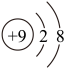 |
C.CaCl2的电子式: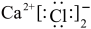 |
| D.明矾的化学式:Al2(SO4)3 |
| A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂 |
| B.ClO2具有还原性,可用于自来水的杀菌消毒 |
| C.SiO2硬度大,可用于制造光导纤维 |
| D.NH3易溶于水,可用作制冷剂 |
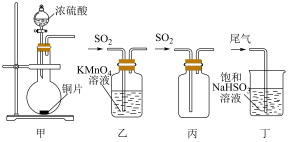
| A.用装置甲制取SO2 | B.用装置乙验证SO2的漂白性 |
| C.用装置丙收集SO2 | D.用装置丁处理实验中的尾气 |
| A.原子半径:r(X) < r(Y) < r(Z) < r(W) |
| B.W的最高价氧化物的水化物是一种弱碱 |
| C.Y的单质的氧化性比Z的强 |
| D.X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
【知识点】 “位构性”关系理解及应用解读
| A.钠与水反应:Na +2H2O=Na++2OH–+H2↑ |
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O H2↑+Cl2↑+2OH– H2↑+Cl2↑+2OH– |
| C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O |
| D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O |
【知识点】 离子反应的发生及书写
A. |
B. |
C. |
D. |
【知识点】 物质的转化
 )。下列说法不正确的是
)。下列说法不正确的是①
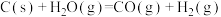
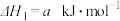
②
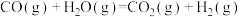
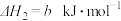
③

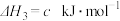
④
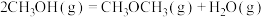
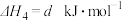
| A.反应①②为反应③提供原料气 |
B.反应③也是 资源化利用的方法之一 资源化利用的方法之一 |
C.反应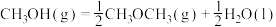 的 的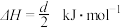 |
D.反应 的 的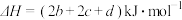 |
【知识点】 盖斯定律及其有关计算 表示燃烧热的热化学方程式书写解读
| A.无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl- |
B.c(Fe2+)=1mol·L-1的溶液中:K+、 、 、 、 、 |
C. =1×10-12的溶液中:K+、Na+、 =1×10-12的溶液中:K+、Na+、 、 、 |
D.能使甲基橙变红的溶液中:Na+、 、 、 、 、 |
【知识点】 离子反应的发生条件解读 离子共存 限定条件下的离子共存解读
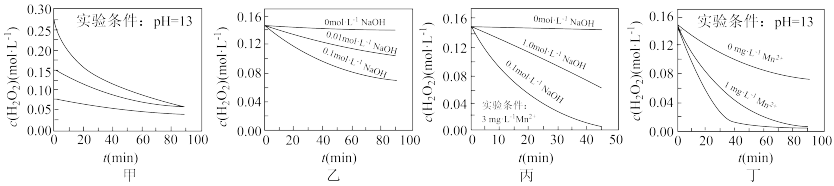
| A.图甲表明,其他条件相同时,H2O2浓度越大,其分解速率越快 |
| B.图乙表明,其他条件相同时,NaOH溶液浓度越小,H2O2分解速率越慢 |
| C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快 |
| D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大 |
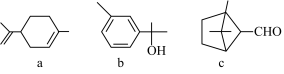
A. 和 和 都属于芳香族化合物 都属于芳香族化合物 |
B. 和 和 分子中所有碳原子均处于同一平面上 分子中所有碳原子均处于同一平面上 |
C. 、 、 、 、 均能使酸性 均能使酸性 溶液褪色 溶液褪色 |
D. 和 和 均能与新制 均能与新制 悬浊液反应生成砖红色沉淀 悬浊液反应生成砖红色沉淀 |
二、多选题 添加题型下试题
A.反应N2 (g) +3H2 (g)  2NH3 (g)的ΔH < 0,ΔS >0 2NH3 (g)的ΔH < 0,ΔS >0 |
| B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 |
| C.常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol·L-1 |
| D.常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 |
【知识点】 氧化还原反应有关计算 化学反应进行方向的判据 溶度积 金属的电化学腐蚀与防护
三、单选题 添加题型下试题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 | 苯酚浓度小 |
| B | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
| C | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜 | 蔗糖未水解 |
| D | 向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色 | 溶液中含 Br2 |
| A.A | B.B | C.C | D.D |
四、多选题 添加题型下试题
| A.浓度均为0.1 mol·L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和: 前者大于后者 |
| B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 |
| C.0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+) |
| D.0.2 mol·L-1 CH3COONa 与 0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7): c(CH3COO-) > c(Cl- ) > c(CH3COOH) > c(H+) |
 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是 | 容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| I | 0.6 | 0 | 0 | 0.2 |
| II | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A.达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5 |
| B.达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大 |
| C.达平衡时,容器Ⅲ中NO的体积分数小于50% |
| D.当温度改变为 T2时,若 k正=k逆,则 T2<T1 |
【知识点】 化学平衡状态 化学平衡的移动及其影响因素 化学平衡的有关计算
五、解答题 添加题型下试题

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是
【知识点】 氧化铝 其他含铝化合物 含氧化铝的混合物的提纯解读 电解原理的应用
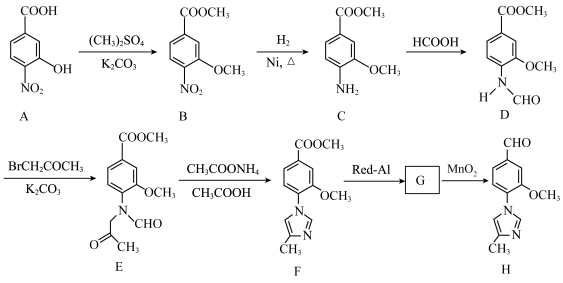
(1)C中的含氧官能团名称为
(2)D→E的反应类型为
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:
①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(4)G 的分子式为C12H14N2O2,经氧化得到H,写出G的结构简式:
(5)已知:
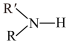

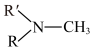 (R代表烃基,R'代表烃基或H)
(R代表烃基,R'代表烃基或H)请写出以
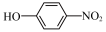 、
、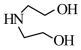 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备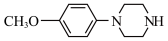 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为

(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl0.1722g;③另取25.00mL溶液A,调节pH4~5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00mL。通过计算确定该样品的化学式(写出计算过程)
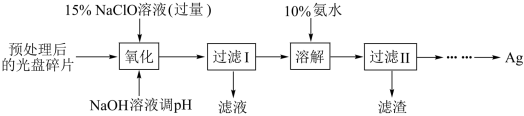
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO=2NaCl+NaClO3
②AgCl可溶于氨水:AgCl+2NH3·H2O

 + Cl− +2H2O
+ Cl− +2H2O③常温时N2H4·H2O(水合肼)在碱性条件下能还原
 :
:4
 +N2H4·H2O=4Ag↓+N2↑+4
+N2H4·H2O=4Ag↓+N2↑+4 +4NH3↑+H2O
+4NH3↑+H2O(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有
 ,其原因是
,其原因是(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图- 1和图- 2所示。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
②H3AsO4第一步电离方程式H3AsO4⇌
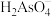 +H+的电离常数为Ka1,则pKa1=
+H+的电离常数为Ka1,则pKa1=(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷;pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为
(1)Fe3+基态核外电子排布式为
(2)丙酮(
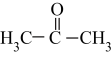 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是(3)C、H、O三种元素的电负性由小到大的顺序为
(4)乙醇的沸点高于丙酮,这是因为
(5)某FexNy的晶胞图−1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x−n) CunNy。FexNy转化为两种Cu替代型产物的能量变化图−2 所示,其中更稳定的Cu替代型产物的化学式为


【知识点】 核外电子排布的表示形式 电负性 杂化轨道理论 晶胞
步骤1:在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28mL浓H2SO4,冷却至
室温,搅拌下加入24 g NaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
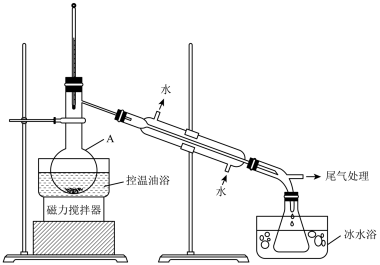
(1)仪器A的名称是
(2)反应时生成的主要有机副产品有2-溴丙烷和
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL 5%Na2CO3溶液,振荡,
试卷分析
试卷题型(共 22题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 化学科学对人类文明发展的意义 大气污染的治理原理及方法 | |
| 2 | 0.94 | 有关粒子结构的化学用语 化学用语综合判断 原子结构示意图、离子结构示意图 | |
| 3 | 0.65 | 酸、碱、盐、氧化物 氨的物理性质及用途 酸性氧化物通性 | |
| 4 | 0.65 | 二氧化硫的制备 二氧化硫的漂白性 二氧化硫与其他强氧化剂的反应 常见气体的制备与收集 | |
| 5 | 0.65 | “位构性”关系理解及应用 | |
| 6 | 0.65 | 离子反应的发生及书写 | |
| 7 | 0.65 | 物质的转化 | |
| 8 | 0.65 | 盖斯定律及其有关计算 表示燃烧热的热化学方程式书写 | |
| 9 | 0.85 | 离子反应的发生条件 离子共存 限定条件下的离子共存 | |
| 10 | 0.65 | 化学反应速率的图像 浓度对化学反应速率的影响 催化剂对化学反应速率的影响 影响化学反应速率的其他因素 | |
| 11 | 0.85 | 含碳碳双键物质的性质的推断 有机分子中原子共面的判断 芳香族化合物的区别与分类 醛类与新制氢氧化铜悬浊液的反应 | |
| 13 | 0.65 | 化学实验基础操作 物质的检验 | |
| 二、多选题 | |||
| 12 | 0.4 | 氧化还原反应有关计算 化学反应进行方向的判据 溶度积 金属的电化学腐蚀与防护 | |
| 14 | 0.4 | 溶液的酸碱性与pH 溶液pH的计算 弱电解质的电离平衡 盐类水解的应用 | |
| 15 | 0.4 | 化学平衡状态 化学平衡的移动及其影响因素 化学平衡的有关计算 | |
| 三、解答题 | |||
| 16 | 0.4 | 氧化铝 其他含铝化合物 含氧化铝的混合物的提纯 电解原理的应用 | 工业流程题 |
| 17 | 0.65 | 有机反应类型 同分异构体书写 有机物的合成 有机物的推断 | 有机推断题 |
| 18 | 0.4 | 氧化还原反应方程式的配平 常见无机物的制备 物质含量的测定 综合实验设计与评价 | 实验探究题 |
| 19 | 0.4 | 氧化还原反应方程式的配平 氨水 物质的分离、提纯 化学实验基础操作 | 工业流程题 |
| 20 | 0.4 | 氧化还原反应的应用 溶液的酸碱性与pH 弱电解质的电离平衡 | 原理综合题 |
| 21 | 0.4 | 核外电子排布的表示形式 电负性 杂化轨道理论 晶胞 | 结构与性质 |
| 22 | 0.4 | 醇的消去反应 醇的取代反应 仪器使用与实验安全 常见有机物的制备 | 实验探究题 |



