云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学
云南
高三
阶段练习
2020-02-27
242次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础、认识化学科学、常见无机物及其应用、物质结构与性质、有机化学基础
云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学
云南
高三
阶段练习
2020-02-27
242次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础、认识化学科学、常见无机物及其应用、物质结构与性质、有机化学基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 下列有关实验的说法不正确的是( )
| A.测定中和热实验的玻璃仪器只需烧杯、量筒和温度计 |
| B.用25mL碱式滴定管量取13.50mLNa2CO3溶液 |
| C.用10mL量筒量取5.5mL硫酸溶液 |
| D.用广泛pH试纸测得某碱溶液的pH为12 |
【知识点】 中和热的测定与误差分析解读 仪器使用与实验安全
您最近一年使用:0次
单选题
|
适中(0.65)
2. 下列指定反应的离子方程式正确的是
| A.钠与水反应:Na +2H2O=Na++2OH–+H2↑ |
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O H2↑+Cl2↑+2OH– H2↑+Cl2↑+2OH– |
| C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O |
| D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O |
【知识点】 离子反应的发生及书写
您最近一年使用:0次
2017-08-08更新
|
2054次组卷
|
47卷引用:2017年全国普通高等学校招生统一考试化学(江苏卷精编版)
2017年全国普通高等学校招生统一考试化学(江苏卷精编版)福建省福州市第八中学2016-2017学年高一下学期期末考试化学试题宁夏六盘山高级中学2018届高三上学期第一次月考化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题04 离子方程式类选择题解题方法和策略重庆市第二中学2018届高三3月测试化学试题(已下线)《考前20天终极攻略》-5月20日 离子共存和离子方程式(已下线)解密04 离子反应——备战2018年高考化学之高频考点解密 张燕(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 练【全国百强校】黑龙江省哈尔滨师范大学附属中学2019届高三上学期开学考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】山东省淄博市淄川中学2019届高三上学期10月月考化学试题河南省辉县市第一高级中学2019届高三上学期第二次月考化学试题山西省运城市临猗中学2019届高三上学期第一次月考化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (教学案)(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)(已下线)考点04 离子反应——备战2019年浙江新高考化学考点河北省大名县第一中学2018-2019学年高二(普通班)5月月考化学试题河北省邯郸市大名县第一中学2018-2019学年高二(清北班)5月月考化学试题(已下线)专题2.2 离子反应 离子共存及检验(练)-《2020年高考一轮复习讲练测》百所名校联考-化学物质及其变化云南省广南县第三中学2020届高三上学期开学考试化学试题四川省遂宁二中2020届高三上学期第二次月考化学试题甘肃省张掖市第二中学2019-2020学年高一上学期期中考试化学试题福建省平潭县新世纪学校2019-2020学年高一上学期第二次月考化学试题贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高三上学期期末考试化学试题云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题(已下线)专题五 离子反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题辽宁省沈阳东北育才中学2020年高中毕业班教学质量监测卷理科综合化学试题湖南省株洲市2020年高中毕业班教学质量监测卷理科综合化学试题四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题(已下线)第4单元 氧化还原反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷安徽省安庆市宜秀区白泽湖中学2021届高三上学期入学考试化学试题山西省运城市永济涑北中学2020-2021学年高三上学期10月月考化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题福建省平潭县新世纪学校2020-2021学年高二上学期第一次月考化学试题(学考)江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题专题3 第二单元综合拔高练-高中化学苏教2019版必修第一册江苏省启东市吕四中学2020-2021学年高一下学期第二次月考化学试题云南省玉溪市民族中学2021-2022年高三下学期适应性考试卷(六) 化学试题云南省丽江市第一高级中学2021-2022学年高二下学期4月月考化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题 山东省济宁市兖州区2022-2023学年高一上学期期中考试化学试题北京市第二中学2022-2023学年高一下学期期末考试化学试题云南省丽江润泽高级中学2023-2024学年高一上学期10月月考化学试题
单选题
|
适中(0.65)
名校
3. 某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水。则原固体物质的组成是 ( )
| A.Na2O2与Na2O | B.Na和NaOH | C.Na2O2和Na | D.Na和Na2O |
您最近一年使用:0次
2016-12-09更新
|
813次组卷
|
6卷引用:2012届河南省洛阳市高三上学期期中考试化学试卷
(已下线)2012届河南省洛阳市高三上学期期中考试化学试卷(已下线)2014年化学高考总复习课时演练 3-1钠及其重要化合物练习卷贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷云南省玉溪市民族中学2021-2022年高三下学期适应性考试卷(六) 化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 以下根据实验现象的推断,正确的是
| A.能使润湿的碘化钾淀粉试纸变蓝的气体一定是Cl2 |
| B.能使澄清石灰水变浑浊的无色气体一定是CO2 |
| C.在潮湿空气中能形成白雾的气态氢化物一定是HCl |
| D.溶于水能形成无色溶液的红棕色气体一定是NO2 |
您最近一年使用:0次
2016-12-09更新
|
560次组卷
|
3卷引用:2009级山东省实验中学第二次诊断性测试化学试卷
单选题
|
适中(0.65)
真题
名校
5. 短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于I A族,W与X属于同一主族。下列说法正确的是
| A.元素X、W的简单阴离子具有相同的电子层结构 |
| B.由Y、Z两种元素组成的化合物是离子化合物 |
| C.W的简单气态氢化物的热稳定性比Y的强 |
| D.原子半径:r(X)<r(Y)<r(Z)<r(W) |
【知识点】 元素周期律、元素周期表的推断
您最近一年使用:0次
2020-12-11更新
|
2726次组卷
|
57卷引用:2016年全国普通高等学校招生统一考试化学(江苏卷精编版)
2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2015-2016学年四川省广安市邻水等高一下学期期末联考化学试卷2016-2017学年湖北省宜昌一中高二上开学测化学试卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2016-2017学年河北武邑中学高二上12.4周考化学卷2017届黑龙江省哈尔滨市第六中学高三下学期第一次模拟理科综合化学试卷2016-2017学年黑龙江省虎林市高级中学高二下学期第二次月考理综化学试卷黑龙江省哈尔滨师范大学附属中学2016-2017学年高一下学期期中考试化学试题山东省潍坊市2016-2017学年高一下学期期中考试化学试题山东省烟台市第二中学2016-2017学年高一6月月考化学试题1山东省烟台市第二中学2016-2017学年高一6月月考化学试题2安徽省阜阳市临泉县第一中学2016-2017学年高一下学期学科竞赛化学试题内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题山东省昌乐第一中学2017-2018学年高一下学期第一次月考化学试题福建省厦门市双十中学2017-2018学年高一下学期期中考试化学试题浙江省余姚中学2018届高三选考科目模拟卷(一)化学(已下线)《考前20天终极攻略》-5月19日 物质结构 元素周期律广东省蓝精灵中学2018-2019学年高二上学期联考化学试题甘肃省张掖市民乐县第一中学2019届高三上学期10月月考化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题陕西省蓝田县焦岱中学2019届高三上学期第一次月考化学试题【全国百强校】四川绵阳南山中学2018-2019学年高二上学期半期考试模拟(一)化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)2016年全国普通高等学校招生统一考试化学(江苏卷参考版)【全国百强校】山东省师范大学附属中学2018-2019学年高一下学期第一阶段学习监测化学试题【全国百强校】山东省师范大学附属中学2018-2019学年高一下学期3月月考化学试题【全国百强校】山东省师范大学附属中学2018-2019学年高一第一学期阶段性测试化学试题湖北省襄阳市东风中学2018-2019学年高一下学期3月月考化学试题【全国百强校】山东省济南市外国语学校三箭分校2018-2019学年高一下学期期中考试化学试题山东省济宁市第二中学2018-2019学年高一下学期期中考试化学试题甘肃省玉门一中2018-2019学年高一下学期期末考试化学试题江苏省沭阳县修远中学2019-2020学年高二上学期第一次月考化学试题人教版高一化学必修2同步练习:第一章第二节第一课时《元素周期律》云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学江苏省南通市如皋市白蒲高级中学2019-2020学年高二下学期第一周测试化学试题河北省邯郸市第一中学2019-2020学年高一下学期第一次网上月考化学试题(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训湖南省长沙市长郡中学2020届高三4月份教学质量监测理综化学试题四川省内江市市中区天立学校2019-2020学年高一下学期第二次月考化学试题江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题江苏省震泽中学2019-2020学年高一下学期期中考试(杨班)化学试题黑龙江省哈尔滨市第六中学校2019-2020学年高二下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高一下学期第五次综合测试化学试题吉林省吉林市吉化第一高级中学校2019-2020学年高一下学期期末考试化学试题人教版(2019)高一必修第一册 第四章 物质结构 元素周期律 第三节 化学键 高考帮(已下线)4.2.2 元素周期表和元素周期律的应用(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)4.2.2 元素周期表和元素周期律的应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)广东省深圳外国语学校2021届高三上学期11月月考化学试题专题5 第二单元综合拔高练-高中化学苏教2019版必修第一册重庆市杨家坪中学2020-2021学年高一上学期1月月考化学试题【石家庄新东方】2020-2021石家庄二十二中高一3月考化学试题(已下线)专题4.3.1 离子键(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)4.2.2 元素周期表和元素周期律的应用-2021-2022学年高一化学10分钟课前预习练(人教版2019必修第一册)(附参考答案)云南昭通市第一中学2021-2022学年高一下学期期中考试化学试题江苏省南京师范大学苏州实验学校2021-2022学年高一上学期12月月考(日新班)化学试题陕西省渭南市白水县中学2021-2022学年高一下学期第三次月考化学试题新疆伊犁哈萨克自治州伊犁州华—伊十校联盟2022-2023学年高一下学期4月期中联考化学试题
单选题
|
适中(0.65)
名校
6. 下列叙述不正确的是
| A.金属腐蚀的本质是金属原子失去电子而被氧化 |
| B.钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O=4OH- |
| C.氢氧燃料电池中,氢气在负极发生氧化反应 |
| D.将地下钢管与直流电源的正极相连,用来保护钢管 |
【知识点】 金属的电化学腐蚀与防护 燃料电池原理及优点解读
您最近一年使用:0次
2016-12-09更新
|
546次组卷
|
8卷引用:2015届北京市清华大学附属中学高三3月综合测(三)化学试卷
单选题
|
适中(0.65)
名校
7. 某有机物的键线式如图所示,下列关于该有机物的描述不正确的是
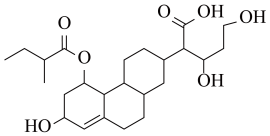

| A.含有4种官能团 |
| B.能发生取代、加成、酯化、氧化、还原等反应 |
| C.1mol该物质最多可与3molH2发生加成反应 |
| D.该有机物与Na、NaOH、Na2CO3均能反应 |
您最近一年使用:0次
2019-09-15更新
|
327次组卷
|
3卷引用:云南省富宁县第一中学2020届高三第一学期开学考试化学试题
二、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
8. 焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________ 。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:__________ 溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________ 。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________ 。电解后,__________ 室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。_____________ ,该样品中Na2S2O5的残留量为____________ g·L−1(以SO2计)。
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:

②工艺中加入Na2CO3固体、并再次充入SO2的目的是
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为

您最近一年使用:0次
2018-06-09更新
|
14952次组卷
|
11卷引用:2018年全国普通高等学校招生统一考试化学(新课标I卷)
2018年全国普通高等学校招生统一考试化学(新课标I卷)(已下线)2018年高考题及模拟题汇编 专题15 工艺流程题四川省攀枝花市第十二中学2019届高三上学期10月月考化学试题广东省惠州市第一中学2019届高三上学期理科综合测试(二)化学试题(已下线)《2019年高考总复习巅峰冲刺》专题11 化学工艺流程题应试策略(已下线)考点06 典型的非金属元素及其化合物——《备战2020年高考精选考点专项突破题集》云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训黑龙江省密山四中2020-2021学年高二下学期期末考试化学试题(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)重庆市西南大学附属中学校2022-2023学年高三上学期开学定时训练化学试题
解答题-工业流程题
|
适中(0.65)
名校
9. 欲降低废水中重金属元素铬的毒性,可将Cr2O 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
(1)某含铬废水处理的主要流程如图所示:
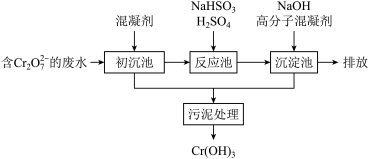
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____ 。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____ 、____ 。证明Cr3+沉淀完全的方法是____ 。
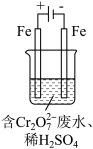
(2)工业可用电解法来处理含Cr2O 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____ ,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____ g。
 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:| 离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
(1)某含铬废水处理的主要流程如图所示:

①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是
(2)工业可用电解法来处理含Cr2O
 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是
您最近一年使用:0次
2019-09-19更新
|
205次组卷
|
4卷引用:云南省陇川县一中2020届高三上学期开学考试化学试题
三、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
解题方法
10. (1)今年来我国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是___________ (填字母)。
a.SO2 b.NO2 c.CO2 d.PM2.5
(2)天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。明矾能净水的原理是_______ ,写出检验明矾中Al3+的实验方法________ 。
(3)A、B、C 三个城市全年雨水的月平均pH变化如下图1 所示。
①受酸雨危害最严重的是_____________ 城市。
②汽车尾气中含有NO2、NO、CO 等有害气体,写出由NO2形成硝酸型酸雨的化学方程式______________ 。
③用纳米二氧化钛光触媒技术,将汽车尾气中的NOx 和CO 转化为无害气体,写出该反应的化学方程式____________________ 。
④测量汽车尾气的浓度常用电化学气敏传感器,其中CO 传感器可用下图2 简单表示,则阳极发生的电极反应_________________ 。

a.SO2 b.NO2 c.CO2 d.PM2.5
(2)天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。明矾能净水的原理是
(3)A、B、C 三个城市全年雨水的月平均pH变化如下图1 所示。
①受酸雨危害最严重的是
②汽车尾气中含有NO2、NO、CO 等有害气体,写出由NO2形成硝酸型酸雨的化学方程式
③用纳米二氧化钛光触媒技术,将汽车尾气中的NOx 和CO 转化为无害气体,写出该反应的化学方程式
④测量汽车尾气的浓度常用电化学气敏传感器,其中CO 传感器可用下图2 简单表示,则阳极发生的电极反应

【知识点】 硫、氮氧化物对人体、环境的危害 酸雨解读
您最近一年使用:0次
2016-01-08更新
|
115次组卷
|
2卷引用:2015-2016学年浙江省台州中学高二上期中测试化学试卷
四、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
11. [化学—选修3:物质结构与性质]
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______ 。
(2)四种元素中第一电离最小的是________ ,电负性最大的是________ 。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
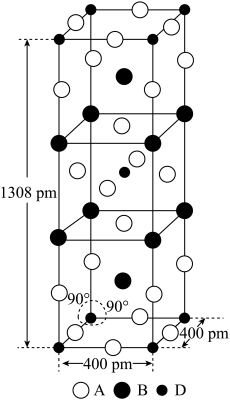
①该化合物的化学式为_________________ ;D的配位数为___________ ;
②列式计算该晶体的密度_______ g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____________ ;该化合物中存在一个复杂离子,该离子的化学式为_______________ ,配位体是____________ 。
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为
(2)四种元素中第一电离最小的是
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。

①该化合物的化学式为
②列式计算该晶体的密度
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有
您最近一年使用:0次
2019-01-30更新
|
2976次组卷
|
9卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷)(已下线)2014高考名师推荐化学选做题练习1(已下线)2014高考名师推荐化学--预测16(已下线)2015届广西桂林中学高三10月月考理综化学试卷(已下线)2015届广西桂林中学高三10月月考理综化学试卷山西省怀仁县第一中学(两校区)2016-2017学年高二下学期期末考试化学试题山西省太原市第二十一中学2020届高三上学期期中考试化学试题云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题
解答题-有机推断题
|
适中(0.65)
12. 8−羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8−羟基喹啉的合成路线。
(1)按官能团分类,A的类别是__________ 。
(2)A→B的化学方程式是____________________ 。
(3)C可能的结构简式是__________ 。
(4)C→D所需的试剂a是__________ 。
(5)D→E的化学方程式是__________ 。
(6)F→G的反应类型是__________ 。
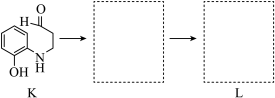
(7)将下列K→L的流程图补充完整:____________ __________ (填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________ 。
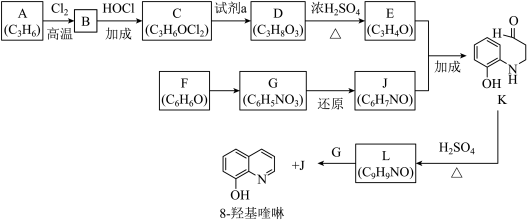
已知:i.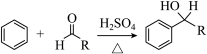
(1)按官能团分类,A的类别是
(2)A→B的化学方程式是
(3)C可能的结构简式是
(4)C→D所需的试剂a是
(5)D→E的化学方程式是
(6)F→G的反应类型是
(7)将下列K→L的流程图补充完整:
您最近一年使用:0次
2018-06-09更新
|
5054次组卷
|
14卷引用:2018年全国普通高等学校招生统一考试化学(北京卷)
2018年全国普通高等学校招生统一考试化学(北京卷)(已下线)2018年高考题及模拟题汇编 专题17 有机化学合成与推断(选修)云南省玉溪市峨山一中2019届高三9月上学期月考化学试题云南省开远市实验中学2020届高三上学期开学考试化学试题(已下线)考点19 有机化学综合——《备战2020年高考精选考点专项突破题集》四川省成都市龙泉中学2019-2020学年度高三1月月考理综化学试题贵州省三都水族自治县高级中学2019-2020学年高三上学期期末考试理综化学试题贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高三上学期期末考试化学试题云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学(已下线)专题17 有机合成与推断不丢分-2021年高考化学必做热点专题(已下线)解密13 有机化学基础(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练第2章 官能团与有机化学反应 烃的衍生物——C挑战区 模拟高考(鲁科版选修5)天津市南开中学2024届高三下学期第五次月检测化学试卷
试卷分析
整体难度:适中
考查范围:化学反应原理、化学实验基础、认识化学科学、常见无机物及其应用、物质结构与性质、有机化学基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 中和热的测定与误差分析 仪器使用与实验安全 | |
| 2 | 0.65 | 离子反应的发生及书写 | |
| 3 | 0.65 | 过氧化钠与水的反应 | |
| 4 | 0.65 | 氯气 二氧化氮 常见气体的检验 | |
| 5 | 0.65 | 元素周期律、元素周期表的推断 | |
| 6 | 0.65 | 金属的电化学腐蚀与防护 燃料电池原理及优点 | |
| 7 | 0.65 | 单烯烃的加成反应 醇类的化学性质 羧酸化学性质 酯的化学性质 | |
| 二、解答题 | |||
| 8 | 0.65 | 电解原理的应用 物质含量的测定 物质制备的探究 | 工业流程题 |
| 9 | 0.65 | 离子反应的发生及书写 氧化还原反应方程式的配平 电化学计算 常见无机物的制备 | 工业流程题 |
| 11 | 0.65 | 物质结构与性质综合考查 轨道表示式 晶胞的有关计算 离子晶体 | 结构与性质 |
| 12 | 0.65 | 根据要求书写同分异构体 羧酸酯化反应 逆合成分析法 有机推断综合考查 | 有机推断题 |
| 三、填空题 | |||
| 10 | 0.65 | 硫、氮氧化物对人体、环境的危害 酸雨 | |



