四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题
四川
高三
模拟预测
2020-07-01
522次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、常见无机物及其应用、化学反应原理、物质结构与性质、认识化学科学、化学实验基础
四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题
四川
高三
模拟预测
2020-07-01
522次
整体难度:
适中
考查范围:
有机化学基础、化学与STSE、常见无机物及其应用、化学反应原理、物质结构与性质、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
1. 科学防护对预防病毒感染非常重要,下列说法错误的是
| A.冠状病毒粒子直径约60-220 nm,介于溶液和胶体粒子之间 |
| B.制作防护服和口罩的无纺布是有机高分子材料 |
| C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性 |
| D.二氧化氯泡腾片可用于水处理 |
【知识点】 蛋白质的变性 化学科学对人类文明发展的意义解读
您最近一年使用:0次
2020-05-19更新
|
1048次组卷
|
8卷引用:广东省佛山市2020届高三教学质量检测(二模)理科综合化学试题
广东省佛山市2020届高三教学质量检测(二模)理科综合化学试题四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题(已下线)专题01 STSE 化学用语-2020年高考真题和模拟题化学分项汇编内蒙古赤峰市2019-2020学年高一下学期期末联考化学(A卷)试题(已下线)专题01 物质的组成、性质和分类——备战2021年高考化学纠错笔记河南省信阳市罗山县2021-2022学年高三上学期高中毕业班第二次调研考试化学试题四川省宜宾市叙州区第一中学校2022届高三高考适应性考试理综化学试题广西贺州市钟山县钟山中学2020-2021学年高二下学期第三次月考理科化学试题
单选题
|
适中(0.65)
名校
解题方法
2. 化合物c的制备原理如下:
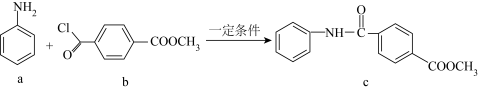
下列说法正确的是

下列说法正确的是
| A.该反应为加成反应 | B.化合物a中所有原子一定共平面 |
| C.化合物C的一氯代物种类为5种 | D.化合物b、c均能与NaOH溶液反应 |
【知识点】 有机官能团的性质及结构 同分异构体的数目的确定解读
您最近一年使用:0次
2020-05-19更新
|
841次组卷
|
11卷引用:广东省佛山市2020届高三教学质量检测(二模)理科综合化学试题
广东省佛山市2020届高三教学质量检测(二模)理科综合化学试题四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题广东省汕头市金山中学2020届高三下学期第三次模拟考试(6月) 理科综合化学试题(已下线)专题12 有机化合物-2020年高考真题和模拟题化学分项汇编内蒙古赤峰市宁城县2021届高三9月摸底考试化学试题(已下线)学科网2020年6月高三大联考考后强化卷(新课标Ⅰ卷)化学试题黑龙江省哈尔滨工业大学附属中学2020-2021学年度高二下学期期末考试化学试题(已下线)第36讲 生物大分子与合成高分子(练) — 2022年高考化学一轮复习讲练测(新教材新高考)四川省泸县第五中学2022届高三三诊模拟考试理科综合化学试题(已下线)专题十一 有机化学基础 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)热点题型特训 新情境迁移考查有机化合物的结构和性质
单选题
|
适中(0.65)
名校
3. 下列实验及现象不能得出相应结论的是
| 选项 | 实验 | 现象 | 结论 |
| A | 某溶液中滴加K3[(Fe(CN)6]溶液 | 产生蓝色沉淀 | 原溶液中有 Fe2+ |
| B | 将CO2依次通过 NaHSO3溶液、品红溶液 | 品红溶液不褪色 | H2SO3的酸性强于比H2CO3 |
| C | 向 l mL 新制氢氧化铜悬浊液中滴加适量 10 %葡萄糖溶液,加热煮沸 | 产生砖红色沉淀 | 葡萄糖具有还原性 |
| D | 向 lmL0. l mol/L AgNO3溶液中滴加4~5 滴 0.l mol/L KI 溶液,再滴加几滴 0. 1mo l/L Na2S 溶液 | 先有黄色沉淀生成;后又有黑色沉淀 | Ksp (AgI )> Ksp (Ag2S) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-05-18更新
|
369次组卷
|
2卷引用:广东省肇庆市2020届高三第三次检测理科综合化学试题
单选题
|
适中(0.65)
名校
解题方法
4. W、X、Y、Z 均为短周期主族元素,X与Z同族,X核外电子总数等于Y最外层电子数,Y是短周期中非金属性最强的元素,W与Z的最高化合价之和为8, 且W原子半径小于Z。下列叙述正确的是
| A.气态简单氢化物的稳定性:Z>X>W |
| B.W和Y可形成共价化合物WY3,且WY3中W、Y均满足最外层 8 电子稳定结构 |
| C.常温下,0.l mol•L-1Z的最高价氧化物对应水合物水溶液的 pH >l |
| D.常温下,与W同族且相邻元素的单质能溶于X的最高价氧化物对应水化物的浓溶液。 |
您最近一年使用:0次
2020-05-18更新
|
159次组卷
|
2卷引用:广东省肇庆市2020届高三第三次检测理科综合化学试题
单选题
|
适中(0.65)
5. 下列指定反应的离子方程式正确的是
| A.钠与水反应:Na +2H2O=Na++2OH–+H2↑ |
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O H2↑+Cl2↑+2OH– H2↑+Cl2↑+2OH– |
| C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O |
| D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O |
【知识点】 离子反应的发生及书写
您最近一年使用:0次
2017-08-08更新
|
2085次组卷
|
47卷引用:2017年全国普通高等学校招生统一考试化学(江苏卷精编版)
2017年全国普通高等学校招生统一考试化学(江苏卷精编版)福建省福州市第八中学2016-2017学年高一下学期期末考试化学试题宁夏六盘山高级中学2018届高三上学期第一次月考化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题04 离子方程式类选择题解题方法和策略重庆市第二中学2018届高三3月测试化学试题(已下线)《考前20天终极攻略》-5月20日 离子共存和离子方程式(已下线)解密04 离子反应——备战2018年高考化学之高频考点解密 张燕(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 练【全国百强校】黑龙江省哈尔滨师范大学附属中学2019届高三上学期开学考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】山东省淄博市淄川中学2019届高三上学期10月月考化学试题河南省辉县市第一高级中学2019届高三上学期第二次月考化学试题山西省运城市临猗中学2019届高三上学期第一次月考化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (教学案)(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)(已下线)考点04 离子反应——备战2019年浙江新高考化学考点河北省大名县第一中学2018-2019学年高二(普通班)5月月考化学试题河北省邯郸市大名县第一中学2018-2019学年高二(清北班)5月月考化学试题(已下线)专题2.2 离子反应 离子共存及检验(练)-《2020年高考一轮复习讲练测》百所名校联考-化学物质及其变化云南省广南县第三中学2020届高三上学期开学考试化学试题四川省遂宁二中2020届高三上学期第二次月考化学试题甘肃省张掖市第二中学2019-2020学年高一上学期期中考试化学试题福建省平潭县新世纪学校2019-2020学年高一上学期第二次月考化学试题贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高三上学期期末考试化学试题云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题(已下线)专题五 离子反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题辽宁省沈阳东北育才中学2020年高中毕业班教学质量监测卷理科综合化学试题湖南省株洲市2020年高中毕业班教学质量监测卷理科综合化学试题四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题(已下线)第4单元 氧化还原反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷安徽省安庆市宜秀区白泽湖中学2021届高三上学期入学考试化学试题山西省运城市永济涑北中学2020-2021学年高三上学期10月月考化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题福建省平潭县新世纪学校2020-2021学年高二上学期第一次月考化学试题(学考)江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题专题3 第二单元综合拔高练-高中化学苏教2019版必修第一册江苏省启东市吕四中学2020-2021学年高一下学期第二次月考化学试题云南省玉溪市民族中学2021-2022年高三下学期适应性考试卷(六) 化学试题云南省丽江市第一高级中学2021-2022学年高二下学期4月月考化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题 山东省济宁市兖州区2022-2023学年高一上学期期中考试化学试题北京市第二中学2022-2023学年高一下学期期末考试化学试题云南省丽江润泽高级中学2023-2024学年高一上学期10月月考化学试题
单选题
|
较难(0.4)
6. 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
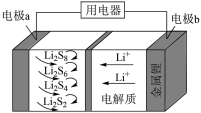

| A.电池工作时,正极可发生反应:2Li2S6+2Li++2e−=3Li2S4 |
| B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g |
| C.石墨烯的作用主要是提高电极a的导电性 |
| D.电池充电时间越长,电池中Li2S2的量越多 |
您最近一年使用:0次
2017-08-08更新
|
13299次组卷
|
44卷引用:河北省安平中学2016-2017学年高二下学期期末考试化学试题
河北省安平中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)陕西师范大学附中2017-2018第一学期高二年级化学期中考试化学试题湖南省长沙市长郡中学2017-2018学年度高二第一学期期末考试化学试题新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题(已下线)《考前20天终极攻略》-5月22日 电化学基础(已下线)解密09 电化学(教师版)——备战2018年高考化学之高频考点解密陕西省西安市交通大学附属中学2017-2018学年高二第二次月考期末选修四测试化学试题【全国百强校】湖南省岳阳市第一中学2017-2018学年高二下学期期末考试化学试题(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)(已下线)考点09 原电池原理及其应用——备战2019年浙江新高考化学考点新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题河北省承德第一中学2019-2020学年高二上学期开学考试化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题步步为赢 高二化学寒假作业:作业十二 原电池原理及其应用吉林省延边第二中学2019-2020学年高二12月月考化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训专题2 化学反应与能量转化——C挑战区 模拟高考(苏教版必修2)广东省深圳中学2020届高三4月份教学质量监测理综化学试题2020届湖南省湘潭市高三教学质量监测卷化学试题河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题河北省衡水中学2020届高三下学期二月份网络教学质量监测理科综合化学试题(已下线)专题6.2 原电池 化学电源(讲)——2020年高考化学一轮复习讲练测(已下线)专题6.2 原电池 化学电源(练)——2020年高考化学一轮复习讲练测四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题(已下线)第20讲 原电池 化学电源(精讲)——2021年高考化学一轮复习讲练测人教版(2019)高二化学选择性必修1第四章 化学反应与电能 过高考 3年真题强化闯关(已下线)专题08 电化学(化学电源、离子交换膜电池、信息类电化学等)-2021年高考化学必做热点专题云南省保山第九中学2021届高三上学期开学考试化学试题陕西省西安市庆华中学2020-2021学年高三上学期第二次月考化学试题(已下线)课时32 可充电电池装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第16讲 原电池 (讲)— 2022年高考化学一轮复习讲练测(新教材新高考)陕西省西安市长安区第一中学2017-2018学年高二上学期第四次教学质量检测化学试题山西省长治市第二中学校2021-2022学年高二上学期第二次月考化学试题云南省景东彝族自治县第一中学2021-2022学年高三下学期3月份考试化学试题(已下线)第16讲 原电池 新型电源 (练)-2023年高考化学一轮复习讲练测(新教材新高考)云南省罗平县第五中学2021-2022学年高二下学期6月月考化学试题云南省富宁县第一中学校2021-2022学年高三下学期开学考试理综化学试题(已下线)题型17 锂电池和锂离子电池的应用(已下线)第六章 化学反应与能量 第36练 新型化学电源(已下线)专题五 锂电池和锂离子电池(练习)福建省厦门市湖滨中学2023-2024学年高二上学期期中考试化学试题
单选题
|
较易(0.85)
名校
7. 我国科学家开发设计一种天然气脱硫装置,利用如图装置可实现:H2S+O2=H2O2 +S↓。已知甲池中有如图所示的转化。下列说法错误的是


| A.该装置可将光能转化为电能和化学能 |
| B.该装置工作时,溶液中的H+从甲池经过全氟磺酸膜进入乙池 |
| C.甲池碳棒上发生电极反应:AQ+2H+ +2e- =H2AQ |
D.乙池①处发生反应:H2S+I =3I-+S↓+2H+ =3I-+S↓+2H+ |
您最近一年使用:0次
2021-01-18更新
|
307次组卷
|
6卷引用:【市级联考】广东省汕头市2019届高三第一学期期末考试化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
名校
8. 化学是一门以实验为基础的学科,实验探究能激发学生学习化学的兴趣。某化学兴趣小组设计如图实验装置(夹持设备已略)制备氯气并探究氯气及其卤族元素的性质。回答下列问题:

(1)仪器a的名称是______________ 。
(2)A装置中发生的化学反应方程式为_________________________________ 。若将漂白粉换成KClO3,则反应中每生成21.3g Cl2时转移的电子数目为____ NA。
(3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到__________ 。
(4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入____ (填选项a或b或c)。
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可观察到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴,打开活塞,将D中少量溶液加入E中,振荡E,观察到的现象是_______________________________ ,该现象_____ (填“能”或“不能”)说明溴的非金属性强于碘,原因是_____________________ 。

(1)仪器a的名称是
(2)A装置中发生的化学反应方程式为
(3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到
(4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
| b | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
| c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
您最近一年使用:0次
2019-01-30更新
|
500次组卷
|
3卷引用:【市级联考】广东省汕头市2019届高三第一学期期末考试化学试题
解答题-工业流程题
|
适中(0.65)
名校
解题方法
9. 铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3和+6价等价态。工业上以铬铁矿 主要成分为
主要成分为 ,含有
,含有 、
、 等杂质
等杂质 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠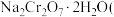 已知
已知  是一种强氧化剂
是一种强氧化剂 ,其主要工艺流程如下:
,其主要工艺流程如下:
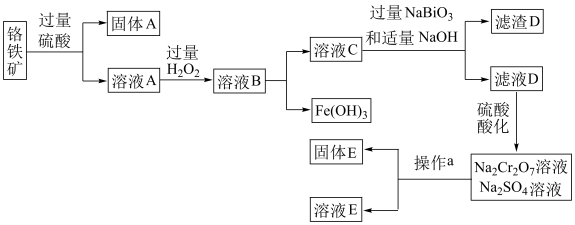
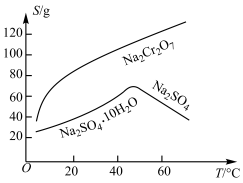
查阅资料得知:常温下, 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以 为原料,利用铝热反应制取金属铬的化学方程式
为原料,利用铝热反应制取金属铬的化学方程式_______________ 。
(2)酸化滤液D时,不选用盐酸的原因是_____________ 。
(3)固体E的主要成分是 ,根据如图分析操作a为
,根据如图分析操作a为________________ 、____________ 、洗涤、干燥。
(4)已知含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的 。
。

① 的化学性质与
的化学性质与  相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________  用离子方程式表示
用离子方程式表示 ;
;
②下列溶液中可以代替上述流程中 溶液最佳的是
溶液最佳的是___________ (填选项序号);
A. 溶液 B.浓
溶液 B.浓 C.酸性
C.酸性 溶液 D.
溶液 D.  溶液
溶液
③上述流程中,每消耗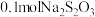 转移
转移 ,则加入
,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为_____________ 。
(5)某厂废水中含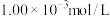 的
的 ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 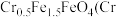 的化合价为
的化合价为 ,Fe的化合价依次为
,Fe的化合价依次为 、
、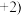 。欲使1L该废水中的
。欲使1L该废水中的  完全转化为
完全转化为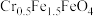 。理论上需要加入
。理论上需要加入________  。(已知
。(已知 摩尔质量为
摩尔质量为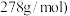
 主要成分为
主要成分为 ,含有
,含有 、
、 等杂质
等杂质 为主要原料生产金属铬和重铬酸钠
为主要原料生产金属铬和重铬酸钠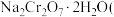 已知
已知  是一种强氧化剂
是一种强氧化剂 ,其主要工艺流程如下:
,其主要工艺流程如下:

查阅资料得知:常温下,
 不溶于水,有强氧化性,在碱性条件下,能将
不溶于水,有强氧化性,在碱性条件下,能将 转化为
转化为
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以
 为原料,利用铝热反应制取金属铬的化学方程式
为原料,利用铝热反应制取金属铬的化学方程式(2)酸化滤液D时,不选用盐酸的原因是
(3)固体E的主要成分是
 ,根据如图分析操作a为
,根据如图分析操作a为(4)已知含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的
 。
。
①
 的化学性质与
的化学性质与  相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为
相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 用离子方程式表示
用离子方程式表示 ;
;②下列溶液中可以代替上述流程中
 溶液最佳的是
溶液最佳的是A.
 溶液 B.浓
溶液 B.浓 C.酸性
C.酸性 溶液 D.
溶液 D.  溶液
溶液③上述流程中,每消耗
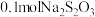 转移
转移 ,则加入
,则加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为(5)某厂废水中含
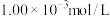 的
的 ,某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,某研究性学习小组为了变废为宝,将废水处理得到磁性材料 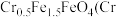 的化合价为
的化合价为 ,Fe的化合价依次为
,Fe的化合价依次为 、
、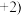 。欲使1L该废水中的
。欲使1L该废水中的  完全转化为
完全转化为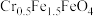 。理论上需要加入
。理论上需要加入 。(已知
。(已知 摩尔质量为
摩尔质量为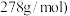
您最近一年使用:0次
2020-02-04更新
|
302次组卷
|
3卷引用:广东省深圳中学2019届高三5月适应性考试理综化学试题
(已下线)广东省深圳中学2019届高三5月适应性考试理综化学试题2020届高考化学二轮复习大题精准训练 —— 制备类无机工艺流程题四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题
解答题-原理综合题
|
适中(0.65)
名校
10. (1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1 )+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________ 。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=______ (用含K1、K2的表达式表示),该反应△H_____ 0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________ (填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________ (填字母符号)。
(3)以CO、H2为原料合成 甲醇的反应为:CO(g)+2H2(g)
甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
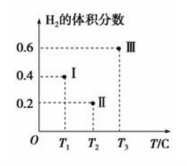
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________ 。
②三个容器中一定达到平衡状态的是容器________ (填写容器代号)。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1
 )+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1乙:CO2(g)+H2(g)
 CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2①CO(g)+2H2(g)
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=②提高CO2转化为CH3OH平衡转化率的措施有
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
| 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
| 543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
| 543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
| 553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
| 553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为
(3)以CO、H2为原料合成
 甲醇的反应为:CO(g)+2H2(g)
甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为
②三个容器中一定达到平衡状态的是容器
【知识点】 化学反应热的计算 化学平衡常数 化学平衡状态的判断方法解读
您最近一年使用:0次
2018-08-09更新
|
1197次组卷
|
8卷引用:【全国校级联考】山东省七校联合体2018届高三第二次联考理科综合化学试题
解答题-结构与性质
|
较难(0.4)
名校
解题方法
11. 在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________ (填“晶体”或“非晶体”)。
(2)基态铜原子有________ 个未成对电子;Cu2+的电子排布式为____________________ ;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为____________________ ,其所含化学键有____________________ ,乙醇分子中C原子的杂化轨道类型为________ 。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________ 。(SCN)2对应的酸有硫氰酸(H—S—C≡N)、异硫氰酸(H—N===C===S)两种。理论上前者沸点低于后者,其原因是______________________________________________________________________________________ 。
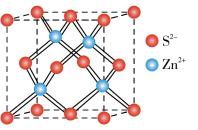
(4)ZnS的晶胞结构如图所示,在ZnS晶胞中,S2-的配位数为_______________ 。
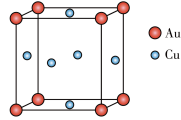
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为________ g·cm-3(用含a、NA的代数式表示)。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于
(2)基态铜原子有
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为

(4)ZnS的晶胞结构如图所示,在ZnS晶胞中,S2-的配位数为

(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为
您最近一年使用:0次
2019-04-09更新
|
777次组卷
|
7卷引用:广东省广州外国语学校2019届高三下学期第一次热身考试化学试题
广东省广州外国语学校2019届高三下学期第一次热身考试化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期期末考试化学试题(已下线)第11章 单元测试(测)-《2020年高考一轮复习讲练测》四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题河北省沧州市盐山县盐山中学2019-2020学年高二下学期期末考试化学试题(已下线)第34讲 原子结构与性质-2021年高考化学一轮复习名师精讲练(已下线)第十一章 能力提升检测卷-2021年高考化学一轮复习讲练测
解答题-有机推断题
|
较难(0.4)
名校
12. 氨甲环酸(G)别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略):

回答下列问题:
(1)A的结构简式是____ 。C的化学名称是_______ 。
(2)G在NaOH催化下发生双分子脱水形成仅含两个环的有机物,写出该反应的化学反应方程式____ 。
(3)①~⑥中属于取代反应的是_________ 。
(4)E中不含N原子的官能团名称为___________ 。
(5)氨甲环酸(G)的分子式为__________ 。
(6)满足以下条件的所有E的同分异构体有_____ 种。
a.含苯环 b.含硝基 c.苯环上只有两个取代基
(7)写出以 和CH2=CHCOOCH2CH3为原料,制备
和CH2=CHCOOCH2CH3为原料,制备 的合成路线:
的合成路线:_______ (无机试剂任性)

回答下列问题:
(1)A的结构简式是
(2)G在NaOH催化下发生双分子脱水形成仅含两个环的有机物,写出该反应的化学反应方程式
(3)①~⑥中属于取代反应的是
(4)E中不含N原子的官能团名称为
(5)氨甲环酸(G)的分子式为
(6)满足以下条件的所有E的同分异构体有
a.含苯环 b.含硝基 c.苯环上只有两个取代基
(7)写出以
 和CH2=CHCOOCH2CH3为原料,制备
和CH2=CHCOOCH2CH3为原料,制备 的合成路线:
的合成路线:
您最近一年使用:0次
2019-11-13更新
|
214次组卷
|
2卷引用:广东省广州市华南师范大学附中2020届高三上学期第二次月考理综化学试题
试卷分析
整体难度:适中
考查范围:有机化学基础、化学与STSE、常见无机物及其应用、化学反应原理、物质结构与性质、认识化学科学、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 蛋白质的变性 化学科学对人类文明发展的意义 | |
| 2 | 0.65 | 有机官能团的性质及结构 同分异构体的数目的确定 | |
| 3 | 0.65 | Fe2+的鉴别及其应用 沉淀转化 溶度积常数与溶解度的关系 葡萄糖与新制氢氧化铜溶液的反应 | |
| 4 | 0.65 | 元素非金属性强弱的比较方法 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 “位构性”关系理解及应用 | |
| 5 | 0.65 | 离子反应的发生及书写 | |
| 6 | 0.4 | 原电池 新型电池 | |
| 7 | 0.85 | 原电池原理 原电池电子流向判断及应用 原电池电极反应式书写 新型电池 | |
| 二、解答题 | |||
| 8 | 0.4 | 氯水 漂白粉和漂粉精 氯气的实验室制法 物质性质的探究 | 实验探究题 |
| 9 | 0.65 | 氧化还原反应方程式的书写与配平 物质分离、提纯综合应用 常见无机物的制备 物质含量的测定 | 工业流程题 |
| 10 | 0.65 | 化学反应热的计算 化学平衡常数 化学平衡状态的判断方法 | 原理综合题 |
| 11 | 0.4 | 电子排布式 配合物的结构与性质 氢键对物质性质的影响 晶胞的有关计算 | 结构与性质 |
| 12 | 0.4 | 同分异构体的数目的确定 有机物的推断 根据题给物质选择合适合成路线 胺的性质与应用 | 有机推断题 |



