贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高三上学期期末考试化学试题
贵州
高三
期末
2020-02-21
388次
整体难度:
适中
考查范围:
认识化学科学、化学反应原理、有机化学基础、物质结构与性质、常见无机物及其应用
一、单选题 添加题型下试题
| A.氢氧燃料电池放电时化学能全部转化为电能 |
| B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 |
| C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023 |
| D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快 |
【知识点】 氧化还原反应有关计算 化学反应进行方向的判据 氢氧燃料电池解读 酶
 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )
| A.放电时,ClO4-向负极移动 |
| B.充电时释放CO2,放电时吸收CO2 |
| C.放电时,正极反应为:3CO2+4e-=2CO32-+C |
| D.充电时,正极反应为:Na++e-=Na |
| A.钠与水反应:Na +2H2O=Na++2OH–+H2↑ |
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O H2↑+Cl2↑+2OH– H2↑+Cl2↑+2OH– |
| C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O |
| D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O |
【知识点】 离子反应的发生及书写
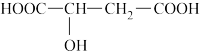 ,下列相关说法不正确的是( )
,下列相关说法不正确的是( )| A.苹果酸在一定条件下能发生酯化反应 |
| B.苹果酸在一定条件下能发生催化氧化反应 |
| C.苹果酸能与钠、镁等活泼金属发生置换反应生成H2 |
| D.1mol苹果醋与Na2CO3溶液反应一定消耗2molNa2CO3 |
| A.CH3COOH溶液与Zn反应放出H2 |
| B.0.1 mol/L CH3COONa溶液的pH大于7 |
| C.CH3COOH溶液与Na2CO3反应生成CO2 |
| D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红 |
A.Ag2O(s)===2Ag(s)+ O2(g) O2(g) |
B.Fe2O3(s)+ C(s)===2Fe(s)+ C(s)===2Fe(s)+ CO2(g) CO2(g) |
| C.N2O4(g)===2NO2(g) |
| D.6C(s)+6H2O(l)===C6H12O6(s) |
【知识点】 化学反应自发过程解读 化学反应进行方向的判据 复合判据解读
| A.原子半径:r(X) < r(Y) < r(Z) < r(W) |
| B.W的最高价氧化物的水化物是一种弱碱 |
| C.Y的单质的氧化性比Z的强 |
| D.X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
【知识点】 “位构性”关系理解及应用解读
二、解答题 添加题型下试题
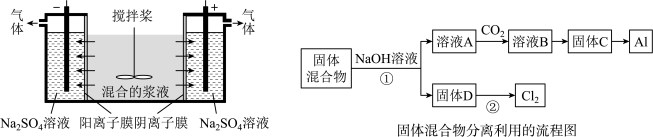
图2
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是
【知识点】 热化学方程式 影响化学反应速率的外因 电解原理的应用

(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(2)设
 =x,若理论上欲获得最多的氯化氢,则x值应
=x,若理论上欲获得最多的氯化氢,则x值应(3)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应化学方程式为2CHCl3+O2
 2COCl2+2HCl,上述反应
2COCl2+2HCl,上述反应A.属于取代反应 B.不属于取代反应
为防止事故发生,在使用前检验氯仿是否变质可选用的试剂是
A.氢氧化钠溶液 B.硝酸银溶液
C.稀盐酸 D.水
E.湿润的蓝色石蕊试纸 F.湿润的无色酚酞试纸
(4)D装置的石棉中均匀混有KI粉末,其作用是
(5)E装置的作用是
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为
①CH4②CH3Cl ③CH2Cl2④CHCl3⑤CCl4
【知识点】 甲烷取代反应实验探究解读 甲烷取代反应的相关计算解读

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是
【知识点】 氧化铝 其他含铝化合物 含氧化铝的混合物的提纯解读 电解原理的应用
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A通常显
(2)紫外光的光子所具有的能量约为399kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因
| 共价键 | C-C | C-N | C-S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
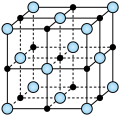
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是
(5)某配合物的分子结构如图所示,其分子内不含有

A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2。若有1molCH4生成,则有
【知识点】 物质结构与性质综合考查解读 基态核外电子排布规律 电离能 晶格能解读
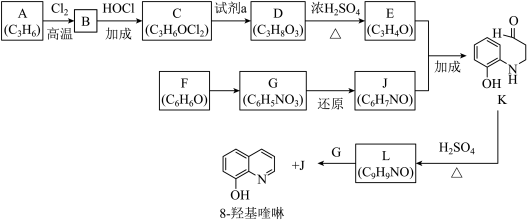
已知:i.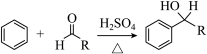
(1)按官能团分类,A的类别是
(2)A→B的化学方程式是
(3)C可能的结构简式是
(4)C→D所需的试剂a是
(5)D→E的化学方程式是
(6)F→G的反应类型是
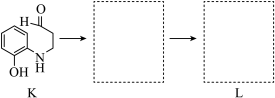
(7)将下列K→L的流程图补充完整:
试卷分析
试卷题型(共 12题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 氧化还原反应有关计算 化学反应进行方向的判据 氢氧燃料电池 酶 | |
| 2 | 0.65 | 原电池原理的综合应用 新型电池 其他二次电池 电解原理的应用 | |
| 3 | 0.65 | 离子反应的发生及书写 | |
| 4 | 0.65 | 有机官能团的性质及结构 羧酸的酸性 羧酸酯化反应 多官能团有机物的结构与性质 | |
| 5 | 0.65 | 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 盐类水解的应用 | |
| 6 | 0.65 | 化学反应自发过程 化学反应进行方向的判据 复合判据 | |
| 7 | 0.65 | “位构性”关系理解及应用 | |
| 二、解答题 | |||
| 8 | 0.4 | 热化学方程式 影响化学反应速率的外因 电解原理的应用 | 原理综合题 |
| 9 | 0.65 | 甲烷取代反应实验探究 甲烷取代反应的相关计算 | 实验探究题 |
| 10 | 0.4 | 氧化铝 其他含铝化合物 含氧化铝的混合物的提纯 电解原理的应用 | 工业流程题 |
| 11 | 0.65 | 物质结构与性质综合考查 基态核外电子排布规律 电离能 晶格能 | 结构与性质 |
| 12 | 0.65 | 根据要求书写同分异构体 羧酸酯化反应 逆合成分析法 有机推断综合考查 | 有机推断题 |



