江苏师范大学附属实验学校2019届高三上学期10月学情调研化学试题
江苏
高三
阶段练习
2018-12-20
523次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、物质结构与性质、常见无机物及其应用、有机化学基础、化学反应原理、化学实验基础
一、单选题 添加题型下试题
| A.加大清洁能源的开发利用,提高资源的利用率 |
| B.用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
| C.加大铅蓄电池、含汞锌锰干电池的生产,满足消费需求 |
| D.对工业废水、生活污水进行净化处理,减少污染物的排放 |
A.中子数为20的氯原子: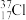 | B.次氯酸的电子式: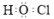 |
C.氮原子的结构示意图: | D.碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
| A.C2H4气体具有可燃性,可用作果实的催熟剂 | B.MgO熔点高,可用作耐高温材料 |
| C.氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多 | D.浓硫酸具有脱水性,可用于干燥NH3、SO2等 |
| A.原子半径:r(W) > r(Z) > r(Y) |
| B.由X、Y 组成的化合物中均不含共价键 |
| C.Y 的最高价氧化物的水化物的碱性比Z的弱 |
| D.X 的简单气态氢化物的热稳定性比W的强 |
【知识点】 元素周期律、元素周期表的推断
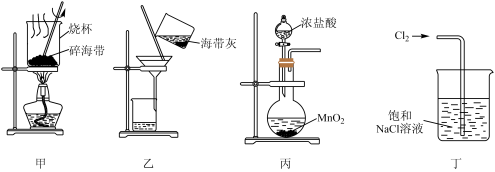
| A.用装置甲灼烧碎海带 |
| B.用装置乙过滤海带灰的浸泡液 |
| C.用装置丙制备用于氧化浸泡液中I−的Cl2 |
| D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气 |
【知识点】 氯气的实验室制法解读 海带中碘的提取及检验解读
| A.将少量SO2气体通入过量氨水中:SO2+NH3·H2O=NH4++HSO3- |
| B.铝溶于NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| C.用醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
【知识点】 离子反应的发生及书写 离子方程式的书写解读 离子方程式的正误判断解读
A.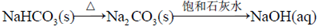 |
B.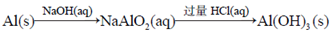 |
C.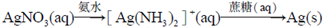 |
D.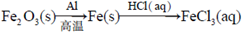 |
② C(s)+O2(g)=CO2(g) ΔH2=b kJ·mol-1
③ 2H2O(l)=2H2(g)+O2(g) ΔH3=c kJ·mol-1
④ 2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH4=d kJ·mol-1 下列说法正确的是
| A.使用催化剂,ΔH1减小 | B.b>0 |
C.H2(g)+ O2(g)=H2O(l) ΔH= O2(g)=H2O(l) ΔH=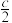 kJ·mol-1 kJ·mol-1 | D.d=2b-c-a |
【知识点】 盖斯定律与热化学方程式解读
| A.能使甲基橙变红的溶液:Na+、NH4+、NO3-、CO32- |
| B.加入苯酚显紫色的溶液:K+、NH4+、Cl-、SCN- |
C.常温下, =1×10-14的溶液:K+、Na+、AlO2-、CO32- =1×10-14的溶液:K+、Na+、AlO2-、CO32- |
| D.加入Al能放出大量H2的溶液:Na+、Fe2+、NO3-、SO42- |
【知识点】 离子共存 限定条件下的离子共存解读
| A.氢氧燃料电池放电时化学能全部转化为电能 |
| B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 |
| C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023 |
| D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快 |
【知识点】 氧化还原反应有关计算 化学反应进行方向的判据 氢氧燃料电池解读 酶
二、多选题 添加题型下试题
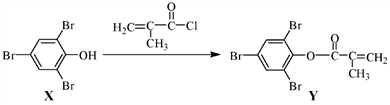
下列有关化合物X、Y 的说法正确的是
| A.X 分子中所有原子一定在同一平面上 |
| B.Y与Br2的加成产物分子中含有手性碳原子 |
| C.X、Y均不能使酸性KMnO4溶液褪色 |
| D.X→Y的反应为取代反应 |
三、单选题 添加题型下试题
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
| B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
| C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
| D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
| A.A | B.B | C.C | D.D |
【知识点】 溶度积常数与溶解度的关系解读 化学实验方案的设计与评价
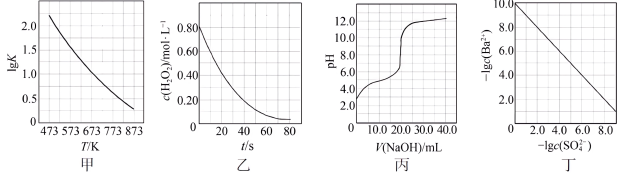
| A.图甲是CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0 |
| B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 |
| C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸 |
| D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小 |
【知识点】 化学平衡图像分析 酸碱中和滴定 难溶电解质的溶解平衡
四、多选题 添加题型下试题
A.反应CO2(g)+C(s) 2CO(g)的△H<0,△S>0 2CO(g)的△H<0,△S>0 |
| B.钢铁水闸可用牺牲阳极或者外加电流的阴极保护法减缓其腐蚀 |
| C.常温下,KSP[Al(OH)3]=1×10-33。欲使溶液中c(Al3+)≤1×10-6 mol·L-1,需调节溶液的pH≥5 |
| D.常温常压下,11.2 L Cl2与足量铁粉充分反应,转移电子数为6.02×1023 |
【知识点】 阿伏加德罗常数 化学反应原理综合考查解读 溶度积常数相关计算解读
五、单选题 添加题型下试题
| 实验 | 现象 | 结论 | |
| A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一支试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
六、填空题 添加题型下试题

(1) K2FeO4既能杀菌消毒,又能沉降水中悬浮物,其原因是:
(2)无隔膜法电解饱和NaCl溶液制备NaClO总反应的离子方程式为:
(3)“氧化”时发生反应的化学方程式为:
(4)“过滤”所得滤液中,除OH-外,一定存在的阴离子为
(5) 试从沉淀溶解平衡的角度解释“转化”得以顺利实现的原因
七、解答题 添加题型下试题

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
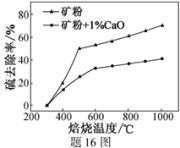
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—
 )×100%
)×100%①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由
(4)“过滤”得到的滤渣中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=
八、计算题 添加题型下试题
(1)黄铵铁矾高温下分解可得到一种红棕色固体,该红棕色固体的化学式为
(2)在酸性媒介中,黄铵铁矾对H2O2氧化去除水溶液中的MB(对亚甲基蓝)有催化作用。反应温度高于80℃时MB的去除率下降,其原因可能是
(3)为测定某黄铵铁矾样品的组成,进行下列实验:
① 取一定量黄铵铁矾样品,将其溶于少量稀盐酸中,再加水稀释至250.00 mL,得到溶液A。
② 取25.00 mL溶液A,加足量的NaOH溶液并充分加热,生成NH3 224mL(标准状况),将产生的沉淀过滤、洗涤,滤液合并后加入足量的BaCl2溶液,生成白色沉淀4.66 g。
③ 另取25.00 mL溶液A,用SnCl2将Fe3+还原为Fe2+,再用HgCl2除去过量的SnCl2,最后用0.2000 mol·L-1 K2Cr2O7标准溶液滴定至终点(Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O),消耗标准溶液25.00 mL。通过计算确定该样品的化学式(写出计算过程)。
【知识点】 酸碱中和滴定原理的应用解读 物质含量的测定 物质制备的探究解读
九、解答题 添加题型下试题
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
(3)用酸性(NH2)2CO水溶液吸收NOx,吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。

反应相同时间NOx的去除率随反应温度的变化曲线如图所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是
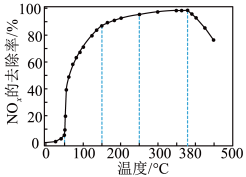 。
。

已知:① 浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水。
② 利用H2C2O4还原H[AuCl4]可得到Au。
(1)“溶解”前,先将粗金块切割成细条状,其目的是
(2)“滤渣”的主要成分为
(3)“操作Ⅰ”的名称为
(4)“操作Ⅱ”需控制在40~70℃时进行,适宜的加热方式为
(5)请设计从“操作Ⅱ”后的水溶液中获取单质Au的实验方案:
 和
和 ,NOx也可在其他条件下被还原为N2。
,NOx也可在其他条件下被还原为N2。(1)
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(2)Fe2+基态核外电子排布式为
(3)与O3分子互为等电子体的一种阴离子为
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=
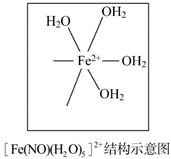
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
试卷分析
试卷题型(共 21题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 大气污染的治理原理及方法 水体污染来源及保护措施 “白色污染”危害及防治 绿色化学与可持续发展 | |
| 2 | 0.85 | 有关粒子结构的化学用语 原子结构示意图、离子结构示意图 电离方程式 原子的构成 | |
| 3 | 0.85 | 浓硫酸的吸水性 既能与酸反应又能与碱反应的无机物质 乙烯的用途 | |
| 4 | 0.85 | 元素周期律、元素周期表的推断 | |
| 5 | 0.65 | 氯气的实验室制法 海带中碘的提取及检验 | |
| 6 | 0.65 | 离子反应的发生及书写 离子方程式的书写 离子方程式的正误判断 | |
| 7 | 0.65 | 碳酸钠与碳酸氢钠性质的比较 铝热反应 偏铝酸钠与盐酸的反应 蔗糖与麦芽糖 | |
| 8 | 0.65 | 盖斯定律与热化学方程式 | |
| 9 | 0.65 | 离子共存 限定条件下的离子共存 | |
| 10 | 0.65 | 氧化还原反应有关计算 化学反应进行方向的判据 氢氧燃料电池 酶 | |
| 12 | 0.65 | 溶度积常数与溶解度的关系 化学实验方案的设计与评价 | |
| 13 | 0.65 | 化学平衡图像分析 酸碱中和滴定 难溶电解质的溶解平衡 | |
| 15 | 0.4 | 仪器使用与实验安全 物质的分离、提纯 物质的检验 | |
| 二、多选题 | |||
| 11 | 0.65 | 有机反应类型 分子的手性 有机分子中原子共面的判断 含有酚羟基的物质性质的推断 | |
| 14 | 0.65 | 阿伏加德罗常数 化学反应原理综合考查 溶度积常数相关计算 | |
| 三、填空题 | |||
| 16 | 0.65 | 氧化还原反应方程式的配平 高铁酸钠 沉淀转化 | |
| 四、解答题 | |||
| 17 | 0.4 | 二氧化硫的化学性质 偏铝酸钠与二氧化碳的反应 铁的氧化物 常见无机物的制备 | 工业流程题 |
| 19 | 0.65 | 化学反应原理综合考查 盖斯定律及其有关计算 化学反应条件的控制及其应用 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |
| 20 | 0.65 | 氧化还原反应方程式的配平 化学反应的速率 物质分离、提纯综合应用 综合实验设计与评价 | 实验探究题 |
| 21 | 0.65 | 物质结构与性质综合考查 等电子原理的应用 利用杂化轨道理论判断化学键杂化类型 离子配位数 | 结构与性质 |
| 五、计算题 | |||
| 18 | 0.4 | 酸碱中和滴定原理的应用 物质含量的测定 物质制备的探究 | |



