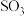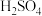云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题
云南
高三
阶段练习
2019-09-26
264次
整体难度:
适中
考查范围:
认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学与STSE、有机化学基础、化学实验基础
云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题
云南
高三
阶段练习
2019-09-26
264次
整体难度:
适中
考查范围:
认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学与STSE、有机化学基础、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
真题
名校
1. 下列叙述正确的是
| A.24 g 镁与27 g铝中,含有相同的质子数 |
| B.同等质量的氧气和臭氧中,电子数相同 |
| C.1 mol重水与1 mol水中,中子数比为2∶1 |
| D.1 mol乙烷和1 mol乙烯中,化学键数相同 |
您最近一年使用:0次
2018-06-09更新
|
12837次组卷
|
53卷引用:2018年全国普通高等学校招生统一考试化学(新课标III卷)
2018年全国普通高等学校招生统一考试化学(新课标III卷)【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高二下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题02 化学计量与化学计算四川省三台中学实验学校2017-2018学年高一下学期期末仿真模拟(二)化学试题(已下线)学科网2019年高考化学一轮复习讲练测1.1 物质的量 气体摩尔体积 练四川省射洪县射洪中学2018-2019学年高二上学期开学考试化学试题(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第1讲 物质的量、气体摩尔体积【教学案】辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量贵州省习水县一中2019届高三上学期12月份考试理科综合化学试题(已下线)2019高考热点题型和提分秘籍 第一章 物质的量 第1讲 物质的量 气体摩尔体积 (教学案)(已下线)2019高考备考二轮复习精品资料-专题2 化学常用计量(教学案)甘肃省武威市第十八中学2019届高三上学期期末考试化学试题(已下线)考点06 原子结构 化学键——备战2019年浙江新高考化学考点辽宁省阜新市第二高级中学2018-2019学年高二下学期期末考试化学试题贵州省独山县高级中学2020届高三上学期开学考试理综化学试题吉林省延边市第二中学2020届高三入学考试化学试题云南省马关县二中2020届高三上学期开学考试化学试题云南省陇川县一中2020届高三上学期开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题山西省应县第一中学校2020届高三9月月考化学试题福建省福州市2019—2020学年高三上学期9月调研考试化学试题(A)湖北省利川市第三中学2019届高三一模化学试题福建省莆田第七中学2020届高三上学期期中复习检测化学试题2安徽省萧城一中2020届高三第一次月考化学试题贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题(已下线)专题三 化学常用计量与阿伏加德罗常数(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)专题5.3 化学键(练)——2020年高考化学一轮复习讲练测云南省昆明市官渡区第一中学2019-2020学年高一下学期期中考试化学试题黑龙江省鸡西市鸡东县第二中学2019-2020 学年高二下学期期末考试化学试题(已下线)第03讲 物质的量 气体摩尔体积(精讲)——2021年高考化学一轮复习讲练测广西兴安县第三中学2020届高三上学期期中考试化学试题山西省晋中市平遥综合职业技术学校2021届高三上学期10月月考化学试题四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题(已下线)第01讲 物质的量 气体摩尔体积(精讲)-2022年一轮复习讲练测(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第01讲 物质的量 气体摩尔体积(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)陕西省洛南县洛南中学2022届高三上学期第一次模拟考试化学试题黑龙江省哈尔滨市第六中学2021-2022学年高三上学期第一次月考化学试题黑龙江省哈尔滨市第六中学2021-2022学年高三上学期10月月考化学试题湖南省邵阳市邵东创新实验学校2021-2022学年高三上学期第一次月考化学试题福建省仙游县郊尾中学2020届高三上学期期中考试化学试题重庆市永川北山中学校2021-2022学年高二下学期第一次月考化学试题(已下线)专题02化学计量与化学计算-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点02 物质的量 气体摩尔体积-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第01讲 物质的量 气体摩尔体积(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第04讲 物质的量 气体摩尔体积 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)内蒙古巴彦淖尔市临河区第三中学2021-2022学年高三上学期第二次阶段性测试理综化学试题第二章 物质的量化学实验基本技能 第6讲 物质的量(已下线)考点06 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆喀什市第五中学2023-2024学年高三上学期12月大联考化学预测卷
单选题
|
适中(0.65)
2. 室温下,下列各组离子在指定溶液中能大量共存的是( )
| A.0.1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH− |
| B.0.1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+ 、NO3−、SO42− |
| C.0.1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3− |
| D.0.1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3− |
【知识点】 离子共存 限定条件下的离子共存解读
您最近一年使用:0次
2018-06-10更新
|
8872次组卷
|
43卷引用:2018年全国普通高等学校招生统一考试化学(江苏卷)
2018年全国普通高等学校招生统一考试化学(江苏卷)【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高二下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题03 离子反应(已下线)高考母题题源02 离子反应2019届高考化学一轮复习离子反应(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题湖北省汉川市第二中学2017-2018学年高一下学期期末考试化学试题(已下线)2018年9月28日《每日一题》人教必修1-离子共存判断【全国百强校】江苏省徐州市第一中学2019届高三上学期第一次月考化学试题云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题西藏自治区林芝市第二高级中学2018-2019学年高一上学期期中考试化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (教学案)贵州省习水县一中2019届高三上学期12月份考试理科综合化学试题(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)(已下线)考点04 离子反应——备战2019年浙江新高考化学考点山东省昌乐第一中学2018-2019学年高二下学期第二次段考化学试题浙江省诸暨中学2018-2019学年高二(实验班)下学期期中考试化学试题(已下线)专题2.2 离子反应 离子共存及检验(讲)-《2020年高考一轮复习讲练测》云南省建水县第二中学2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题宁夏石嘴山市第三中学2020届高三上学期第一次适应性(开学)考试化学试题湖北省利川市第三中学2019届高三一模化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)甘肃省武威第十八中学2020届高三上学期第三次月考诊断化学试题2020届高三化学大二轮增分强化练——离子共存专题1.2 离子反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题北京市海淀区人民大学附属中学2020届高三化学3月考试题(已下线)专题五 离子反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训湖南省株洲市茶陵县第三中学2019-2020学年高一下学期第二次月考化学试题江苏省南通市启东市吕四中学2020届高三第一次质量检测化学试题湖北松滋市言程中学2020-2021学年高一上学期9月月考化学试题广东省中山市第一中学丰山学部2019-2020学年高一上学期第三次段化学试题吉林省白山市抚松县第一中学2022-2023学年高三上学期第一次模拟考试化学试题(已下线)专题06 离子共存、检验和推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)上海市实验学校2023届高三下学期3月月考化学试题江西省景德镇一中2022-2023学年高二下学期期中考试(18班)化学试题辽宁省大连市长海县高级中学2022-2023学年高三上学期期中考试化学试题河北省沧州市盐山中学2023-2024学年高一下学期开学化学试题广东省汕头市潮阳实验学校2022-2023学年高一下学期第一次月考化学试题
单选题
|
适中(0.65)
名校
3. 取ag某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了ag,下列物质不能满足上述结果的是( )
| A.H2 | B.CO | C.C6H12O6 | D.C12H22O11 |
您最近一年使用:0次
2019-09-25更新
|
645次组卷
|
24卷引用:2010年安丘中学高二暑期练习化学卷(六)
(已下线)2010年安丘中学高二暑期练习化学卷(六)(已下线)2010年河南省郑州外国语学校高三上学期9月月考化学试题(已下线)2011-2012学年安徽怀远县包集中学高一下学期期中考试化学试卷(已下线)2012届山东省济宁学院附属中学高三9月月考化学试卷(已下线)2015届吉林省公主岭市第一中学高三上学期第二次月考化学试卷2014-2015吉林省松原市扶余县一中高一上学期期中化学试卷组卷网合作校特供232015-2016学年河北省正定中学高一上第三次月考化学试卷22015-2016学年河南省安阳三十六中高二6月月考化学试卷2015-2016学年新疆乌鲁木齐七十中高二下期末化学试卷2017届甘肃省定西市通渭二中高三上学期第一次月考化学试卷2017届天津市静海一中高三上学期9月调研化学试卷河北省邢台市第一中学2017-2018学年高一上学期第三次月考化学试题广西钦州市经济技术开发区中学2017年秋季学期12月份考试高二年级化学试卷云南省建水县第二中学2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题辽宁省大连市2019-2020学年高一上学期期中考试化学试题山西省实验中学2020届高三化学复习针对性试题集(七)(已下线)上海市闵行区2012年高考二模化学试题(已下线)微专题10 “四角度”认识过氧化钠与水、二氧化碳的反应-备战2022年高考化学考点微专题(已下线)易错专题11 Na2O2反应的增重问题-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)河北省武安市第一中学2021-2022学年高三上学期第四次调研考试化学试题(已下线)微专题11 “四角度”认识过氧化钠与水、二氧化碳的反应-备战2023年高考化学一轮复习考点微专题山西大学附属中学校2023-2024学年高一上学期期中考试化学试卷
单选题
|
较易(0.85)
真题
名校
4. 化学与生活密切相关。下列说法错误的是
| A.泡沫灭火器可用于一般的灭火,也适用于电器灭火 |
| B.疫苗一般应冷藏存放,以避免蛋白质变性 |
| C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 |
| D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 |
您最近一年使用:0次
2018-06-09更新
|
15284次组卷
|
41卷引用:2018年全国普通高等学校招生统一考试化学(新课标III卷)
2018年全国普通高等学校招生统一考试化学(新课标III卷)江西省南昌三中2019届高二下期末考试 化学(已下线)2018年高考题及模拟题汇编 专题01 STSE 化学用语(已下线)学科网2019年高考化学一轮复习讲练测2.1 物质的组成、性质及分类 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第1讲 物质的组成、性质和分类 【教学案】辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题【全国百强校】吉林省实验中学2019届高三上学期第三次月考化学试题广东省惠州市第一中学2019届高三上学期理科综合测试(二)化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第1讲 物质的分类( 教学案)(已下线)2018年12月28日 《每日一题》高考二轮复习-化学与STSE(已下线)2019高考备考二轮复习精品资料-专题1 物质的组成、性质、分类与化学用语(教学案)【全国百强校】内蒙古自治区赤峰市第二中学2019届高三上学期第三次月考化学试题【全国百强校】江西省南昌市第十中学2019届高三上学期期末考试理科综合化学试题(已下线)2019年高考总复习巅峰冲刺-专题01 联系生产、科学、生活实际的社会热点问题应试策略(已下线)专题2.1 物质的组成、性质及分类(练)-《2020年高考一轮复习讲练测》云南省文山壮族苗族自治州马关县第一中学2020届高三上学期9月份考试化学试题云南省广南县第三中学2020届高三上学期开学考试化学试题云南省建水县第二中学2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题西藏山南市第二高级中学2020届高三上学期第二次月考理综化学试题湖北省利川市第三中学2019届高三一模化学试题湖北名师联盟(人教版)2019-2020学年高三上学期第二次月考精编仿真金卷化学试题2020届高三化学二轮复习把握分类标准 理清物质类别(强化训练)云南省昭通市绥江县二中2019-2020学年高三上学期期末考试理综化学试题河北省承德市第一中学2019-2020学年高二下学期3月疫情期间直播课堂检测化学试题(已下线)专题一 化学与STSE(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题广西北流市实验中学2019-2020学年高二下学期期中考试理科综合化学试题安徽省六安市舒城中学2019-2020学年高二下学期第三次月考化学试题(已下线)小题必刷01 物质的组成、分类和性质 ——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷12 钠及其化合物——2021年高考化学一轮复习小题必刷(通用版)安徽省亳州市第三十二中学2020-2021学年高二上学期第一次月考化学试题海南省万宁市北京师范大学万宁附属中学2021届高三上学期第三次月考化学试题甘肃省嘉峪关市第一中学2021届高三下学期六模考试理综化学试题(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-练习(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题01STSE化学用语-五年(2018~2022)高考真题汇编(全国卷)陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题陕西省西安高级中学2021-2022学年高三第一次适应性考试化学试题江苏省徐州市沛县树恩高级中学2021-2022学年高二下学期期中测试化学试题第一章 化学物质及其变化 第1讲 物质的组成、性质和分类
单选题
|
适中(0.65)
真题
名校
5. 主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
| A.常温常压下X的单质为气态 |
| B.Z的氢化物为离子化合物 |
| C.Y和Z形成的化合物的水溶液呈碱性 |
| D.W与Y具有相同的最高化合价 |
【知识点】 元素周期律、元素周期表的推断
您最近一年使用:0次
2018-06-09更新
|
16253次组卷
|
63卷引用:2018年全国普通高等学校招生统一考试化学(新课标I卷)
2018年全国普通高等学校招生统一考试化学(新课标I卷)安徽师范大学附属中学2017-2018学年高一下学期期末考试化学试题河北省安平中学2017-2018学年高一下学期期末考试化学试题2(已下线)2018年高考题及模拟题汇编 专题06 物质结构 元素周期律(已下线)高考母题题源04 元素周期表及周期律河南省天一大联考2017-2018学年高一下学期阶段性测试(四)化学试题【全国百强校】天津市第一中学2019届高三上学期第一次月考化学试题贵州省习水县一中2019届高三上学期12月份考试理科综合化学试题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)(已下线)考点07 元素周期律和元素周期表——备战2019年浙江新高考化学考点(已下线)2019年高考总复习巅峰冲刺-专题04 物质结构 元素周期律应试策略【全国百强校】安徽省黄山市屯溪第一中学2018-2019学年高一下学期期中考试化学试题【全国百强校】山西省平遥中学校2018-2019学年高二下学期期中考试化学试题黑龙江省大庆实验中学2018-2019学年高一下学期6月月考化学试题云南省广南县第三中学2020届高三上学期开学考试化学试题云南省文山州广南县第二中学2020届高三上学期9月份考试化学试题云南省西畴县第二中学2020届高三上学期开学考试化学试题云南省玉溪元江民中2020届高三开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题吉林省德惠市实验中学、前郭五中等九校2020届高三上学期期中考试化学试题河北省衡水市深州市长江中学2020届高三上学期12月月考化学试题甘肃省武威第一中学2020届高三12月月考化学试题云南省广南县二中2019-2020学年高三上学期期末考试化学试题贵州省荔波高级中学2019-2020学年高三上学期期末考试理综化学试题第1章原子结构与元素周期律 挑战区 模拟高考专题1微观结构与物质的多样性 模拟高考第一章物质结构元素周期律 模拟高考广西壮族自治区崇左市宁明中学2019-2020学年高一上学期期末考试化学试题第1章 原子结构——C挑战区 模拟高考(鲁科版选修3)(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训宁夏回族自治区银川一中2019-2020学年高二下学期期中考试化学试题内蒙古鄂尔多斯市2020届高考模拟试卷理科综合化学试题(已下线)专题5.2 元素周期律和元素周期表(讲)——2020年高考化学一轮复习讲练测(已下线)专题5.3 化学键(讲)——2020年高考化学一轮复习讲练测(已下线)专题5.2 元素周期律和元素周期表(练)——2020年高考化学一轮复习讲练测(已下线)专题5.3 化学键(练)——2020年高考化学一轮复习讲练测安徽省池州市第一中学2019-2020学年高一下学期期中教学质量检测化学试题云南省昆明市官渡区第一中学2020届高三上学期期中考试理综化学试题苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册 第四章素养检测(已下线)【全国百强校】黑龙江省大庆实验中学2018-2019学年高一6月月考试化学试题(已下线)第18讲 元素周期律和元素周期表(精讲)——2021年高考化学一轮复习讲练测(已下线)第17讲 原子结构 化学键(精讲)——2021年高考化学一轮复习讲练测(已下线)练习13 元素周期律-2020-2021学年【补习教材·寒假作业】高一化学(人教版)贵州省毕节市金沙县第一中学2020-2021学年高一下学期第一次月考化学试题江西省宜春市第九中学2020-2021学年高一下学期第一次月考化学试题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第13讲 原子结构 化学键(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第14讲 元素周期律和元素周期表(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)天津市蓟州区燕山中学2021-2022学年高三上学期第一次月考化学试题河南省南阳市第一中学2019届高三第二十次考试理综化学试题云南省玉溪市三中2021-2022学年高一下学期3月份入学考试 化学试题(已下线)专题06物质结构元素周期律-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省密山市第四中学2021-2022学年高三上学期第二次月考化学试题云南省富宁县第一中学2021-2022学年高一下学期开学考试化学试题(已下线)专题07 元素周期律与元素周期表(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第一部分 二轮专题突破 专题9 “位—构—性”综合推断黑龙江省牡丹江市第二高级中学2022-2023学年高二下学期4月月考化学试题
单选题
|
适中(0.65)
真题
名校
6. 下列说法正确的是
| A.氢氧燃料电池放电时化学能全部转化为电能 |
| B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 |
| C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023 |
| D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快 |
【知识点】 氧化还原反应有关计算 化学反应进行方向的判据 氢氧燃料电池解读 酶
您最近一年使用:0次
2018-06-10更新
|
7338次组卷
|
51卷引用:2018年全国普通高等学校招生统一考试化学(江苏卷)
2018年全国普通高等学校招生统一考试化学(江苏卷)西藏日喀则市南木林高级中学2017-2018学年高一下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题07 化学反应中的能量变化江苏师范大学附属实验学校2019届高三上学期10月学情调研化学试题(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)(已下线)2019年高考总复习巅峰冲刺-专题05 化学反应中的能量变化应试策略云南省腾冲市第八中学2018-2019学年高二下学期期中考试化学试题西藏林芝一中2018-2019学年高一下学期期末考试化学试题青海省大通回族土族自治县第一完全中学2018-2019学年高一下学期期中考试化学试题新疆自治区和田地区和田县喀什塔什乡中学2019届高三年级四月调研考试理综化学试题【区级联考】天津市和平区2019届高三下学期三模理科综合化学试题云南省文山壮族苗族自治州马关县第一中学2020届高三上学期9月份考试化学试题云南省开远市实验中学2020届高三上学期开学考试化学试题云南省宾川县三中2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题黑龙江省哈尔滨市第六中学2019-2020学年高二10月月考化学试题湖南省娄底市娄星区2019-2020学年高二上学期期中考试化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)江苏省苏州市五校2020届高三12月月考化学试题陕西省咸阳市三原县南郊中学2020届高三第五次月考化学试题夯基提能2020届高三化学选择题对题专练——溶解度、质量分数的相关计算贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高三上学期期末考试化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训河北省唐山遵化市2018-2019学年高二下学期期末考试化学试题山西省忻州市忻州实验中学2019-2020学年高二上学期期始考试化学试题江苏省南通市启东市吕四中学2020届高三第一次质量检测化学试题(已下线)小题必刷08 氧化还原反应的规律及应用——2021年高考化学一轮复习小题必刷(通用版)四川省内江市第六中学2021届高三上学期开学考试(第一次月考)化学试题江苏省扬州市江都区大桥高级中学2021届高三上学期期初调研化学试题湖南省衡阳市第二十六中学2021届高三上学期9月月考化学试题湖北省武汉市钢城四中2020-2021学年高二上学期期中考试化学试题山东省济南第一中学2020-2021学年高二上学期期中考试化学试题福建师范大学第二附属中学2019-2020学年高二上学期期中考试化学(选考)试题重庆市缙云教育联盟2020-2021学年高一下学期期末质量检测化学试题(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)安徽省舒城中学2021-2022学年高二上学期第二次月考化学试题重庆市朝阳中学2021-2022学年高二10月月考化学试题云南省开远市第一中学校2021-2022学年高三下学期开学考试理综化学试题云南省玉溪市民族中学2021-2022年高三下学期适应性考试(七)化学试题云南省景东彝族自治县第一中学2021-2022学年高三下学期3月份考试化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题云南省瑞丽市第一民族中学2021-2022学年高三下学期3月月考化学试题(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)广东省东莞市第四高级中学2022-2023学年高三8月月考化学试题山东省泰安一中新校2022-2023学年高二上学期10月质量检测化学试题江西省宜春市丰城市东煌学校2022-2023学年高二上学期期中考试化学试卷广东省潮州市潮安区2018-2019学年高一下学期期末考试化学试题浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷10-2023新东方高二上期中考化学
单选题
|
适中(0.65)
真题
名校
7. 室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
 C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是| A.加入NaOH,可增大乙醇的物质的量 |
| B.增大HBr浓度,有利于生成C2H5Br |
| C.若反应物增大至2 mol,则两种反应物平衡转化率之比不变 |
| D.若起始温度提高至60℃,可缩短反应达到平衡的时间 |
【知识点】 化学平衡的移动及其影响因素
您最近一年使用:0次
2018-06-09更新
|
5861次组卷
|
53卷引用:2018年全国普通高等学校招生统一考试化学(天津卷)
2018年全国普通高等学校招生统一考试化学(天津卷)【全国百强校】山西省临汾第一中学2017-2018学年高二下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题09 反应速率、化学平衡四川省宜宾县第一中学2019届高三上学期第一次月考理综化学试题河北省唐山市第一中学2018-2019学年高二上学期10月月考化学试题【全国百强校】四川省阆中中学2018-2019学年高二(仁智班)上学期期中考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期期中考试化学试题贵州省习水县一中2019届高三上学期12月份考试理科综合化学试题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题山东省日照青山学校2019届高三上学期第三次月考化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)安徽省阜阳市第三中学2018-2019学年高二下学期开学考试化学试题【全国百强校】四川省绵阳南山中学2018-2019学年高二下学期入学考试化学试题(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略河南省周口市扶沟县高级中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】浙江省学军中学2019届高三下学期4月选考模拟冲刺化学试题广东省佛山一中、石门中学、顺德一中、国华纪中四校2018-2019学年高二下学期期末联考化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》步步为赢 高二化学寒假作业:综合检测(一)云南省麻栗坡民族中学2019-2020学年高三上学期期末考试化学试题2020届高三化学二轮复习 化学反应速率 化学平衡(专题训练)江西省赣州市南康中学、平川中学、信丰中学2019—2020学年高二上学期12月月考试题化学贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题03-2020年北京新高考化学模拟试题天津市海河中学2020届高三第二学期化学测试(二)试卷(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)【南昌新东方】江西省九江第一中学2018-2019学年高二上学期第二次月考化学试题广东省梅州市2019-2020学年高二下学期期末考试化学试题(已下线)第02章 化学反应速率和化学平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)吉林省长春市实验中学2020-2021学年高二上学期开学考试化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)天津市蓟县擂鼓台中学2020-2021学年高二上学期第一次月考化学试题(已下线)第23讲 化学平衡状态 化学平衡的移动 (精讲)——2021年高考化学一轮复习讲练测鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考湖南省邵东县第一中学2020-2021学年高二上学期期中考试化学试题(已下线)专题06 化学反应速率和化学平衡——备战2021年高考化学纠错笔记浙江省舟山中学2020-2021学年高三上学期10月月考化学试题黑龙江省哈尔滨市哈师大附中2020-2021学年高二下学期期中考试化学试题(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题2.2.3 影响化学平衡的因素(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)2.2.2 影响化学平衡的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)课时36 化学平衡及平衡移动-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)安徽省舒城中学2021-2022学年高二上学期第二次月考化学试题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第19讲 化学平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)云南省昆明市第一中学2023-2024学年高二上学期12月月考化学试题辽宁省大连市第四十四中学2022-2023学年高三上学期10月考试化学试题
二、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
名校
8. 氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁流程如下:
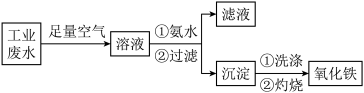
已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:___________ ,指出使用空气的优点是:_________ 。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s)ΔH=-Q1kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=_________ 。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=___________ ,c(Mg2+)=___________ 。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时Fe(OH)3沉淀中可能混有的杂质是______ (填化学式,下同),用_______ 试剂可将其除去。

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s)ΔH=-Q1kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时Fe(OH)3沉淀中可能混有的杂质是
您最近一年使用:0次
2019-04-27更新
|
265次组卷
|
5卷引用:福建省晋江市季延中学2018-2019学年高二下学期期中考试化学试题
三、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
9. 现以淀粉或乙烯为主要原料都可以合成乙酸乙酯,其合成路线如图所示。
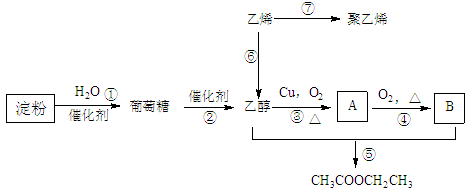
(已知:2CH3CHO+O2 2CH3COOH)
2CH3COOH)
(1)A中含有的官能团名称是______________ ;其中③的反应类型是______________ ;
⑥的反应类型是______________ ;
(2)写乙烯的电子式:_________________ 乙烯的结构简式:____________ ;
(3)写出下列反应的化学方程式:①__________________ ;⑤______________________________ 。

(已知:2CH3CHO+O2
 2CH3COOH)
2CH3COOH)(1)A中含有的官能团名称是
⑥的反应类型是
(2)写乙烯的电子式:
(3)写出下列反应的化学方程式:①
您最近一年使用:0次
2014-08-05更新
|
765次组卷
|
7卷引用:2013-2014甘肃省嘉峪关市第二学期期末高一联合考试化学试卷
四、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
真题
名校
10. K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]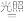 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是________________________________________ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________ 、___________ 。
③为防止倒吸,停止实验时应进行的操作是_____________________________ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________ 。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________ 。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________ 。
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]
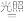 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为
【知识点】 物质含量的测定 探究物质组成或测量物质的含量解读 化学实验探究
您最近一年使用:0次
2018-06-09更新
|
13233次组卷
|
19卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题四川省攀枝花市第十二中学2019届高三上学期10月月考化学试题广东省惠州市第一中学2019届高三上学期理科综合测试(二)化学试题云南省马关县二中2020届高三上学期开学考试化学试题云南省玉溪元江民中2020届高三开学考试化学试题云南省富宁县民族中学2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题云南省富宁县第一中学2020届高三第一学期开学考试化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)重庆市开州中学高 2021-2022学年高三上学期10月月考化学试题(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)西藏自治区拉萨中学2022届高三第六次月考理综化学试题西藏林芝市第二高级中学2022-2023学年高三上学期第二次月考化学试题
解答题-有机推断题
|
适中(0.65)
11. 近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
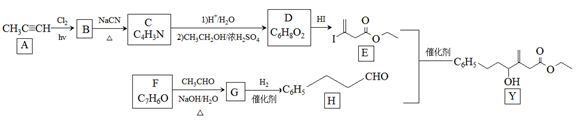
已知: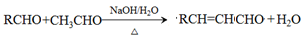
回答下列问题:
(1)A的化学名称是________________ 。
(2)B为单氯代烃,由B生成C的化学方程式为________________ 。
(3)由A生成B、G生成H的反应类型分别是________________ 、________________ 。
(4)D的结构简式为________________ 。
(5)Y中含氧官能团的名称为________________ 。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________ 。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________ 。

已知:

回答下列问题:
(1)A的化学名称是
(2)B为单氯代烃,由B生成C的化学方程式为
(3)由A生成B、G生成H的反应类型分别是
(4)D的结构简式为
(5)Y中含氧官能团的名称为
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式
您最近一年使用:0次
2018-06-09更新
|
13278次组卷
|
31卷引用:2018年全国普通高等学校招生统一考试化学(新课标III卷)
2018年全国普通高等学校招生统一考试化学(新课标III卷)【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高二下学期期末考试化学试题【全国百强校】吉林省长春外国语学校2017-2018学高二下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题17 有机化学合成与推断(选修)【全国百强校】西藏自治区拉萨中学2019届高三上学期第二次月考理科综合化学试题【全国百强校】西藏自治区拉萨北京实验中学2019届高三上学期第二次月考化学试题宁夏回族自治区银川市长庆高级中学2019届高三上学期第四次月考理科综合化学试题贵州省织金县一中2019届高三上学期12月份考试化学试题【全国百强校】河北省武邑中学2019届高三上学期12月月考化学试题云南省临沧市永德县2018-2019学年高二第一学期期末复习统一检测化学试题宁夏回族自治区宁夏大学附属中学2019届高三上学期第六次月考理科综合化学试题(已下线)《2019年高考总复习巅峰冲刺》专题13 有机化学基础应试策略云南省马关县二中2020届高三上学期开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题云南省漾濞二中2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题云南省富宁县第一中学2020届高三第一学期开学考试化学试题山东省2020届高三新高考仿真模拟化学试题第三章 烃的含氧衍生物——C 挑战区 模拟高考(人教版选修5)新疆哈密市第十五中学2021届高三上学期第一次质量检测化学试题(已下线)解密13 有机化学基础(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练吉林省长春市北京师范大学长春附属学校2019-2020学年高二下学期期末考试化学试题四川省邻水实验学校2022届高三上学期入学考试理综化学试题云南省玉溪市民族中学2021-2022学年高三下学期开学测试理综化学部分云南省玉溪第三中学2021-2022学年高三上学期期末考试化学试题云南省宁蒗县第一中学2021-2022学年高三下学期3月考试化学试题(已下线)专题19有机化学基础(选修)-五年(2018~2022)高考真题汇编(全国卷)云南省玉溪市民族中学2021-2022学年高三1月份考试理综化学试题西藏自治区拉萨中学2022届高三第六次月考理综化学试题山东省菏泽市单县第二中学2021-2022学年高二下学期四月月考化学试题
解答题-结构与性质
|
适中(0.65)
解题方法
12. 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________ ,基态S原子电子占据最高能级的电子云轮廓图为________ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________ 。
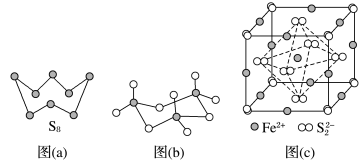
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________ 形,其中共价键的类型有________ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________ 。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏伽德罗常数的值为NA,其晶体密度的计算表达式为______________________________ g·cm-3;晶胞中Fe2+位于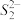 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为________ nm。
|
|
|
|
|
| |
熔点 | -85.5 | 115.2 |
(分解) | -75.5 | 16.8 | 10.3 |
沸点 | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏伽德罗常数的值为NA,其晶体密度的计算表达式为
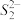 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
2018-09-23更新
|
263次组卷
|
7卷引用:云南省玉溪市元江一中2019届高三第一次月考化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学与STSE、有机化学基础、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 物质的量的含义 摩尔 原子的构成 共价键 | |
| 2 | 0.65 | 离子共存 限定条件下的离子共存 | |
| 3 | 0.65 | 过氧化钠与水的反应 过氧化钠和二氧化碳反应 过氧化钠的相关计算 | |
| 4 | 0.85 | 碳酸氢钠的俗称、物理性质及用途 金属的防护 化学科学对人类文明发展的意义 | |
| 5 | 0.65 | 元素周期律、元素周期表的推断 | |
| 6 | 0.65 | 氧化还原反应有关计算 化学反应进行方向的判据 氢氧燃料电池 酶 | |
| 7 | 0.65 | 化学平衡的移动及其影响因素 | |
| 二、解答题 | |||
| 8 | 0.65 | 沉淀的溶解与生成 溶度积规则及其应用 溶度积常数相关计算 物质制备的探究 | 工业流程题 |
| 10 | 0.65 | 物质含量的测定 探究物质组成或测量物质的含量 化学实验探究 | 实验探究题 |
| 11 | 0.65 | 常见官能团名称、组成及结构 根据要求书写同分异构体 有机合成综合考查 有机推断综合考查 | 有机推断题 |
| 12 | 0.65 | 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 三、填空题 | |||
| 9 | 0.65 | 糖类综合 有机物的推断 有机推断综合考查 | |