北京市海淀区人民大学附属中学2020届高三化学3月考试题
北京
高三
阶段练习
2020-04-04
827次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、物质结构与性质、化学反应原理、认识化学科学、化学实验基础
北京市海淀区人民大学附属中学2020届高三化学3月考试题
北京
高三
阶段练习
2020-04-04
827次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、物质结构与性质、化学反应原理、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 下列关于物质的组成、性质和用途的说法中,不正确 的是
| A | B | C | D |
聚乙烯盒 | 带玻璃塞的试剂瓶 | 铁罐车 | 铝制饭盒 |
| 可用于盛装食品 | 可用于盛放氢氧化钠溶液 | 可用于运输浓硫酸 | 不宜长时间存放酸性或碱性的食物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-03-26更新
|
530次组卷
|
6卷引用:北京市人民大学附属中学2018届高三3月模拟测试(一)理综化学试题
单选题
|
较易(0.85)
名校
3. 全氮类物质具有高密度、超高能量及爆炸产物无污染等优点,被称为没有核污染的“N2爆弹”。中国科学家胡炳成教授团队近日成功合成全氮阴离子N5﹣,N5﹣是制备全氮类物质N10(其中含有 N5+和N5﹣两种离子)的重要中间体。下列说法中不正确的是
| A.全氮类物质属于绿色能源 | B.每个N5+中含有35个质子 |
| C.每个N5﹣中含有35个电子 | D.N10结构中含非极性共价键和离子键 |
【知识点】 原子中相关数值及其之间的相互关系解读 化学键基本概念
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
4. 已知16S和34Se位于同一主族,下列说法正确的是
| A.热稳定性:H2Se>H2S>H2O | B.原子半径:Se>S>Cl |
| C.酸性:H2SeO4>H2SO4>HClO4 | D.还原性:S2->Se2->Br- |
【知识点】 同周期元素性质递变规律 同主族元素性质递变规律
您最近一年使用:0次
2016-12-09更新
|
280次组卷
|
3卷引用:2015届北京市海淀区高三第二学期期末练习理综化学试卷
单选题
|
适中(0.65)
名校
5. 下列解释事实的方程式不正确的是
A.电解饱和食盐水,产生黄绿色气体: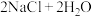  |
B.用 溶液将水垢中的 溶液将水垢中的 转化为 转化为 : : |
C.向H2O2溶液中滴加 溶液,产生气泡: 溶液,产生气泡:  |
D.向苯酚浊液中滴加 溶液,溶液变澄清: 溶液,溶液变澄清: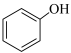 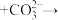   |
您最近一年使用:0次
2020-02-07更新
|
202次组卷
|
4卷引用:夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 沉淀溶解平衡及其影响因素 (提升练习)
6. 人造海绵的主要成分是聚氨酯,合成方法如下:

下列说法不正确 的是

下列说法
| A.M的分子式为C15H10N2O2 |
| B.合成聚氨酯的反应属于缩聚反应 |
| C.聚氨酯在一定条件下可发生水解反应 |
D.聚氨酯和蛋白质分子中均含有 结构 结构 |
【知识点】 氨基酸 缩聚反应 多官能团有机物的结构与性质解读
您最近一年使用:0次
2020-01-13更新
|
490次组卷
|
5卷引用:北京市朝阳区2020届高三上学期期末教学统一检测化学试题
单选题
|
适中(0.65)
7. 室温下,下列各组离子在指定溶液中能大量共存的是( )
| A.0.1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH− |
| B.0.1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+ 、NO3−、SO42− |
| C.0.1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3− |
| D.0.1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3− |
【知识点】 离子共存 限定条件下的离子共存解读
您最近一年使用:0次
2018-06-10更新
|
8871次组卷
|
43卷引用:2018年全国普通高等学校招生统一考试化学(江苏卷)
2018年全国普通高等学校招生统一考试化学(江苏卷)【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高二下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题03 离子反应(已下线)高考母题题源02 离子反应2019届高考化学一轮复习离子反应(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题湖北省汉川市第二中学2017-2018学年高一下学期期末考试化学试题(已下线)2018年9月28日《每日一题》人教必修1-离子共存判断【全国百强校】江苏省徐州市第一中学2019届高三上学期第一次月考化学试题云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题西藏自治区林芝市第二高级中学2018-2019学年高一上学期期中考试化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (教学案)贵州省习水县一中2019届高三上学期12月份考试理科综合化学试题(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)(已下线)考点04 离子反应——备战2019年浙江新高考化学考点山东省昌乐第一中学2018-2019学年高二下学期第二次段考化学试题浙江省诸暨中学2018-2019学年高二(实验班)下学期期中考试化学试题(已下线)专题2.2 离子反应 离子共存及检验(讲)-《2020年高考一轮复习讲练测》云南省建水县第二中学2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题宁夏石嘴山市第三中学2020届高三上学期第一次适应性(开学)考试化学试题湖北省利川市第三中学2019届高三一模化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)甘肃省武威第十八中学2020届高三上学期第三次月考诊断化学试题2020届高三化学大二轮增分强化练——离子共存专题1.2 离子反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题北京市海淀区人民大学附属中学2020届高三化学3月考试题(已下线)专题五 离子反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训湖南省株洲市茶陵县第三中学2019-2020学年高一下学期第二次月考化学试题江苏省南通市启东市吕四中学2020届高三第一次质量检测化学试题湖北松滋市言程中学2020-2021学年高一上学期9月月考化学试题广东省中山市第一中学丰山学部2019-2020学年高一上学期第三次段化学试题吉林省白山市抚松县第一中学2022-2023学年高三上学期第一次模拟考试化学试题(已下线)专题06 离子共存、检验和推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)上海市实验学校2023届高三下学期3月月考化学试题江西省景德镇一中2022-2023学年高二下学期期中考试(18班)化学试题辽宁省大连市长海县高级中学2022-2023学年高三上学期期中考试化学试题河北省沧州市盐山中学2023-2024学年高一下学期开学化学试题广东省汕头市潮阳实验学校2022-2023学年高一下学期第一次月考化学试题
单选题
|
适中(0.65)
名校
8. 30℃时,利用下图装置进行实验,结果记录如下表所示:
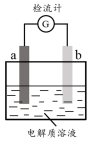
下列说法不正确 的是

| 实验 | a电极 | b电极 | 电解质溶液 | 现象 |
| I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅱ | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅲ | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
| IV | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
| A.Ⅱ中Al为负极,其电极反应是:Al - 3e- = Al3+ |
| B.Ⅲ中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行 |
| C.IV中Fe为负极,发生了氧化反应 |
| D.上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定 |
您最近一年使用:0次
2017-05-02更新
|
240次组卷
|
2卷引用:安徽省安庆市第一中学2016-2017学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 向0.1mol/L的Al2(SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是


| A.a点pH<7的原因:Al3++3H2O⇌Al(OH)3+3H+ |
| B.bc段发生的主要反应:Al3++3OH⁻=Al(OH)3 |
| C.ef段发生的主要反应:Al(OH)3+OH⁻=AlO2⁻+2H2O |
| D.d点,溶液中大量存在的离子是Na+、AlO2⁻和SO42⁻ |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
10. 利用下图装置可以进行实验并能达到实验目的的是
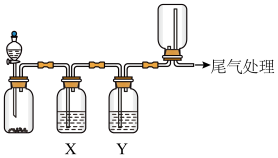

| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4溶液 |
| D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A.A | B.B | C.C | D.D |
【知识点】 氯气的实验室制法解读 乙炔的制备 常见气体的制备与收集解读
您最近一年使用:0次
2016-12-09更新
|
1238次组卷
|
9卷引用:2016届北京市东城区高三一模理综化学试卷
单选题
|
适中(0.65)
名校
解题方法
11. 在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
下列说法正确的是
 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A.其他条件不变,升高温度,此反应的平衡常数增大 |
| B.反应前2min的平均速率ν(Z)=4.0×10-3mol·L-1·min-1 |
| C.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正) |
| D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
12. 亚砷酸(H3AsO3)在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液pH关系如下图所示。下列说法中,不正确 的是


A.K3AsO3溶液中的水解方程式:AsO33-+H2O HAsO32-+OH- HAsO32-+OH- |
| B.pH=12.8时,c(HAsO32-)>c(H2AsO3-)=c(AsO33-) |
| C.pH = 12时,溶液中c(H2AsO3-) + 2c(HAsO32-) + 3c(AsO33-) + c(OH-) = c(H+) |
| D.pH=9.2时,在H2AsO3-和H3AsO3的混合溶液中:c(H2AsO3-):c(H3AsO3)=1:1 |
您最近一年使用:0次
2018-03-26更新
|
648次组卷
|
3卷引用:北京市人民大学附属中学2018届高三3月模拟测试(一)理综化学试题
单选题
|
适中(0.65)
名校
13. 工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。不合理 的是

| A.活性炭对Cu2+具有一定的吸附作用 |
| B.铁屑和活性炭会在溶液中形成微电池,铁为负极 |
| C.增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率 |
| D.利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu |
您最近一年使用:0次
2018-12-15更新
|
1526次组卷
|
19卷引用:【全国百强校】北京市师范大学附属中学2019届高三上学期期中考试化学试题1
【全国百强校】北京市师范大学附属中学2019届高三上学期期中考试化学试题1【全国百强校】北京市师范大学附属中学2019届高三上学期期中考试化学试题2【全国百强校】重庆南开中学2019届高三下学期适应性考试理科综合化学试题河北省邯郸市2019-2020学年高三上学期期中考试化学试题北京市东城区十一学校2020届高三联考零模化学试题湖南省部分重点中学2020届高三上学期期末考试理综化学试题北京市海淀区人民大学附属中学2020届高三化学3月考试题陕西省西安中学2020届高三第一次模拟考试化学试题(已下线)考点15 金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编山西省运城市高中联合体2020届高三模拟测试(一)理综化学试题(已下线)第六单元 化学反应速率和化学平衡测试题-2021年高考化学一轮复习名师精讲练【学科网名师堂】(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练广东省普宁市普师高级中学2021-2022学年高三上学期第二次阶段考化学试题北京理工大学附属中学2021-2022学年高二上学期期中练习化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题湖南省雅礼中学2024届高三下学期综合自主压轴测试 (一)化学题
单选题
|
较易(0.85)
名校
14. 某小组为探究 AgNO3溶液和不同类型盐溶液反应的多样性,设计如图实验:
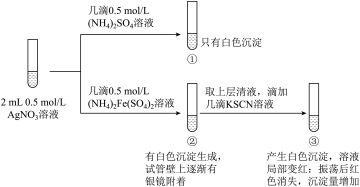
已知:AgSCN为白色难溶物。
下列说法中,不正确的是

已知:AgSCN为白色难溶物。
下列说法中,不正确的是
A.向①的试管中滴加 0.5 mol/L KI溶液,有黄色沉淀生成证明存在Ag2SO4(s)+2I− 2AgI(s)+SO42− 2AgI(s)+SO42− |
| B.①中的白色沉淀是Ag2SO4 |
| C.②中发生了氧化还原反应 |
| D.对于③中红色褪去的原因可能与平衡移动原理有关 |
您最近一年使用:0次
2020-04-01更新
|
178次组卷
|
4卷引用:2020届高三化学无机化学二轮专题复习——高考常考题型:无机化学推断题型【精编精炼】
2020届高三化学无机化学二轮专题复习——高考常考题型:无机化学推断题型【精编精炼】2020届高三化学无机化学二轮专题复习——铁的其他化合物【精编20题】北京市海淀区人民大学附属中学2020届高三化学3月考试题(已下线)小题必刷15 铁、铜及其化合物——2021年高考化学一轮复习小题必刷(通用版)
二、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
名校
解题方法
15. As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如下流程转化为粗As2O3。

(1) “碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应
的化学方程式是________ 。
(2) “氧化”时,1 mol AsO33-转化为AsO43-至少需要O2________ mol。
(3) “沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s) Ca2+(aq) + 2OH-(aq) ΔH <0
Ca2+(aq) + 2OH-(aq) ΔH <0
b.5Ca2+ + OH- + 3AsO43- Ca5(AsO4)3OH ΔH >0
Ca5(AsO4)3OH ΔH >0
研究表明:“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是________ 。

(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________ 。
(5) “还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如右图所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是________ 。
(6)下列说法中,正确的是________ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的

(1) “碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应
的化学方程式是
(2) “氧化”时,1 mol AsO33-转化为AsO43-至少需要O2
(3) “沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)
 Ca2+(aq) + 2OH-(aq) ΔH <0
Ca2+(aq) + 2OH-(aq) ΔH <0b.5Ca2+ + OH- + 3AsO43-
 Ca5(AsO4)3OH ΔH >0
Ca5(AsO4)3OH ΔH >0研究表明:“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是

(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是
(5) “还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如右图所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是
(6)下列说法中,正确的是
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
【知识点】 氧化还原反应方程式的配平解读 溶度积 物质分离、提纯综合应用解读
您最近一年使用:0次
2018-01-10更新
|
503次组卷
|
5卷引用:湖北省宜昌市第一中学2018届高三年级适应性训练(二)理综化学试题
解答题-原理综合题
|
适中(0.65)
名校
解题方法
16. 某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。

(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______ 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol•L-1时,钴的浸出率下降,其原因可能为______ 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式______ 。该步骤一般在80℃以下进行,温度不能太高的原因是______ 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______ (填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3•H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]

(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol•L-1时,钴的浸出率下降,其原因可能为
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3•H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
您最近一年使用:0次
2020-04-01更新
|
146次组卷
|
2卷引用:北京市海淀区人民大学附属中学2020届高三化学3月考试题
解答题-原理综合题
|
适中(0.65)
名校
解题方法
17. 苯乙烯(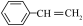 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
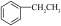 (g)
(g)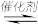
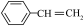 (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______ b(填“>” “<”或“=”),乙苯的转化率将________ (填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
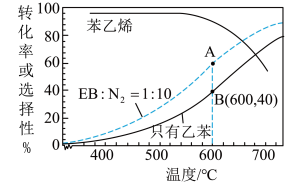
①A,B两点对应的正反应速率较大的是________ 。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________ 。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________ 。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________ 。
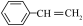 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: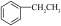 (g)
(g)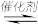
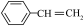 (g)+H2(g) △H
(g)+H2(g) △H(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①A,B两点对应的正反应速率较大的是
②掺入N2能提高乙苯的平衡转化率,解释说明该事实
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=
④控制反应温度为600℃的理由是
您最近一年使用:0次
2020-04-01更新
|
208次组卷
|
2卷引用:北京市海淀区人民大学附属中学2020届高三化学3月考试题
解答题-有机推断题
|
适中(0.65)
名校
18. H是药物合成中的一种重要中间体,下面是H的一种合成路线:
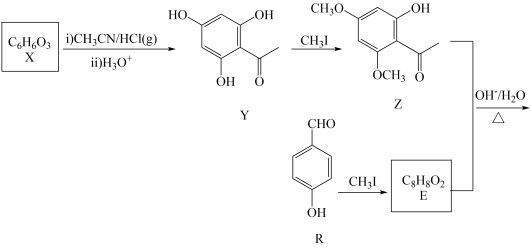

回答下列问题:
(1)X的结构简式为_______ ,其中所含官能团的名称为______ ;Y生成Z的反应类型为_______ 。
(2)R的化学名称是________ 。
(3)由Z和E合成F的化学方程式为__________________ 。
(4)同时满足苯环上有4个取代基,且既能发生银镜反应,又能发生水解反应的Y的同分异构体有________ 种,其中核磁共振氢谱上有4组峰,峰面积之比为1∶2∶2∶3的同分异构体的结构简式为________ (一种即可)。
(5)参照上述合成路线,以乙醛和 为原料(其他试剂任选),设计制备肉桂醛(
为原料(其他试剂任选),设计制备肉桂醛( )的合成路线
)的合成路线_______________ 。


回答下列问题:
(1)X的结构简式为
(2)R的化学名称是
(3)由Z和E合成F的化学方程式为
(4)同时满足苯环上有4个取代基,且既能发生银镜反应,又能发生水解反应的Y的同分异构体有
(5)参照上述合成路线,以乙醛和
 为原料(其他试剂任选),设计制备肉桂醛(
为原料(其他试剂任选),设计制备肉桂醛( )的合成路线
)的合成路线
您最近一年使用:0次
2019-03-25更新
|
334次组卷
|
5卷引用:2019年3月31日 《每日一题》二轮复习- 每周一测
解答题-实验探究题
|
较难(0.4)
名校
解题方法
19. 某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
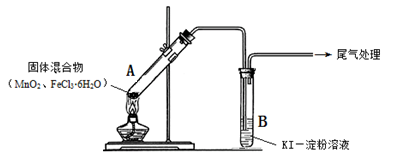
实验操作和现象:
(1)现象ⅰ中的白雾是__________ ,形成白雾的原因是_________________ 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有_______________ 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________ 。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是________________ 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
①方案1的C中盛放的试剂是______________ 。
②方案2中检验Fe2+的原因是_______________ 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是_______________ 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是_________ 。

实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
| 方案1 | B中溶液变为蓝色 |
| 方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
②方案2中检验Fe2+的原因是
③综合方案1、2的现象,说明选择NaBr溶液的依据是
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是
您最近一年使用:0次
2016-12-09更新
|
861次组卷
|
5卷引用:2017届内蒙古赤峰市宁城县高三上统一考试化学试卷
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、物质结构与性质、化学反应原理、认识化学科学、化学实验基础
试卷题型(共 19题)
题型
数量
单选题
14
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 硫酸 二氧化硅的用途 铝 聚乙烯结构及应用 | |
| 2 | 0.94 | 浓硫酸的吸水性 碳酸氢钠的不稳定性 苯酚的毒性 | |
| 3 | 0.85 | 原子中相关数值及其之间的相互关系 化学键基本概念 | |
| 4 | 0.65 | 同周期元素性质递变规律 同主族元素性质递变规律 | |
| 5 | 0.65 | 沉淀转化 氯碱工业 苯酚的弱酸性 | |
| 6 | 0.65 | 氨基酸 缩聚反应 多官能团有机物的结构与性质 | |
| 7 | 0.65 | 离子共存 限定条件下的离子共存 | |
| 8 | 0.65 | 通过实验探究原电池原理 原电池原理的综合应用 利用原电池原理比较金属活动性强弱 | |
| 9 | 0.65 | 铝盐与强碱溶液反应 盐类水解的原理 | |
| 10 | 0.65 | 氯气的实验室制法 乙炔的制备 常见气体的制备与收集 | |
| 11 | 0.65 | 化学反应速率计算 等效平衡 化学平衡常数的影响因素及应用 化学平衡题中基于图表数据的相关计算 | |
| 12 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 13 | 0.65 | 影响化学反应速率的其他因素 化学反应条件的控制及优化 原电池原理对化学反应速率的影响 | |
| 14 | 0.85 | 氧化还原反应定义、本质及特征 勒夏特列原理的应用 沉淀溶解平衡的应用 | |
| 二、解答题 | |||
| 15 | 0.65 | 氧化还原反应方程式的配平 溶度积 物质分离、提纯综合应用 | 工业流程题 |
| 16 | 0.65 | 氧化还原反应方程式的配平 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 电解原理 | 原理综合题 |
| 17 | 0.65 | 根据△H=反应物的键能之和-生成物的键能之和进行计算 化学平衡的移动及其影响因素 等效平衡 化学平衡常数的有关计算 | 原理综合题 |
| 18 | 0.65 | 有机反应类型 根据要求书写同分异构体 逆合成分析法 有机推断综合考查 | 有机推断题 |
| 19 | 0.4 | 氯气 铁盐的检验 化学实验探究 物质性质的探究 | 实验探究题 |







