2018年全国普通高等学校招生统一考试化学(新课标II卷)
全国
高三
高考真题
2018-06-10
43568次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、有机化学基础、物质结构与性质、认识化学科学、化学反应原理、化学实验基础
2018年全国普通高等学校招生统一考试化学(新课标II卷)
全国
高三
高考真题
2018-06-10
43568次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、有机化学基础、物质结构与性质、认识化学科学、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. 化学与生活密切相关。下列说法错误的是
| A.碳酸钠可用于去除餐具的油污 | B.漂白粉可用于生活用水的消毒 |
| C.氢氧化铝可用于中和过多胃酸 | D.碳酸钡可用于胃肠X射线造影检查 |
您最近一年使用:0次
2018-06-09更新
|
12904次组卷
|
55卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题01 STSE 化学用语(已下线)学科网2019年高考化学一轮复习讲练测2.1 物质的组成、性质及分类 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第1讲 物质的组成、性质和分类 【教学案】辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题【全国百强校】甘肃省天水市第一中学2019届高三上学期一轮复习第二次质量检测化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第1讲 物质的分类( 教学案)(已下线)2019高考备考二轮复习精品资料-专题1 物质的组成、性质、分类与化学用语(教学案)甘肃省武威市第十八中学2019届高三上学期期末考试化学试题(已下线)专题2.1 物质的组成、性质及分类(练)-《2020年高考一轮复习讲练测》安徽省亳州市第二中学2018-2019学年高二下学期期末考试化学试题吉林省延边市第二中学2020届高三入学考试化学试题云南省马关县二中2020届高三上学期开学考试化学试题云南省玉溪元江民中2020届高三开学考试化学试题陕西省咸阳市三原县南郊中学2020届高三摸底考试化学试题湖北省利川市第三中学2019届高三一模化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——化学与STSE青海省西宁市第十四中学2019-2020学年高二上学期期末考试化学试题云南省玉溪一中2019-2020学年高二上学期期末考试化学试题新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题重庆市南开中学高一下学期化学人教版第1章《非金属及其化合物》单元测试河北省承德市第一中学2019-2020学年高二下学期3月疫情期间直播课堂检测化学试题辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题(已下线)专题一 化学与STSE(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训西藏自治区拉萨市拉萨中学2019-2020学年高二第五次月考理科综合化学试题甘肃省西北师范大学附属中学2019-2020学年高二上学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期第三次月考化学试题模拟卷05——2020年秋高二化学开学摸底考试卷(全国通用)(已下线)小题必刷01 物质的组成、分类和性质 ——2021年高考化学一轮复习小题必刷(通用版)吉林省松原市油田第十一中学2021届高三第一次阶段考试化学试题河南省郑州市第一〇六高级中学2021届高三上学期9月月考化学试题天津市南开中学2021届高三上学期第二次月考化学试题安徽省临泉第一中学2020-2021学年高二上学期第三次月考化学试题山东济南章丘第四中学2021届高三上学期第一次阶段性检测化学试题四川省成都外国语学校2020-2021学年高二下学期开学考试化学试题(已下线)专题01 物质的组成、性质和分类——备战2021年高考化学纠错笔记安徽省淮北市树人高级中学2020-2021学年高二上学期期末考试化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题吉林省梅河口市第五中学2021-2022学年高二上学期开学考试化学试题(已下线)第1周 晚练题-备战2022年高考化学周测与晚练(新高考专用)山东省济南市平阴县第一中学2021-2022学年高三10月月考化学试题辽宁省抚顺市抚顺县高级中学2021-2022学年高三10月月考化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期期中考试化学试题(已下线)专题01STSE化学用语-五年(2018~2022)高考真题汇编(全国卷)广西北海市普通高中2022届高三第四次模拟考试化学试题陕西省黄陵中学2021-2022学年高三上学期期中考试化学试题新疆叶城县第八中学2021-2022学年高三上学期第二次月考化学试题天津市南开中学2022-2023学年高三上学期统练三化学试题内蒙古巴彦淖尔市临河区第三中学2021~2022学年高三上学期期中考试化学试题广东省 汕头市潮阳区河溪中学2022-2023学年高二下学期期中考试化学试题湖南省永州市第一中学2023-2024学年高二上学期9月月考化学试题海南省海口市琼山华侨中学2023-2024学年高三上学期第二次月考化学试题辽宁省沈阳市东北育才学校科学高中部2024届高三下学期最后一模化学试题
单选题
|
较易(0.85)
2. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是


| A.雾和霾的分散剂相同 |
| B.雾霾中含有硝酸铵和硫酸铵 |
| C.NH3是形成无机颗粒物的催化剂 |
| D.雾霾的形成与过度施用氮肥有关 |
您最近一年使用:0次
2018-06-09更新
|
17014次组卷
|
134卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)【全国百强校】四川省棠湖中学2017-2018学年高二下学期期末考试理综化学试题(已下线)2018年高考题及模拟题汇编 专题05 元素及其化合物(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题(已下线)2018年12月3日——《每日一题》高一人教必修1-二氧化硫和二氧化氮对大气的污染及其防治贵州省习水县一中2019届高三上学期12月份考试理科综合化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第4讲 氮及其化合物 (教学案)【全国百强校】山西省平遥中学2019届高三上学期11月质检化学试题(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(教学案)(已下线)2019高考备考二轮复习精品资料-专题5 金属及其化合物(教学案)【市级联考】河南省南阳市2019届高三上学期期末考试理科综合化学试题(已下线)2019年高考总复习巅峰冲刺-专题01 联系生产、科学、生活实际的社会热点问题应试策略(已下线)2019年高考总复习巅峰冲刺-专题08 常见无机物及其应用应试策略【全国百强校】广西壮族自治区桂林市第十八中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年5月28日 《每日一题》 必修2 环境问题与环境保护黑龙江省大庆实验中学2018-2019学年高一下学期6月月考化学试题(已下线)专题2.1 物质的组成、性质及分类(练)-《2020年高考一轮复习讲练测》云南省富宁县民族中学2020届高三上学期开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题甘肃省武威第十八中学2020届高三上学期第二次诊断考试化学试题湖北省利川市第三中学2019届高三一模化学试题吉林省白城市第十四中学2020届高三上学期期中考试化学试题浙江省东阳中学2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题山东省潍坊市2020届高三9月月考化学试题黑龙江省哈尔滨市第六中学2020届高三上学期第三次调研考试化学试题福建省厦门市湖滨中学2020届高三上学期期中考试化学试题江西省宜春市上高二中2020届高三上学期第四次月考理综化学试题云南省西畴县第二中学2019-2020学年高三上学期期末考试化学试题山东省潍坊市2019—2020学年高三上学期10月质量检测化学试题贵州省荔波高级中学2019-2020学年高三上学期期末考试理综化学试题人教版(2019)必修第二册第五章 模拟高考四川省成都市实验中学2020届高三上学期第十九周考理科综合化学试题内蒙古包头市包钢第四中学2018-2019学年高二下学期期末考试化学试题专题4 化学科学与人类文明——C挑战区 模拟高考(苏教版必修2)(已下线)专题二 物质的分类、组成和变化 化学用语(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训福建省泉州第十六中学2019-2020学年高一下学期5月月考化学试题内蒙古包头稀土高新区第二中学2019-2020高一下学期月考化学试题(已下线)专题4.4 氮及其化合物(讲)——2020年高考化学一轮复习讲练测(已下线)专题4.4 氮及其化合物(练)——2020年高考化学一轮复习讲练测安徽省安庆市怀宁县怀宁中学2019-2020学年高一下学期期中考试化学试题黑龙江省佳木斯市第一中学2019-2020学年高一下学期第一学段考试化学试题北京市朝阳区2020届高三5月适应性模拟化学试卷山东省潍坊昌乐县第二中学2020届高三上学期期末化学模拟试题三(已下线)第16讲 氮及其化合物(精讲)——2021年高考化学一轮复习讲练测云南省玉溪市新平一中2020-2021学年高二上学期开学考试化学试题鲁科版(2019)高一必修第一册第3章 物质的性质与转化 总结检测鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关四川省成都石室中学2021届高三上学期开学考试化学试题(已下线)小题必刷16 金属元素为载体的化工流程选择题——2021年高考化学一轮复习小题必刷(通用版)高一必修第一册(鲁科2019)第3章 第3节 氮的循环高一必修第二册(人教2019版)第五章 素养检测必修第二册RJ第5章挑战区 模拟高考(已下线)【全国百强校】黑龙江省大庆实验中学2018-2019学年高一6月月考试化学试题安徽省安庆市宿松县程集中学2021届高三上学期9月月考化学试题(已下线)【浙江新东方】47甘肃省武威第六中学2021届高三上学期第四次过关考试化学试题西藏山南第二高级中学2021届高三上学期第三次月考理综化学试题(已下线)练习16 生活中的含氮化合物-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)(已下线)练习12 微项目 论证重污染天气“汽车限行”的合理性-2020-2021学年【补习教材·寒假作业】高一化学(鲁科版2019)河南省新蔡县2021届高三上学期期末调研考试化学试题山东省济南市章丘市第一中学2020-2021学年高一上学期12月月考化学试题专题7 第三单元综合拔高练-高中化学必修第二册苏教版2019湖南省广益实验中学2020-2021学年高二上学期期中考试化学试题(人教版2019)必修第二册 第八章 化学与可持续发展 第三节 环境保护与绿色化学人教版2019必修第二册 第五章 第二~三节综合拔高练(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练江西省新建一中2020-2021学年高一下学期开学考试化学试题江苏省苏州市吴江区青云实验中学2020-2021学年高一下学期3月月考化学试题青海湟川中学2020-2021学年高一下学期3月考化学试题湖北省宜昌英杰学校2020-2021学年高一下学期3月测试化学试题吉林省延边第二中学2020-2021学年高一下学期期中考试化学试题广东省汕头市金山中学2020-2021学年高一下学期期中考试化学试题云南省梁河县第一中学2020-2021学年高一下学期第一次月考化学试题(已下线)专题12 资源综合利用 环境保护【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)(已下线)专题13 环境保护与绿色化学【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)(苏教版2019)必修第二册专题7 氮与社会可持续发展 C 高考挑战区(已下线)8.3 环境保护与绿色化学(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)辽宁省抚顺市重点高中2020-2021学年高一下学期期末考试化学试题(已下线)专题1.1.2 物质的转化(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)微专题28 非金属氧化物的污染与防治-备战2022年高考化学考点微专题(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第12讲 氮及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)黑龙江省牡丹江市第十五中学2020-2021学年高二下学期期末考试化学试题重庆市第二十九中学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期期中考试化学试题广东省广州市玉岩中学2020-2021学年高一下学期期中考试化学试题江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题广西罗城仫佬族自治县高级中学2021-2022学年高二上学期开学检测化学试题辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题天津市部分区2021-2022学年高三上学期期中练习化学试题上海市虹口区复兴高级中学2021-2022学年高一上学期期中考试化学试题(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-测试(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)内蒙古自治区阿拉善盟第一中学2021-2022学年高二上学期第一次段考化学试题(已下线)课后-8.3 环境保护与绿色化学-人教2019必修第二册(已下线)卷01 化学与STSE-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)【期中复习】必刷题-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)上海市七宝中学2021-2022学年高一下学期线上检测4月月考化学试题广东省大联考2021-2022学年高一下学期期中检测化学试题海南省中部六市县2021-2022学年高三模拟考试化学试题(已下线)专题07化学反应中的能量变化及反应机理-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题14物质的反应和转化-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点11 氮及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第12讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)湖北省罗田县第一中学2021-2022学年高一下学期3月月考化学试题天津市咸水沽第一中学2023届高三上学期第一次模拟考试化学试题湖北省巴东第三高级中学2021-2022学年高一下学期第一次月考化学试题黑龙江省密山市第四中学2021-2022学年高三上学期第二次月考化学试题甘肃省兰州第一中学2022-2023学年高三上学期期中考试化学试题(已下线)专题08 元素及其化合物(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题01 物质的组成与分类 传统文化-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题8 常见无机物性质的转化第四章 非金属及其化合物 第23讲 硝酸 含氮化合物的转化关系(已下线)题型56 结合环保问题考查氮的氧化物的性质及应用北京市第一六一中学2022-2023学年高一下学期期中考试化学试题云南省红河哈尼族彝族自治州第一中学2022-2023学年高一下学期5月期中化学试题广东省梅州市梅雁中学2022-2023学年高一下学期3月月考化学试题河南师范大学附中2022-2023学年高一下期阶段测试(6月)化学试题(已下线)第5讲 氮及其化合物(已下线)第13讲氮及其化合物(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)湖南省衡阳市第八中学2022-2023学年高一上学期第一次月考化学试题山东省枣庄市薛城区2023-2024学年高一上学期期末考试化学试题(已下线)热点13 环境保护与绿色化学
单选题
|
较易(0.85)
真题
名校
3. 实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
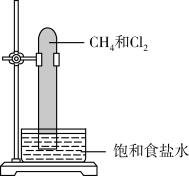
A.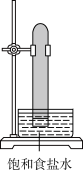 | B.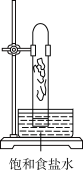 | C.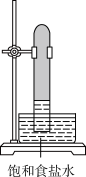 | D. |
您最近一年使用:0次
2018-06-09更新
|
18060次组卷
|
80卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础云南省保山一中2017-2018学年高一下学期期末考试化学试题【全国百强校】河北省石家庄市第一中学2018-2019学年高二上学期期中考试化学试题河北省临漳县第一中学2018-2019学年高二下学期第一次月考化学试题内蒙古自治区通辽实验中学2018-2019学年高二下学期第一次月考化学试题(已下线)2019年4月20日 《每日一题》 必修2 周末培优【全国百强校】安徽省合肥市第一六八中学2018-2019学年高一下学期期中考试化学试题(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略【全国百强校】山东省师范大学附属中学2018-2019学年高一下学期期中考试化学试题重庆市大学城第一中学2018-2019学年高二下学期期中考试化学试题新疆奎屯市第一高级中学2018-2019学年高一下学期第二次月考化学试题山西省太原市2018-2019学年高一下学期期末考试化学试题内蒙古赤峰市赤峰二中2019-2020学年高二上学期第一次月考化学试题内蒙古北京八中乌兰察布分校2018-2019学年高一下学期教学质量调研三化学试题陕西省渭南市临渭区尚德中学2019-2020学年高二上学期第一次月考化学试题内蒙古自治区集宁一中2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题(已下线)专题9.1 重要的烃 化石燃料(讲)-《2020年高考一轮复习讲练测》(已下线)专题9.1 重要的烃 化石燃料(练)-《2020年高考一轮复习讲练测》吉林省白城市通榆县第一中学2020届高三上学期第三次月考化学试题新疆阿克苏市实验中学2019-2020学年高二上学期第三次月考化学试题第七章 有机化合物 模拟高考——C挑战区 夯实基础(人教版(2019)第二册)第三章 有机化合物 模拟高考——C挑战区 夯实基础(人教版必修2)第二章 烃和卤代烃——C挑战 模拟高考(人教版选修5)专题3 有机化合物的获得与应用—— C挑战区 模拟高考(苏教版必修2)山东省德州市齐河县实验中学2019-2020学年高一下学期期中考试化学试题山东省滕州市第一中学2019-2020学年高一4月网课检测化学试题内蒙古自治区乌兰察布市集宁一中2019-2020学年高一下学期第二次月考化学试题福建省泉州第十六中学2019-2020学年高一下学期5月月考化学试题甘肃省西北师范大学附属中学2019-2020学年高二上学期期中考试化学试题甘肃省兰州市第一中学2019-2020学年高一下学期期中考试化学试题辽宁省锦州市第二高级中学2019-2020学年高一下学期月考化学试题广西钦州市2019-2020学年高一下学期期末教学质量监测化学(理)试题鲁科版(2019)高一必修第二册 第3章 简单有机化合物 第1节 认识有机化合物 高考帮必修第二册RJ第7章挑战区 模拟高考第29讲 重要的烃 同分异构体(精讲)-2021年高考化学一轮复习讲练测黑龙江省绥化市一中2020-2021学年度高二上学期第三次月考化学试题专题8 第一单元综合拔高练-高中化学必修第二册苏教版2019(人教版2019)必修第二册 第七章 有机化合物 第一节 认识有机化合物高二选择性必修3(人教版2019)第二章 烃 第二章素养检测(鲁科版2019)必修第二册 第3章 简单的有机化合物 学科素养提升内蒙古自治区通辽实验中学2020-2021学年高二(特优班)上学期期末考试化学试题河南省洛阳市豫西名校2020-2021学年高二下学期第一次联考化学试题山东省淄博市校级联考2020-2021学年高一下学期期中考试化学试题四川省资阳市雁江区中和中学2020-2021学年高一下学期期中考试化学试题新疆新源县2020-2021学年高一5月联考化学试题山西省长治二中2020-2021学年高一下学期第五次月考化学试题山西省吕梁市柳林县2020-2021学年高一下学期第二次月考化学试题吉林省延边第二中学2020-2021学年高一下学期第二次阶段考试化学试题(苏教版2019)必修第二册专题8 有机化合物的获得与应用 C 高考挑战区(鲁科版2019)选3第1章 C高考挑战区广西梧州市第一中学2020-2021学年高一下学期段考理科化学试题(已下线)考点27 甲烷、乙烯和苯的性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点26 甲烷、乙烯和苯的性质-备战2022年高考化学一轮复习考点帮(浙江专用)山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题(已下线)课时58 烃和卤代烃-2022年高考化学一轮复习小题多维练(全国通用)课中-7.1.2 烷烃的性质-人教2019必修第二册课中课中-7.1.2 烷烃的性质-人教2019必修第二册安徽省合肥市普通高中六校联盟2021-2022学年高二下学期期中联考化学试题山西省太原市第五中学2021-2022学年高一下学期5月阶段性检测化学试题河南省安阳市中原名校2021-2022学年高一下学期第三次联考化学试题(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)云南省玉溪市2021-2022学年高一下学期教学质量检测化学试题黑龙江省双鸭山市集贤县一中、四中等2021-2022学年高二下学期期末考试化学试题专题3 石油化工的基础物质——烃 第一~二单元综合拔高练第一~三节综合拔高练陕西省西安市西航一中2021~2022学年高二下学期期末考试化学试题山西省太原市第五实验中学2021-2022学年高一下学期5月阶段性检测化学试题黑龙江省双鸭山市饶河县高级中学2021-2022学年高二下学期期中考试化学试题河北省隆化存瑞中学2022-2023学年高二上学期期中考试化学试题山西省实验中学2021-2022学年高二上学期开学考试化学试题3.1.1脂肪烃的性质 课后广东省中山市第一中学2022-2023学年高一下学期6月月考化学试题河北新乐市第一中学2022-2023学年高二下学期3月月考化学试题第2课时 烷烃的性质1云南省保山市腾冲市第八中学2021-2022学年高二上学期期中考试化学试题上海市上海中学东校2023-2024学年高二下学期3月月考 化学试题(B卷)山西省大同市浑源七中2022-2023学年高一下学期第三次月考化学试题 广州市第七十五中学2023-2024学年高一下学期第一次阶段考试化学试题
单选题
|
适中(0.65)
4. W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是
| A.X与其他三种元素均可形成两种或两种以上的二元化合物 |
| B.Y与其他三种元素分别形成的化合物中只含有离子键 |
| C.四种元素的简单离子具有相同的电子层结构 |
| D.W的氧化物对应的水化物均为强酸 |
您最近一年使用:0次
2018-06-09更新
|
17509次组卷
|
62卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高二下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题06 物质结构 元素周期律四川省三台中学实验学校2017-2018学年高一下学期期末仿真模拟(二)化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期期中考试化学试题广东省惠州市第一中学2019届高三上学期理科综合测试(二)化学试题【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)甘肃省武威市第十八中学2019届高三上学期期末考试化学试题(已下线)考点07 元素周期律和元素周期表——备战2019年浙江新高考化学考点(已下线)2019年高考总复习巅峰冲刺-专题04 物质结构 元素周期律应试策略吉林省蛟河高级中学2018-2019学年高一下学期第一次月考化学试题2018-2019学年河南省洛阳市下学期第一次月考高一化学试题新疆奎屯市第一高级中学2018-2019学年高一下学期第二次月考化学试题黑龙江省大庆实验中学2018-2019学年高一下学期6月月考化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题甘肃省兰州市第五十五中学2020届高三上学期12月月考化学试题黑龙江省绥化市安达市第七中学2019-2020学年高二上学期月考化学试题广东省汕头市潮阳区2019~2020学年高二上学期期末质量检测化学试题专题1微观结构与物质的多样性 模拟高考第一章物质结构元素周期律 模拟高考河北省张家口市宣化区第一中学2019-2020学年高一3月月考化学试题(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训四川省内江市市中区天立学校2019-2020学年高一下学期第二次月考化学试题(已下线)专题5.2 元素周期律和元素周期表(讲)——2020年高考化学一轮复习讲练测(已下线)专题5.3 化学键(讲)——2020年高考化学一轮复习讲练测(已下线)专题5.2 元素周期律和元素周期表(练)——2020年高考化学一轮复习讲练测(已下线)专题5.3 化学键(练)——2020年高考化学一轮复习讲练测黑龙江省哈尔滨市双城区兆麟中学2019-2020学年度高一下学期期中考试化学试题湖北省武汉市第三中学2019-2020学年高一下学期期中考试化学试题苏教版(2020)高一必修第一册专题5 总结检测四川省新津中学2019-2020学年高二上学期开学考试化学试题人教版(2019)高一必修第一册 第四章素养检测广西壮族自治区桂林市第十八中学2020-2021学年高二上学期开学考试化学试题新疆哈密市第十五中学2021届高三上学期第一次质量检测化学试题高一必修第一册(苏教2019版)专题5 高考挑战区(已下线)【全国百强校】黑龙江省大庆实验中学2018-2019学年高一6月月考试化学试题(已下线)第18讲 元素周期律和元素周期表(精讲)——2021年高考化学一轮复习讲练测(已下线)第17讲 原子结构 化学键(精讲)——2021年高考化学一轮复习讲练测湖北省武汉市外国语学校2019-2020学年高一下学期期中考试化学试题广东省深圳实验学校高中部2020-2021学年高一下学期第一学期阶段考试化学试题(已下线)2021年高考化学押题预测卷(新课标Ⅲ卷)(03)(含考试版、答题卡、参考答案、全解全析)河北省张家口市宣化第一中学2020-2021学年高一下学期期中考试化学试题四川省资阳市雁江区中和中学2020-2021学年高一下学期期中考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)四川省蓬安中学校2020届高三上学期入学考试化学试题(已下线)第13讲 原子结构 化学键(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第14讲 元素周期律和元素周期表(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)吉林省梅河口市第五中学2021-2022学年高二上学期开学考试化学试题(已下线)第五单元 物质结构与元素周期律(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)专题06物质结构元素周期律-五年(2018~2022)高考真题汇编(全国卷)新疆喀什市普通高中2021-2022学年高三上学期期末考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)北京市顺义牛栏山第一中学2021-2022学年高一下学期居家学习成果展示化学测试题河南省南阳市第六完全学校高级中学2021-2022学年高一下学期3月半考试化学试题 北京市中国人民大学附属中学2022-2023学年高三上学期期中考试化学模拟试卷试题新疆柯坪县柯坪湖州国庆中学2021-2022学年高二下学期期末考试化学试题青海省北外西宁新华联国际学校2021-2022学年高一下学期第一次月考化学试题 (已下线)专题07 元素周期律与元素周期表(练)-2023年高考化学二轮复习讲练测(新高考专用)广东省深圳实验学校高中部2020-2021学年高一下学期阶段考试化学试题北京市中国人民大学附属中学2023-2024学年高三上学期期中考试前练习化学试题
单选题
|
适中(0.65)
真题
名校
5. NA代表阿伏伽德罗常数的值。下列说法正确的是
| A.常温常压下,124gP4中所含P—P键数目为4NA |
| B.100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA |
| C.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA |
| D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA |
您最近一年使用:0次
2018-06-09更新
|
21996次组卷
|
78卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高二下学期期末考试化学试题云南省腾冲市第八中学2017-2018学年高二下学期期末考试化学试题(已下线)2018年高考题及模拟题汇编 专题02 化学计量与化学计算(已下线)2019年高考化学一轮复习讲练测1.2 物质的量浓度 练(已下线)学科网2019年高考化学一轮复习讲练测1.1 物质的量 气体摩尔体积 练(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第1讲 物质的量、气体摩尔体积【教学案】辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题辽宁省阜新市海州高级中学2019届高三上学期第一次月考化学试题【全国百强校】吉林省实验中学2019届高三上学期第三次月考化学试题(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量(已下线)2019高考热点题型和提分秘籍 第一章 物质的量 第1讲 物质的量 气体摩尔体积 (教学案)山东省滨州市北镇中学2019届高三上学期12月份质量检测化学试题(已下线)2019高考备考二轮复习精品资料-专题2 化学常用计量(教学案)甘肃省武威市第十八中学2019届高三上学期期末考试化学试题(已下线)2019年高考总复习巅峰冲刺-专题02 阿佛加德罗常数应试策略【全国百强校】广西南宁市第三中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】江苏省启东中学2018-2019学年高二(创新班)下学期期中考试化学试题河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第二次月考化学试题辽宁省阜新市第二高级中学2018-2019学年高二下学期期末考试化学试题(已下线)专题1.1 物质的量 气体摩尔体积(练)-《2020年高考一轮复习讲练测》(已下线)专题1.1 物质的量 气体摩尔体积(讲)-《2020年高考一轮复习讲练测》云南省富宁县民族中学2020届高三上学期开学考试化学试题湖北省利川市第三中学2019届高三一模化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题黑龙江省哈尔滨市第六中学2020届高三上学期第三次调研考试化学试题2020届人教版高三化学二轮复习选择题专攻练——阿伏加德罗常数福建省莆田第二十五中学2020届高三上学期期末考试化学试题福建省莆田市仙游县枫亭中学2020届高三上学期期中考试化学试题(已下线)专题三 化学常用计量与阿伏加德罗常数(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训四川省成都经济技术开发区实验中学2021届高三上学期入学考试化学试题(已下线)易错02 阿伏加德罗常数判断-备战2021年高考化学一轮复习易错题(已下线)小题必刷09 物质的量、气体摩尔体积——2021年高考化学一轮复习小题必刷(通用版)湖北省宜昌市葛洲坝中学2021届高三9月月考化学试题甘肃省平凉市庄浪县第一中学2021届高三上学期第一次模拟化学试题甘肃省白银市靖远县第四中学2021届高三上学期10月月考化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题黑龙江省伊春市伊美区第二中学2021届高三上学期开学考试化学试题湖南省长沙市雅礼中学2021届高三第三次月考化学试题福建省莆田第二十五中学2021届高三上学期期中考试化学试题辽宁省大连市普兰店区第一中学2021届高三第一阶段考试化学试题江苏省南通市新高考2021届高三上学期期中考试化学(ⅱ卷)试题四川省成都经开区实验中学2021届高三上学期11月月考理综化学试题青海省西宁市海湖中学2021届高三上学期第二阶段考试化学试题西藏山南第二高级中学2021届高三上学期第三次月考理综化学试题福建省连城县第一中学2021届高三上学期第二次月考化学试题江西省南昌市南昌县莲塘第一中学2021届高三上学期12月质量检测化学试题(已下线)专题02 阿伏加德罗常数-2021年高考化学必做热点专题甘肃省武威市民勤县第四中学2021届高三上学期期末考试(实验班)化学试题北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题新疆新和县实验中学2020-2021学年高三上学期期中考试化学试题河北省安平中学2020-2021学年高二下学期6月第三次月考化学试题(已下线)微专题01 “破解七陷阱”突破NA-备战2022年高考化学考点微专题(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点02 物质的量 气体摩尔体积-备战2022年高考化学一轮复习考点帮(浙江专用)四川省蓬安中学校2020届高三上学期入学考试化学试题四川省阆中中学2021届高三上学期开学考试化学试题山东省聊城市高唐县第一中学2021-2022学年高三上学期开学考试化学试题(已下线)第一单元 化学计量在实验中的应用(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)江苏省盐城市伍佑中学2021-2022学年高三上学期第一次阶段考试化学试题新疆哈密市第十五中学2021-2022学年高三上学期第一次月考化学试题广东省湛江市第二十一中学2022届高三9月第二次月考化学试题(已下线)专题01 阿伏加德罗常数正误判断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)福建省厦门市湖滨中学2021-2022学年高三上学期期中考试化学试题内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题(已下线)专题02化学计量与化学计算-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点02 物质的量 气体摩尔体积-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第04讲 物质的量 气体摩尔体积 (练)-2023年高考化学一轮复习讲练测(新教材新高考)湖南省邵阳市新邵县2021-2022学年高二下学期期末质量检测化学试题江苏省盐城市伍佑中学2022-2023学年高三上学期期初考试化学试题河北省廊坊市第十五中学2021-2022学年高三下学期第一次模拟测试化学试题河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题天津市实验中学滨海学校黄南民族班2021-2022学年高三上学期期中质量监测化学试题福建省龙岩市永定区坎市中学2022-2023学年高三上学期期中化学试题(已下线)专题五 化学常用计量与化学计算-实战高考·二轮复习核心突破 天津市静海区第一中学2020-2021学年高三下学期一模化学试题(已下线)第二章 物质的量化学实验基本技能 第7练 包罗万象的阿伏加德罗常数(NA)
单选题
|
适中(0.65)
6. 我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )

 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )
| A.放电时,ClO4-向负极移动 |
| B.充电时释放CO2,放电时吸收CO2 |
| C.放电时,正极反应为:3CO2+4e-=2CO32-+C |
| D.充电时,正极反应为:Na++e-=Na |
您最近一年使用:0次
2018-06-09更新
|
21776次组卷
|
83卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题08 电化学及其应用广东省深圳市科学高中2018-2019学年第一学期高二入学考试化学试题四川省攀枝花市第十二中学2019届高三上学期10月月考化学试题【全国百强校】山东省泰安市第一中学2018-2019学年高二上学期期中考试化学试题【全国百强校】福建省仙游第一中学2018-2019学年高二上学期期中考试化学试题贵州省习水县一中2019届高三上学期12月份考试理科综合化学试题四川省隆昌县第七中学2019届高三上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)甘肃省武威市第十八中学2019届高三上学期期末考试化学试题(已下线)考点09 原电池原理及其应用——备战2019年浙江新高考化学考点甘肃省临夏中学2018-2019学年高二下学期期中考试化学试题四川省南充市阆中中学2018-2019学年高二6月月考理科综合化学试题云南省马关县二中2020届高三上学期开学考试化学试题云南省玉溪元江民中2020届高三开学考试化学试题云南省陇川县一中2020届高三上学期开学考试化学试题云南省石屏县第二中学2020届高三上学期开学考试化学试题江西省宜春市宜丰中学2020届高三上学期第一次月考化学试题山西省太原市六十六中2020届高三上学期第一次月考化学试题福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题(已下线)【新东方】高中化学167河北省唐山市第十一中学2019-2020学年高二上学期期中考试化学(理)试题吉林省吉林市蛟河市第一中学2019-2020学年高二上学期期中考试化学试题河北省石家庄市六校2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题重庆一中2019-2020学年高二上学期期中考试化学试题(已下线)考点09 原电池及化学电源——《备战2020年高考精选考点专项突破题集》步步为赢 高二化学寒假作业:综合检测(一)江苏省苏州市五校2020届高三12月月考化学试题浙江省三门县尚义高级中学2020届高三1月月考化学试题云南省麻栗坡民族中学2019-2020学年高三上学期期末考试化学试题福建省莆田第二十五中学2020届高三上学期期末考试化学试题贵州省荔波高级中学2019-2020学年高三上学期期末考试理综化学试题贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高三上学期期末考试化学试题云南省玉溪市新平县一中2019-2020学年高三上学期1月月考理综化学试题(已下线)专题十 化学能与电能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训专题2 化学反应与能量转化——C挑战区 模拟高考(苏教版必修2)宁夏石嘴山市第三中学2020届高三第三次模拟考试理综化学试题江西省上饶市横峰中学2019-2020学年高二下学期开学考试(统招班)化学试题西藏自治区拉萨市拉萨中学2019-2020学年高二第五次月考理科综合化学试题(已下线)专题6.2 原电池 化学电源(讲)——2020年高考化学一轮复习讲练测(已下线)专题6.2 原电池 化学电源(练)——2020年高考化学一轮复习讲练测甘肃省武威市第十八中学2020届高三上学期期末考试化学试题安徽省亳州市涡阳县第九中学2019-2020学年高一下学期期末考试化学试题黑龙江省大兴安岭漠河县第一中学2019-2020学年高二上学期第二次月考化学试题云南省昆明市官渡区第一中学2020届高三上学期期中考试理综化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第2节 化学能转化为电能——电池高中必刷题高二选择性必修1第四章 化学反应与电能 第四章素养检测福建省福州市第八中学2019-2020学年高二上学期期末考试化学(选考)试题人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第一节 原电池 高考帮江西省南昌市新建一中2021届高三上学期第一次月考化学试题(已下线)专题讲座(六)新型电源及电极反应式的书写(精讲)——2021年高考化学一轮复习讲练测(已下线)第20讲 原电池 化学电源(精讲)——2021年高考化学一轮复习讲练测广西岑溪市第一中学2020-2021学年高二9月月考化学试题安徽省淮北市孙疃中学2020-2021学年高二上学期第一次月考化学(实验班)试题人教版(2019)高二化学选择性必修1第四章 化学反应与电能 过高考 3年真题强化闯关河北省保定市唐县第一中学20202-2021学年高二上学期第二次月考化学试卷题山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题湖南省衡阳市第二十六中学2021届高三上学期9月月考化学试题河南省南阳市第一中学校2020-2021学年高二上学期第三次考试化学试题(已下线)小题必刷25 原电池及化学电源——2021年高考化学一轮复习小题必刷(通用版本)(已下线)高中化学苏教2019版必修第二册-专题6 第三单元综合拔高练黑龙江省哈尔滨市第六中学2020-2021学年高二上学期期末考试化学试题四川省遂宁市射洪中学2020—2021学年高二下学期第三次月考化学试题(已下线)课时32 可充电电池装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题四川省阆中中学2021届高三上学期开学考试化学试题福建省将乐县第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)卷08 电化学及其应用-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)专题08电化学及其应用-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)河南省南阳市第一完全学校2020-2021学年高二上学期第二次月考化学试题黑龙江省巴彦县第三高级中学2021-2022学年高二上学期11月月考化学试题陕西省黄陵中学2021-2022学年高一下学期期中考试化学试题河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题(已下线)题型16 金属-空气电池的应用辽宁省鞍山市一般高中协作校2022-2023学年高一下学期6月月考化学试题广东省惠州市2024届高三第一次调研考试化学试题广东省深圳市福田区福田中学2023-2024学年高三上学期12月月考化学考试上海市曹杨第二中学2023-2024学年高二上学期化学期末卷
单选题
|
适中(0.65)
真题
名校
7. 下列实验过程可以达到实验目的的是
| 编号 | 实验目的 | 实验过程 |
| A | 配制0.4000 mol·L−1的NaOH溶液 | 称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容 |
| B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
| C | 制取纯净氢气 | 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液 |
| D | 探究浓度对反应速率的影响 | 向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象 |
| A.A | B.B | C.C | D.D |
【知识点】 化学实验探究 化学实验方案的设计与评价
您最近一年使用:0次
2018-06-09更新
|
12565次组卷
|
35卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础四川省射洪县射洪中学2018-2019学年高二上学期开学考试化学试题山西省临猗县临晋中学2019届高三9月月考化学试题广东省惠州市第一中学2019届高三上学期理科综合测试(二)化学试题四川省宜宾市叙州区第一中学2019届高三上学期期末考试理科综合化学试题(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略黑龙江齐齐哈尔市第八中学2018-2019学年高二6月月考化学试题【全国百强校】吉林省实验中学2018-2019学年高二下学期期末考试化学试题(已下线)专题1.2 物质的量浓度(练)-《2020年高考一轮复习讲练测》辽宁省实验中学东戴河分校2019-2020学年高二10月月考化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题河北省沧州市泊头市第一中学2020届高三上学期第二次月考化学试题2020届高三化学化学二轮复习——高考常考题:氧化还原反应的实际应用【精编选择25题】四川省成都市实验中学2020届高三上学期第十九周考理科综合化学试题(已下线)【南昌新东方】江西省九江第一中学2018-2019学年高二上学期第二次月考化学试题陕西省榆林市绥德县绥德中学2020届高三下学期第五次模拟考试化学试题内蒙古自治区通辽市开鲁县第一中学2019-2020学年高一下学期期末考试化学试题山东省潍坊昌乐县第二中学2020届高三上学期期末化学模拟试题三河北正定中学2019-2020学年高一下学期摸底考试化学试题西藏山南市第二高级中学2021届高三上学期第一次月考化学试题陕西省宝鸡市宝鸡中学2020-2021学年高三上学期第一次月考化学试题(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)吉林省延边第二中学2020-2021学年高二下学期第二次考试月考化学试题(已下线)课时53 简单实验方案的设计与评价-2022年高考化学一轮复习小题多维练(全国通用)重庆第七中学2021-2022学年高三上学期半期考试化学试题河南省郑州市第一0六高级中学2021-2022学年高三上学期期中考试化学试题山东省烟台第二中学2021-2022学年高一3月月月考化学试题(已下线)专题12化学实验方案的设计与评价-五年(2018~2022)高考真题汇编(全国卷)辽宁省大连市金普新区省示范性高中联合体2021-2022学年高三上学期第二阶段考试化学试题河南省南阳市第一中学校2022-2023学年高三上学期第一次月考化学试题陕西省渭南市华州区咸林中学2020-2021学年高三下学期第1次教学质量检测化学试题
二、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
8. 我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
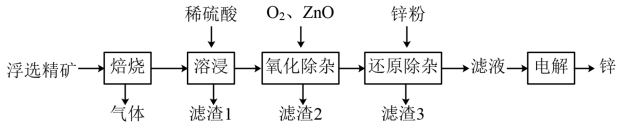
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________ 。
(2)滤渣1的主要成分除SiO2外还有___________ ;氧化除杂工序中ZnO的作用是____________ ,若不通入氧气,其后果是________________ 。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________ 。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________ ;沉积锌后的电解液可返回_______ 工序继续使用。

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为
(2)滤渣1的主要成分除SiO2外还有
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为
您最近一年使用:0次
2018-06-09更新
|
15607次组卷
|
24卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题15 工艺流程题(已下线)高考母题题源16 工艺流程【全国百强校】河北省石家庄市辛集中学2019届高三上学期12月月考化学试题(已下线)《2019年高考总复习巅峰冲刺》专题11 化学工艺流程题应试策略云南省昭通鲁甸县二中2019-2020学年高一10月月考化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题吉林省白城市通榆县第一中学2020届高三上学期第三次月考化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训新疆巴音郭楞蒙古自治州第一中学2021届高三上学期期中考试化学试题河南省项城市第三高级中学2021届高三上学期第四次段考化学试题(已下线)专题14 无机化工流程不丢分-2021年高考化学必做热点专题甘肃省民乐一中2021届高三5月第二次诊断考试理综化学试题(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题09 金属矿物的开发和利用 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练山东省聊城市高唐县第一中学2021-2022学年高三上学期开学考试化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期期中考试化学试题(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)内蒙古赤峰市第四中学分校2021-2022学年高三上学期9月月考化学试题(已下线)第一部分 二轮专题突破 大题突破3 无机化工流程题题型研究福建省宁德市霞浦县2022-2023学年高一上学期期末考试化学试题辽宁省大连市第八中学2021-2022学年高二上学期12月月考化学试题
解答题-原理综合题
|
较难(0.4)
9. CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____ (填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______ mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
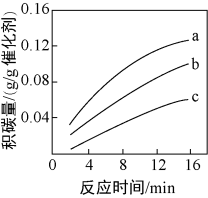
①由上表判断,催化剂X____ Y(填“优于”或“劣于”),理由是_________________ 。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________ 填标号)。

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________ 。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH=
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
| ΔH/(kJ·mol−1) | 75 | 172 | |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |

A.K积、K消均增加B.v积减小,v消增加
C.K积减小,K消增加D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为

您最近一年使用:0次
2018-06-09更新
|
14138次组卷
|
23卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合(已下线)高考母题题源14 基本概念、基本理论综合二【全国百强校】西藏自治区拉萨中学2019届高三上学期第二次月考理科综合化学试题【全国百强校】山西省平遥中学2018-2019学年高二上学期期中考试化学试题【校级联考】江西省上饶市“山江湖”协作体2018-2019学年高二上学期第三次月考化学试题(已下线)2019年高考总复习巅峰冲刺-专题06 化学反应速率、化学平衡问题应试策略【全国百强校】江西省南昌市第十中学2019届高三下学期期中考试(第二次模拟)理科综合化学试题辽宁省实验中学东戴河分校2019-2020学年高二10月月考化学试题四川省宜宾市叙州区第一中学2020届高三上学期开学考试理综化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题山东省2020届高三新高考仿真模拟化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考安徽省临泉第一中学2020-2021学年高二上学期第三次月考化学试题青海省湟川中学2020-2021学年高二上学期期中考试化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练甘肃省临夏县中学2020-2021学年高二上学期期末考试化学试题贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题湖南省长沙县第九中学2021-2022学年高二上学期第二次月考化学试题
解答题-实验探究题
|
适中(0.65)
真题
名校
10. K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是________________________________________ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________ 、___________ 。
③为防止倒吸,停止实验时应进行的操作是_____________________________ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________ 。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________ 。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________ 。
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]
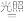 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为
【知识点】 物质含量的测定 探究物质组成或测量物质的含量解读 化学实验探究
您最近一年使用:0次
2018-06-09更新
|
13232次组卷
|
19卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题16 化学实验综合题四川省攀枝花市第十二中学2019届高三上学期10月月考化学试题广东省惠州市第一中学2019届高三上学期理科综合测试(二)化学试题云南省马关县二中2020届高三上学期开学考试化学试题云南省玉溪元江民中2020届高三开学考试化学试题云南省富宁县民族中学2020届高三上学期开学考试化学试题云南省大理白族自治州漾濞二中2019—2020学年9月份高三化学考试试题云南省富宁县第一中学2020届高三第一学期开学考试化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)重庆市开州中学高 2021-2022学年高三上学期10月月考化学试题(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)西藏自治区拉萨中学2022届高三第六次月考理综化学试题西藏林芝市第二高级中学2022-2023学年高三上学期第二次月考化学试题
解答题-结构与性质
|
较难(0.4)
11. 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________ ,基态S原子电子占据最高能级的电子云轮廓图为_________ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________ 。
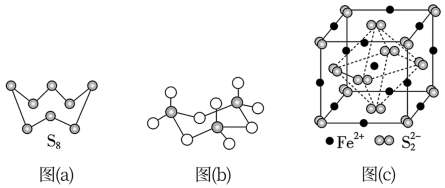
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________ 。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏伽德罗常数的值为NA,其晶体密度的计算表达式为___________ g·cm−3;晶胞中Fe2+位于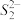 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为______ nm。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | −85.5 | 115.2 | >600(分解) | −75.5 | 16.8 | 10.3 |
| 沸点/℃ | −60.3 | 444.6 | −10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏伽德罗常数的值为NA,其晶体密度的计算表达式为
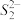 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
2018-06-09更新
|
13134次组卷
|
19卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题18 物质结构与性质(选修)(已下线)《2019年高考总复习巅峰冲刺》专题12 物质结构与性质应试策略吉林省吉林市第五十五中学2018-2019学年高二下学期期中考试化学试题云南省富宁县第一中学2020届高三第一学期开学考试化学试题河南省南阳市第一中学2020届高三上学期第一次月考化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题四川省成都市北大成都附属实验中学2019-2020学年度高三上学期1月月考理科综合化学试题贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题河北省2020届高三高考模拟理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题辽宁省锦州市渤海大学附属中学、育明高级中学2021届高三上学期第二次月考化学试题河南省长葛市第一高级中学2021届高三上学期10月阶段性测试化学试题四川邻水石永中学2021-2022学年高三上学期入学考试理科综合化学试题云南省玉溪市民族中学2021-2022学年高三下学期开学测试理综化学部分(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)湖南省长沙市宁乡市2020-2021学年高二下学期期末调研考试化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题
解答题-有机推断题
|
适中(0.65)
12. 以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下:
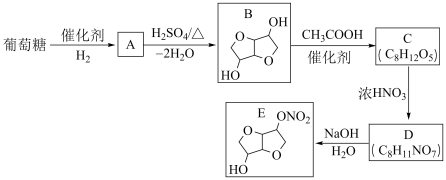
回答下列问题:
(1)葡萄糖的分子式为_____ 。
(2)A中含有的官能团的名称为_____ 。
(3)由B到C的反应类型为_____ 。
(4)C的结构简式为_____ 。
(5)由D到E的反应方程式为_____ 。
(6)F是B的同分异构体,7.30g的F与足量饱和碳酸氢钠反应可释放出2.24L二氧化碳(标准状况),F的可能结构共有_____ 种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构简式为_____ 。

回答下列问题:
(1)葡萄糖的分子式为
(2)A中含有的官能团的名称为
(3)由B到C的反应类型为
(4)C的结构简式为
(5)由D到E的反应方程式为
(6)F是B的同分异构体,7.30g的F与足量饱和碳酸氢钠反应可释放出2.24L二氧化碳(标准状况),F的可能结构共有
您最近一年使用:0次
2018-06-09更新
|
12346次组卷
|
26卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题17 有机化学合成与推断(选修)四川省攀枝花市第十二中学2019届高三上学期第一次月考化学试题甘肃省靖远县第一中学2019届高三上学期9月月考化学试题【全国百强校】四川省棠湖中学2019届高三上学期第三次月考理综-化学试题(已下线)《2019年高考总复习巅峰冲刺》专题13 有机化学基础应试策略河北省唐山市开滦第二中学2018-2019学年高二6月月考化学试题云南省陇川县一中2020届高三上学期开学考试化学试题云南省文山州广南一中2019-2020学年高二上学期期中考试化学试题广东省北大附中深圳南山分校2020届高三上学期期中考试化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题(已下线)考点17 基本营养物质——《备战2020年高考精选考点专项突破题集》黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题河北省张家口市宣化区宣化第一中学2019-2020学年高二下学期6月月考化学试题(已下线)专题讲座(十) 有机综合推断题突破策略(精练)-2021年高考化学一轮复习讲练测高二选择性必修3(人教版2019)第四章 生物大分子 第四章素养检测(已下线)解密13 有机化学基础(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密12 有机化学基础(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(人教2019)选择性必修3第四章 C高考挑战区内蒙古巴彦淖尔市乌拉特前旗第一中学2020-2021学年高二下学期期末考试化学试题吉林省吉林市第二中学2020-2021学年高二下学期期中考试化学试卷山东师范大学附属中学2021-2022学年高二下学期期中考试化学试题(已下线)专题19有机化学基础(选修)-五年(2018~2022)高考真题汇编(全国卷)专题6 生命活动的物质基础——糖类、油脂、蛋白质 第一~二单元综合拔高练期末学业水平检测(二)河北省石家庄市元氏县第四中学2021-2022学年高二下学期第一次月考化学试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学与STSE、有机化学基础、物质结构与性质、认识化学科学、化学反应原理、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 漂白粉和漂粉精 碳酸钠的俗称、物理性质及用途 明矾的净水作用及原理 化学科学对人类文明发展的意义 | |
| 2 | 0.85 | 硫的氧化物对人体、环境的危害 酸雨 大气污染的治理原理及方法 | |
| 3 | 0.85 | 甲烷取代反应实验探究 甲烷与氯气反应的四种产物结构、性质及用途 | |
| 4 | 0.65 | 元素周期律、元素周期表的推断 根据物质性质进行元素种类推断 | |
| 5 | 0.65 | 阿伏加德罗常数的应用 可逆反应及反应限度 盐类水解规律 甲烷的组成与结构 | |
| 6 | 0.65 | 原电池原理的综合应用 新型电池 其他二次电池 电解原理的应用 | |
| 7 | 0.65 | 化学实验探究 化学实验方案的设计与评价 | |
| 二、解答题 | |||
| 8 | 0.65 | 沉淀转化 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 9 | 0.4 | 盖斯定律及其有关计算 化学平衡的移动及其影响因素 化学平衡图像分析 化学平衡常数的有关计算 | 原理综合题 |
| 10 | 0.65 | 物质含量的测定 探究物质组成或测量物质的含量 化学实验探究 | 实验探究题 |
| 11 | 0.4 | 价层电子对数的确定 晶胞的有关计算 晶体的类型与物质熔点、硬度、导电性的关系 | 结构与性质 |
| 12 | 0.65 | 酯的水解反应机理 有机推断综合考查 | 有机推断题 |



