吉林省延边第二中学2020-2021学年高一下学期期中考试化学试题
吉林
高一
期中
2021-06-01
344次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、化学反应原理、化学实验基础、有机化学基础、物质结构与性质
一、单选题 添加题型下试题
A.四氯化碳分子空间充填模型 | B.水分子的结构式H-O-H |
C.CO2的电子式 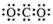 | D.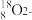 离子结构示意图 离子结构示意图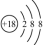 |
| A.晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料 |
| B.SiO2是酸性氧化物,所以可与NaOH反应:2NaOH+SiO2=Na2SiO3+H2O |
C.Na2SiO3可溶于水,在水中电离的方程式为:Na2SiO3=2Na++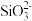 |
| D.氢氟酸能雕刻玻璃,利用了SiO2与HF的反应,由此判断SiO2是一种碱性氧化物 |

| A.雾和霾的分散剂相同 |
| B.雾霾中含有硝酸铵和硫酸铵 |
| C.NH3是形成无机颗粒物的催化剂 |
| D.雾霾的形成与过度施用氮肥有关 |
| A.10℃20mL,3mol/L的X溶液 |
| B.20℃30mL,2mol/L的X溶液 |
| C.10℃30mL,2mol/L的X溶液 |
| D.20℃10mL,3mol/L的X溶液 |
【知识点】 浓度对化学反应速率的影响解读 温度对化学反应速率的影响解读
| A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- |
| B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路由正极流向负极 |
| 气体(杂质) | 方法 | |
| A | SO2(H2S) | 通过酸性高锰酸钾溶液 |
| B | Cl2(HCl) | 通过饱和的食盐水 |
| C | N2(O2) | 通过灼热的铜丝网 |
| D | NO(NO2) | 通过氢氧化钠溶液 |
| A.A | B.B | C.C | D.D |
【知识点】 氯气 一氧化氮 二氧化硫 物质分离、提纯的常见化学方法解读
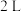 的密闭容器中分别进行合成氨反应:
的密闭容器中分别进行合成氨反应: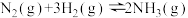 。根据在相同时间内测定的结果,判断反应进行快慢的顺序为
。根据在相同时间内测定的结果,判断反应进行快慢的顺序为a.
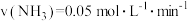 b.
b.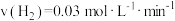
c.
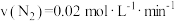 d.
d.
A. | B. | C. | D. |
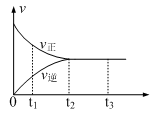
| A.0~t1,只有正反应在不断进行 |
| B.t1~t2,NH3的物质的量逐渐增大 |
| C.t2时刻,N2的转化率为100% |
| D.t2~t3,N2(g)、H2(g)、NH3(g)的物质的量浓度相等 |
【知识点】 化学平衡图像分析
 2HI(g)已达平衡状态的是
2HI(g)已达平衡状态的是| A.一个H—H键断裂的同时有2个H-I键形成 |
| B.v (H2)正=v (HI)逆时的状态 |
| C.恒温恒容时,体系的颜色不再发生变化的状态 |
| D.恒温恒容时,反应混合物总质量保持不变的状态 |
【知识点】 化学平衡状态的判断方法解读
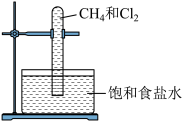
| A.试管中发生了取代反应 | B.生成油状液体浮在水面 |
| C.试管中液面上升 | D.试管中黄绿色褪去 |
【知识点】 甲烷的取代反应解读 甲烷取代反应实验探究解读
| A.将铁片变成铁粉 |
| B.将容器的容积缩小一半 |
| C.压强不变,充入N2使容器容积增大 |
| D.保持容积不变,充入N2使容器压强增大 |
A.NH3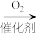 NO2 NO2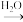 HNO3 HNO3 |
B.Mg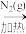 Mg3N2 Mg3N2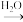 MgO MgO |
C.粗Si SiHCl3 SiHCl3 纯Si 纯Si |
D.S SO3 SO3 H2SO4 H2SO4 |
【知识点】 物质的转化 含硫化合物之间的转化解读
| A.向BaCl2中通入过量的SO2 | B.向Ca(ClO)2溶液中通入过量的CO2 |
| C.向AlCl3溶液中滴加过量的稀氨水 | D.向饱和Na2CO3溶液中通入过量的CO2 |
二、未知 添加题型下试题
三、单选题 添加题型下试题
A.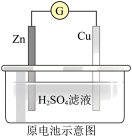 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加 |
B.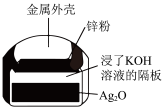 正极的电极反应式为Ag2O+2e−+H2O=2Ag+2OH− 正极的电极反应式为Ag2O+2e−+H2O=2Ag+2OH− |
C.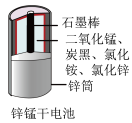 锌筒作负极,发生氧化反应,锌筒会变薄 锌筒作负极,发生氧化反应,锌筒会变薄 |
D.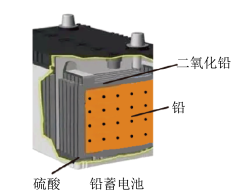 使用一段时间后,电解质溶液的酸性减弱,导电能力下降 使用一段时间后,电解质溶液的酸性减弱,导电能力下降 |
| 选项 | 溶液中的离子 | 通入(或加入)过量的某种物质 |
| A | H+、Ba2+、Fe3+、 | 通入SO2气体 |
| B |  、Na+、Br-、 、Na+、Br-、 | 通入CO2气体 |
| C | Fe3+、Na+、 、Cl- 、Cl- | 通入NH3气体 |
| D | Ca2+、Cl-、K+、 | 通入CO2气体 |
| A.A | B.B | C.C | D.D |
【知识点】 离子共存 限定条件下的离子共存解读 硝酸盐的氧化性解读
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n molNO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
| A.3个 | B.4个 | C.5个 | D.6个 |
【知识点】 化学平衡状态 化学平衡状态的判断方法解读
 B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有
B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有①单位时间内生成2molA的同时生成1molB ②v (B): v (C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变
| A.3个 | B.4个 | C.5个 | D.6个 |
【知识点】 化学平衡状态 化学平衡状态的判断方法解读

| A.铜电极上发生氧化反应 |
B.电池工作一段时间后,甲池的c( )减小 )减小 |
| C.电池工作一段时间后,乙池溶液的总质量增加 |
| D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
【知识点】 原电池
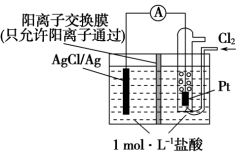
| A.正极反应为AgCl +e-=Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
【知识点】 原电池 原电池正负极判断解读 原电池电极反应式书写解读
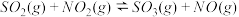 达到平衡,正反应速率随时间变化的示意图如下所示。下列叙述正确的是
达到平衡,正反应速率随时间变化的示意图如下所示。下列叙述正确的是
| A.反应在c 点达到平衡状态 |
B.反应物浓度: 点小于 点小于 点 点 |
| C.反应物的总能量低于生成物的总能量 |
D. 时,SO2的转化率: 时,SO2的转化率: 段小于 段小于 段 段 |
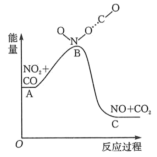
| A.图中A→B的过程为放热过程 |
| B.1molNO2和1molCO断键吸收的能量大于形成1molNO和1molCO2成键放出的能量 |
| C.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量 |
| D.该反应可以看成将储存在NO2(g)和CO(g)内部的能量以热能的形式释放出来 |
【知识点】 化学反应中能量变化的原因 化学键与化学反应中的能量关系解读
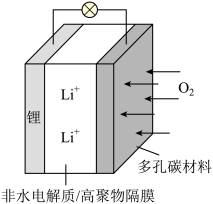
| A.放电时,多孔碳材料电极为负极 |
| B.放电时,外电路电子由多孔碳材料电极流向锂电极 |
| C.放电时,电解质溶液中Li+向锂电极迁移 |
D.放电时,电池总反应为2Li+(1-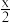 )O2=Li2O2-x )O2=Li2O2-x |
【知识点】 原电池原理 原电池电极反应式书写解读 新型电池解读
 在不同浓度时的化学反应速率
在不同浓度时的化学反应速率 见下表:
见下表:| 实验编号 | 1 | 2 | 3 | 4 | 5 |
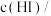 mol/L mol/L |  | 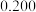 | 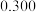 |  |  |
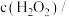 mol/L mol/L |  |  |  | 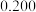 | 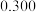 |
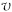 / mol·(L·s) / mol·(L·s)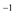 | 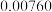 | 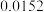 | 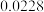 | 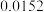 | 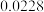 |
由此可推出当
 mol/L、
mol/L、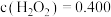 mol/L时的反应速率为:
mol/L时的反应速率为:A. mol·(L·s) mol·(L·s) | B.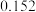 mol·(L·s) mol·(L·s) |
C.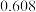 mol·(L·s) mol·(L·s) | D.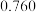 mol·(L·s) mol·(L·s) |

| A.装置d之后需要增加尾气处理装置 |
| B.装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成 |
| C.装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2 |
| D.分解的气体产物中有SO3、SO2,应该先检验SO3 |
【知识点】 三氧化硫 二氧化硫的化学性质 物质性质实验方案的设计解读
四、填空题 添加题型下试题
①甲烷和己烷;②CH3-CH2-CH2-CH3与CH3-CH2-C2H5③12C和13C④O2和O3⑤
 和
和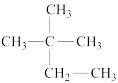 ⑥
⑥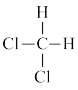 和
和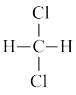
五、解答题 添加题型下试题
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=
(4)原混合气体中,a:b=
(5)达到平衡时,n(N2):n(H2):n(NH3)=
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验。请完成以下实验设计表。
| 实验 编号 | 温度 | 初始pH | 0.1mol·L-1草酸体积/mL | 0.01mol·L-1KMnO4体积/mL | 蒸馏水 体积/mL | 数据 混合液褪色时间/s |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式为
(3)若t1<t2,则根据实验①和②得到的结论是
(4)请你设计实验④验证MnSO4对该反应起催化作用,完成表中内容。
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
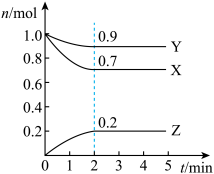
(1)由图中所给数据进行分析,该反应的化学方程式为
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。
 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时
(5)为加快反应速率,可以采取的措施是
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
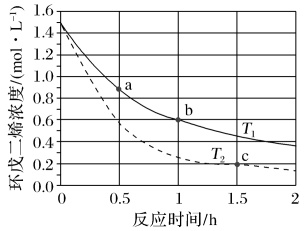
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时环戊二烯的浓度为0.45 mol/L
(2)298 K时,将20 mL 3x mol·L-1 Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH-(aq)⇌
(aq)+I2(aq)+2OH-(aq)⇌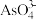 (aq)+2I-(aq)+ H2O(l)。溶液中c(
(aq)+2I-(aq)+ H2O(l)。溶液中c(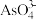 )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。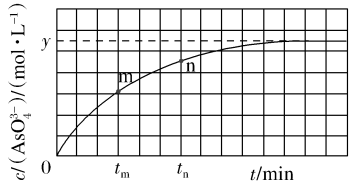
下列可判断反应达到平衡的是
a.溶液的pH不再变化
b.v(I-)=2v(
 )
)c.c(
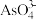 )/c(
)/c( )不再变化
)不再变化d.c(I-)=y mol·L-1
(3)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质是LiClO4,溶于混合有机溶剂中,金属锂离子(Li+)通过电解质迁移入二氧化锰晶格中,生成LiMnO2。

电池的正极反应式为
(4)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g) ②2HI(g)⇌H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=4mol•L﹣1,下列说法正确的是
A.平衡时,c(NH3)=5mol•L﹣1
B.反应起始时固体NH4I是5 mol
C.平衡时HI的分解率为20%
D.改变反应起始固体NH4I的量,保持其他条件不变,平衡时各气体浓度也发生改变
(5)探究H2SO3的酸性强于HClO(可能需要的装置和试剂如图所示)。
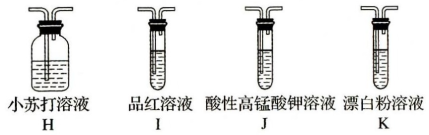
(5)所需装置的连接顺序为:纯净的SO2→
【知识点】 化学平衡图像分析 化学平衡状态的判断方法解读 原电池的判断解读
试卷分析
试卷题型(共 30题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 原子结构示意图、离子结构示意图 有机物的结构式、结构简式、比例模型、球棍模型、最简式 共价型分子结构式、电子式 | |
| 2 | 0.65 | 硅单质 二氧化硅 硅酸与硅酸盐 | |
| 3 | 0.85 | 硫的氧化物对人体、环境的危害 酸雨 大气污染的治理原理及方法 | |
| 4 | 0.85 | 浓度对化学反应速率的影响 温度对化学反应速率的影响 | |
| 5 | 0.85 | 铝与强碱溶液反应 原电池原理理解 原电池电子流向判断及应用 | |
| 6 | 0.65 | 氯气 一氧化氮 二氧化硫 物质分离、提纯的常见化学方法 | |
| 7 | 0.85 | 化学反应速率计算 化学反应速率与化学计量数之间的关系 | |
| 8 | 0.65 | 化学平衡图像分析 | |
| 9 | 0.85 | 化学平衡状态的判断方法 | |
| 10 | 0.85 | 甲烷的取代反应 甲烷取代反应实验探究 | |
| 11 | 0.94 | 影响化学反应速率的外因 浓度对化学反应速率的影响 影响化学反应速率的其他因素 | |
| 12 | 0.65 | 物质的转化 含硫化合物之间的转化 | |
| 13 | 0.85 | 漂白粉的变质原因及检验 二氧化硫的化学性质 碳酸钠与碳酸氢钠性质的比较 氢氧化铝 | |
| 15 | 0.65 | 原电池原理理解 原电池电极反应式书写 锰锌干电池 铅蓄电池 | |
| 16 | 0.65 | 离子共存 限定条件下的离子共存 硝酸盐的氧化性 | |
| 17 | 0.65 | 化学平衡状态 化学平衡状态的判断方法 | |
| 18 | 0.65 | 化学平衡状态 化学平衡状态的判断方法 | |
| 19 | 0.4 | 原电池 | |
| 20 | 0.65 | 原电池 原电池正负极判断 原电池电极反应式书写 | |
| 21 | 0.65 | 化学平衡的移动及其影响因素 化学平衡题中基于图表数据的相关计算 | |
| 22 | 0.65 | 化学反应中能量变化的原因 化学键与化学反应中的能量关系 | |
| 23 | 0.85 | 原电池原理 原电池电极反应式书写 新型电池 | |
| 24 | 0.65 | 化学反应速率计算 | |
| 25 | 0.65 | 三氧化硫 二氧化硫的化学性质 物质性质实验方案的设计 | |
| 二、未知 | |||
| 14 | 0.65 | 化学平衡的有关计算 可逆反应及反应限度 转化率的相关计算及判断 | 未知 |
| 三、填空题 | |||
| 26 | 0.85 | 同系物的判断 同分异构现象、同分异构体的概念 “四同”的相关比较 “四素”比较 | |
| 四、解答题 | |||
| 27 | 0.65 | 化学平衡的有关计算 可逆反应及反应限度 | 原理综合题 |
| 28 | 0.65 | 影响化学反应速率的因素 外因对化学反应速率影响的综合分析 化学实验探究 | 实验探究题 |
| 29 | 0.65 | 根据△H=反应物的键能之和-生成物的键能之和进行计算 化学反应速率计算 影响化学反应速率的外因 转化率的相关计算及判断 | 原理综合题 |
| 30 | 0.65 | 化学平衡图像分析 化学平衡状态的判断方法 原电池的判断 | 原理综合题 |

 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是

