山东师范大学附属中学2021届高三上学期期中考试(11月)化学试题
山东
高三
期中
2020-11-27
1489次
整体难度:
适中
考查范围:
常见无机物及其应用、化学与STSE、化学反应原理、化学实验基础、认识化学科学、物质结构与性质
一、单选题 添加题型下试题
| A.酒精和84消毒液混合使用能提高对新型冠状病毒的预防效果 |
| B.纳米铁粉可以去除被污染水体中的Cu2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 |
| C.燃煤中加入CaO可以减少酸雨的形成,同时也可以减少温室气体的排放 |
| D.5G时代某三维存储器能储存海量数据,其半导体衬底材料是单晶硅 |
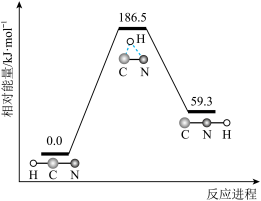
| A.HCN比HNC稳定 |
| B.该异构化反应的ΔH=59.3kJ·mol-1 |
| C.使用催化剂,不能改变反应的反应热 |
| D.升高温度,该反应正反应速率增大的程度大于逆反应速率增大的程度 |
【知识点】 焓变 化学能与物质稳定性之间的关系解读 温度对化学平衡移动的影响解读
| A.配制5%氯化钠溶液时,将称量的氯化钠放入烧杯中,然后加计量的水搅拌溶解 |
| B.测定硫酸铜晶体的结晶水含量时,需用小火缓慢加热,防止晶体飞溅 |
| C.用硝酸银溶液滴定氯离子时,可用溴离子作指示剂 |
| D.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 |
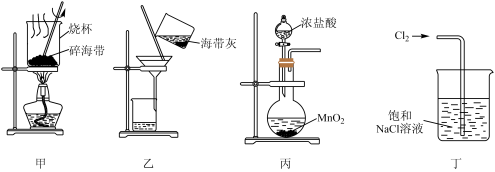
| A.用装置甲灼烧碎海带 |
| B.用装置乙过滤海带灰的浸泡液 |
| C.用装置丙制备用于氧化浸泡液中I−的Cl2 |
| D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气 |
【知识点】 氯气的实验室制法解读 海带中碘的提取及检验解读
5. 下列实验操作能达到实验目的或得出相应结论的是
实验操作 | 目的或结论 | |
A | 将Cu片放入FeC13溶液中 | 证明Fe的金属性比Cu强 |
B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁的还原性比碳强 |
C | 将SO2通入溴水或酸性KMnO4溶液中 | 证明SO2有漂白性 |
D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
| A.A | B.B | C.C | D.D |
| A.“全碳气凝胶”可用作处理海上原油泄漏的吸油材料 |
| B.“全碳气凝胶”与石墨互为同位素 |
| C.“全碳气凝胶”中含有碳碳双键,属于烯烃 |
| D.“全碳气凝胶”的性质稳定,能在热的浓硫酸中稳定存在 |

| A.a极为负极 |
| B.处理污水时,Cl-移向a极,b极附近溶液的pH减小 |
| C.阳极上产生臭氧的电极反应式为O2+2OH--2e-=O3+H2O |
| D.为了降低原材料成本,可将多孔铂电极a换成Fe电极 |
 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )
| A.放电时,ClO4-向负极移动 |
| B.充电时释放CO2,放电时吸收CO2 |
| C.放电时,正极反应为:3CO2+4e-=2CO32-+C |
| D.充电时,正极反应为:Na++e-=Na |
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=206.1 kJ·mol-1
| A.反应①中电能转化为化学能 |
| B.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8 kJ·mol-1 |
| C.反应③使用催化剂,ΔH3减小 |
| D.H2的燃烧热为571.6 kJ·mol-1 |
【知识点】 盖斯定律与热化学方程式解读 盖斯定律的应用解读

| A.OH-在反应中做催化剂 | B.该反应可产生清洁燃料H2 |
| C.该反应属于氧化还原反应 | D.该催化循环中Fe的成键数目未发生变化 |
【知识点】 氧化还原反应定义、本质及特征解读 共价键
二、多选题 添加题型下试题
 室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
| A.室温下,A点的溶液显酸性 |
| B.A点时加入氢氧化钠溶液的体积小于20.00 mL |
| C.室温下,AG=7 溶液的pH=3.5 |
| D.从0到B,水的电离程度逐渐减小 |
三、单选题 添加题型下试题
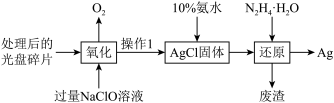
| A.氧化过程中参加反应的Ag和NaClO的物质的量比之为1:1 |
| B.为了提高氧化过程的反应速率和产率,氧化过程应该在酸性、加强热条件下进行 |
| C.氧化过程中,可以用HNO3代替NaClO 氧化Ag |
D.还原过程,若水合肼转化为无害气体 ,则还原过程的离子方程式为4Ag++N2H4 ,则还原过程的离子方程式为4Ag++N2H4 H2O+4OH-=4Ag↓+N2↑+5H2O H2O+4OH-=4Ag↓+N2↑+5H2O |

下列说法错误的是
| A.“焙烧”时Fe(CrO2)2发生反应:4Fe(CrO2)2+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2 |
| B.过滤时需要的玻璃仪器有漏斗、烧杯、玻璃棒 |
| C.图中“滤渣”成分是Al(OH)3和H2SiO3 |
| D.“反应Ⅲ”每消耗32g硫黄,能产生2molCr(OH)3 |
【知识点】 沉淀溶解平衡的应用 物质分离、提纯综合应用解读 常见无机物的制备解读
四、多选题 添加题型下试题
 LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( )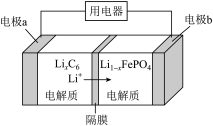
| A.充电时,电极a与电源正极连接,电极b与电源负极连接 |
| B.电池充电时,正极的电极反应为LiFePO4-xe-=Li1-xFePO4+xLi+ |
| C.电池工作时,负极材料质量减少0.7g,转移0.2mol电子 |
| D.电池充电时锂离子穿过隔膜向a极移动 |
五、单选题 添加题型下试题
 CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是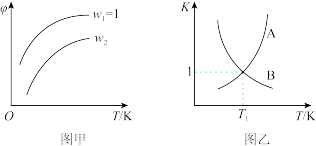
| A.图甲中W2>1 |
| B.图乙中,A线表示逆反应的平衡常数 |
| C.温度为T1,W=2时,Cl2的转化率为50% |
| D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强增大 |
六、解答题 添加题型下试题
已知:①饱和NaClO溶液析出晶体与温度的关系如表所示。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
| 温度/℃ | <38 | 38~60 | >60 |
| 晶体成分 | NaClO2 3H2O 3H2O | NaClO2 | NaClO2分解生成NaClO3和NaCl |
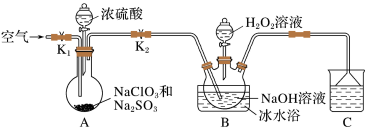
实验一、制备NaClO2晶体
(1)装置C的作用是
(2)装置B中反应生成NaClO2的化学方程式为
(3)装置B反应后的溶液中阴离子除了ClO
 、ClO
、ClO 、Cl-、ClO-、OH-外还可能含有的一种阴离子是
、Cl-、ClO-、OH-外还可能含有的一种阴离子是(4)从装置B反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤 D.冰水洗涤 E.38~60℃的温水洗涤
实验二、测定产品纯度
(5)准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗Na2S2O3标准溶液的平均值为VmL。(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-、I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-、I2+2S2O =2I-+S4O
=2I-+S4O )
)①达到滴定终点时的现象为
②该样品中NaClO2的质量分数为
③若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果
【知识点】 酸碱中和滴定原理的应用解读 物质的分离、提纯
七、填空题 添加题型下试题
 和熔融
和熔融 制成燃料电池,模拟工业电解法来处理含
制成燃料电池,模拟工业电解法来处理含 的废水,如图所示;电解过程中溶液发生反应:
的废水,如图所示;电解过程中溶液发生反应: 。
。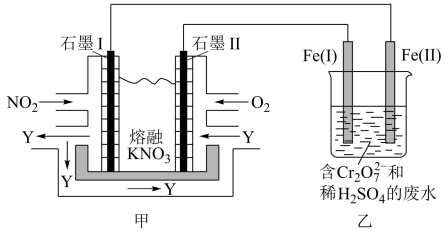
(1)甲池工作时,
 转变成绿色硝化剂Y,Y是
转变成绿色硝化剂Y,Y是 ,可循环使用。则石墨II是电池的
,可循环使用。则石墨II是电池的(2)工作时,甲池内的
 向
向 和
和 的体积比为
的体积比为(3)乙池中
 (I)棒上发生的电极反应为
(I)棒上发生的电极反应为(4)若溶液中减少了
 ,则电路中至少转移了
,则电路中至少转移了 电子。
电子。
八、解答题 添加题型下试题
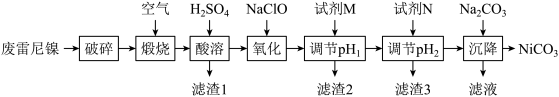
已知金属离子沉淀的pH:
| Ni2+ | Fe2+ | Fe3+ | Al3+ | |
| 开始沉淀的pH | 6.9 | 6.3 | 1.5 | 3.4 |
| 沉淀完全的pH | 8.9 | 8.3 | 2.8 | 4.7 |
回答下列问题:
(1)“破碎”的目的为
(2)“氧化”时发生反应的离子方程式为
(3)调节pH的范围为
a.FeO b.Fe2O3 c.Al2O3 d. NiO
(4)“沉降”后所得NiCO3沉淀在空气中热分解时,固体残留率(固体残留率=
 ×100%)与温度(T)的关系如图所示(已知当NiCO3加热至300℃ 时已完全失去碳元素)。
×100%)与温度(T)的关系如图所示(已知当NiCO3加热至300℃ 时已完全失去碳元素)。 加热至A点过程中反应的化学方程式为
加热至A点过程中反应的化学方程式为
(5)该回收工艺中可回收的金属化合物有
 、
、九、填空题 添加题型下试题
(1)研究表明在无催化剂作用下N2O与CO难以反应,原因是
(2)过渡态理论认为N2O和CO之间的反应分为两个过程,首先N2O与CO通过碰撞生成高能量的活化配合物,然后该活化配合物进一步转化为产物,其历程为:
第一步:N-N-O+C-O→N-NOC-O(慢反应) 活化配合物
第二步:N-NOC-O→N-N+O-C-O(快反应) 活化配合物
第一步反应为
(3)在400℃ 和650℃条件下,分别向两个相同体积的刚性容器中充入2molN2O和2molCO,发生反应CO(g)+N2O(g)=CO2(g)+N2(g)∆H<0,实验得出两容器中CO与N2的物质的量随时间的变化关系如图所示。已知气体的分压等于气体的总压乘以气体的体积分数,曲线ad对应的容器中平衡后总压为pxkPa,曲线bc对应的容器中平衡后总压为pxkPa。

①曲线ad表示
②a、c、d三点逆反应速率的大小顺序为
③ad段的平均反应速率
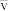 (N2O)
(N2O)④400℃条件下平衡常数Kp=
【知识点】 化学键与化学反应中的能量关系解读 化学反应的速率 化学平衡常数
十、解答题 添加题型下试题
(1)用CO还原N2O的能量变化如图甲所示,则该反应的热化学方程式为

在相同温度和压强下,1molN2O和1molCO经过相同反应时间测得如下实验数据:
| 实验 | 温度/℃ | 催化剂 | N2O转化率/% |
| 实验1 | 400 | 催化剂1 | 9.5 |
| 400 | 催化剂2 | 10.6 | |
| 实验2 | 500 | 催化剂1 | 12.3 |
| 500 | 催化剂2 | 13.5 |
试分析在相同温度时,催化剂2催化下N2O的转化率更高的原因是
(2)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入0.1molN2O、0.4molCO和相同催化剂。实验测得A、B容器中N2O的转化率随时间的变化关系如图乙所示。

①B容器中N2O的转化率随时间的变化关系是图乙中的
②要缩短b曲线对应容器达到平衡的时间,但不改变N2O的平衡转化率,在催化剂一定的情况下可采取的措施是
③500 ℃该反应的化学平衡常数K=
④实验测定该反应的反应速率v正=k正·c(N2O)·c(CO),v逆=k逆·c(N2)·c(CO2),k正、k逆分别是正、逆反应速率常数,c为物质的量浓度。计算M处的
 =
=试卷分析
试卷题型(共 20题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 硅的物理性质与用途 化学科学对人类文明发展的意义 大气污染的治理原理及方法 处理污水的几种方法 | |
| 2 | 0.65 | 焓变 化学能与物质稳定性之间的关系 温度对化学平衡移动的影响 | |
| 3 | 0.65 | 酸碱中和滴定实验相关仪器 酸碱中和滴定指示剂选择 仪器使用与实验安全 化学实验基础操作 | |
| 4 | 0.65 | 氯气的实验室制法 海带中碘的提取及检验 | |
| 5 | 0.65 | 二氧化硫与其他强氧化剂的反应 镁的结构与化学性质 Fe3+与其他物质氧化性强弱关系 | |
| 6 | 0.65 | 胶体 浓硫酸的强氧化性 几组常见同素异形体 石墨、金刚石和C60 | |
| 7 | 0.65 | 电解原理 电解原理的应用 | |
| 8 | 0.65 | 原电池原理的综合应用 新型电池 其他二次电池 电解原理的应用 | |
| 9 | 0.65 | 盖斯定律与热化学方程式 盖斯定律的应用 | |
| 10 | 0.65 | 氧化还原反应定义、本质及特征 共价键 | |
| 12 | 0.65 | 氧化还原反应方程式的配平 次氯酸及其性质 物质分离、提纯综合应用 常见无机物的制备 | |
| 13 | 0.65 | 沉淀溶解平衡的应用 物质分离、提纯综合应用 常见无机物的制备 | |
| 15 | 0.65 | 化学平衡图像分析 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 | |
| 二、多选题 | |||
| 11 | 0.65 | 水溶液中水的电离程度及的计算 溶液稀释时pH的变化图像 酸碱混合时的定性判断及计算 盐溶液的酸碱性判断 | |
| 14 | 0.65 | 原电池电极反应式书写 原电池原理的综合应用 新型电池 原电池有关计算 | |
| 三、解答题 | |||
| 16 | 0.4 | 酸碱中和滴定原理的应用 物质的分离、提纯 | 实验探究题 |
| 18 | 0.65 | 含氧化铝的混合物的提纯 盐类水解规律理解及应用 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 20 | 0.65 | 热化学方程式 化学反应的速率 化学平衡的有关计算 | 原理综合题 |
| 四、填空题 | |||
| 17 | 0.65 | 原电池、电解池综合考查 原电池有关计算 电解池有关计算 | |
| 19 | 0.65 | 化学键与化学反应中的能量关系 化学反应的速率 化学平衡常数 | |



