四川省成都外国语学校2020-2021学年高二下学期开学考试化学试题
四川
高二
开学考试
2021-03-12
492次
整体难度:
容易
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学反应原理、化学实验基础
一、单选题 添加题型下试题
| A.碳酸钠可用于去除餐具的油污 | B.漂白粉可用于生活用水的消毒 |
| C.氢氧化铝可用于中和过多胃酸 | D.碳酸钡可用于胃肠X射线造影检查 |
 。下列说法正确的是
。下列说法正确的是A.1L0.1mol· NH4Cl溶液中, NH4Cl溶液中, 的数量为0.1 的数量为0.1 |
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1 |
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2 |
D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 |
【知识点】 阿伏加德罗常数 阿伏加德罗定律 氧化还原反应有关计算
| A.甲醇的结构式:CH4O | B.钠离子的结构示意图: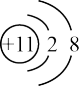 |
C.质子数为16、中子数为17的硫原子: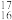 S S | D.硫化氢分子的电子式:H+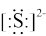 H+ H+ |
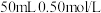 的盐酸与
的盐酸与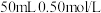 的
的 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是
| A.如图条件下实验过程中没有热量损失 |
| B.氢氧化钠溶液应一次性迅速倒入盐酸溶液中 |
| C.烧杯间填满碎纸条的作用是固定小烧杯 |
D.若改用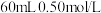 盐酸跟 盐酸跟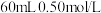 的 的 溶液进行反应,所放出热量相等 溶液进行反应,所放出热量相等 |
【知识点】 中和热的测定与误差分析解读 中和热的计算解读
 xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )
xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )| A.x=2 |
| B.2min时,B的浓度为0.4mol/L |
| C.0~2min内B的反应速率为0.2mol·L-¹·min-¹ |
| D.此时A的转化率为40% |
| A.保存FeCl2溶液时常常需要加入少量的Fe粉 |
| B.夏天打开可乐时,瓶中立刻泛起大量泡沫 |
| C.实验室中常用排饱和食盐水的方法收集Cl2 |
| D.黄色的Na2CrO4溶液中,加入硫酸后,溶液呈橙色 |
| A.只有AgBr沉淀生成 | B.AgCl和AgBr沉淀等量生成 |
| C.AgCl沉淀少于AgBr沉淀 | D.AgCl沉淀多于AgBr沉淀 |
【知识点】 难溶电解质的溶解平衡 溶度积定义及表达式解读
| A.仅在低温下自发进行 | B.仅在高温下自发进行 |
| C.在任何温度下都不能自发进行 | D.在任何温度下都能自发进行 |
【知识点】 化学反应自发过程解读 化学反应进行方向的判据
 2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是
2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是| A.混合气体的密度不变 | B.体系温度不变 |
| C.3v逆(NH3)=2v正(H2) | D.N2和NH3的浓度的比值不变 |
【知识点】 化学平衡状态 化学平衡状态本质及特征解读 化学平衡状态的判断方法解读

A.图Ⅰ比较CO 和HCO 和HCO 水解能力的强弱 水解能力的强弱 | B.图Ⅱ测定锌与稀硫酸的反应速率 |
| C.图Ⅲ研究浓度对反应速率的影响 | D.图Ⅳ比较碳酸和醋酸的酸性强弱 |
| A.2SO2(g)+O2(g)⇌2SO3(g)为放热反应,则该反应的反应物总能量低于生成物总能量 |
B.由C(s)+ O2(g)=CO(g) △H=-110.5kJ·mol-1,可知碳的燃烧热为110.5kJ·mol-1 O2(g)=CO(g) △H=-110.5kJ·mol-1,可知碳的燃烧热为110.5kJ·mol-1 |
| C.若C(石墨,s)⇌C(金刚石,s)△H>0,则石墨比金刚石稳定 |
D.已知C(s)+O2(g)=CO2(g)△H1;C(s)+ O2(g)=CO(g)△H2,则△H1>△H2 O2(g)=CO(g)△H2,则△H1>△H2 |
| A.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:K+、Na+、ClO-、I- |
B.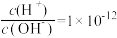 的溶液中:K+、AlO 的溶液中:K+、AlO 、CO 、CO 、Na+ 、Na+ |
C.c(H+)=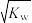 mol·L-1的溶液中:K+、Fe3+、Cl-、CO mol·L-1的溶液中:K+、Fe3+、Cl-、CO |
D.pH=13的溶液中:AlO 、Cl-、HCO 、Cl-、HCO 、SO 、SO |
| A.电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大 |
| B.氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体 |
| C.向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度 |
| D.粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变 |
| A.氯气溶于水:Cl2+H2O⇌2H++Cl-+ClO- |
| B.明矾[KAl(SO4)2∙12H2O]作净水剂:Al3++3H2O⇌ Al(OH)3↓+3H+ |
C.铜作电极电解NaCl溶液初始阶段:Cu+2H2O Cu(OH)2+ H2↑ Cu(OH)2+ H2↑ |
D.饱和Na2CO3溶液处理水垢中的CaSO4:Ca2++CO =CaCO3↓ =CaCO3↓ |
【知识点】 离子方程式的正误判断解读 沉淀转化解读 电解原理的理解及判断解读
| A.0.04 mol·L-1 | B.0.05 mol·L-1 | C.0.017 mol·L-1 | D.0.50 mol·L-1 |
【知识点】 酸碱混合时的定性判断及计算解读

| A.a点溶液中:c(H+)=6.0×10-3mol·L-1 |
| B.b点溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH) |
| C.c点溶液中:c(OH-)=c(CH3COOH)+ c(H+) |
| D.d点溶液中:2c(Na+)=c(CH3COO-)+c(CH3COOH) |

| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池中正极的电极反应式是O2+4e-+4H+=2H2O |
| C.反应过程中,乙池的pH逐渐减小 |
| D.甲池中消耗O2的体积与丙池生成气体的总体积在相同条件下的比值为1∶2 |
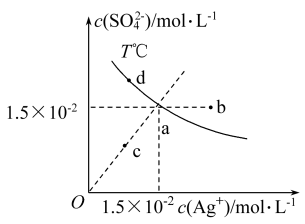
| A.a点溶液加入硝酸银固体,则a点可沿虚线移动到b点 |
| B.a点溶液若降低温度,则a点可沿虚线移动到c点 |
| C.向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动 |
| D.根据曲线数据计算可知,T ℃下,Ksp(Ag2SO4)=2.25×10-4 |

| A.电极N为电池的负极 |
| B.电池工作时,H+由右极区通过交换膜移动到左极区 |
| C.N电极的电极反应方程式为2CH3CH2NH2+8H2O-30e-=4CO2↑+N2↑+30H+ |
| D.当空气(假设含氧气20%)的进入量为7.5mol时,可以处理含乙胺9%(质量分数)的废水0.1kg |
| t/min | 2 | 4 | 6 | 8 |
| n(B)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A.反应6min时刚好达到平衡状态 |
| B.其他条件不变,升高温度,反应达到新平衡前v(逆)>v(正) |
| C.其他条件不变,向平衡体系中再充入0.32mol气体C,到达平衡时,n(C)=0.24mol |
| D.其他条件不变,向容器中通入A、B、C各0.1mol气体,反应逆向进行 |
【知识点】 等效平衡 化学平衡常数 化学平衡的有关计算 温度对化学平衡移动的影响解读
二、填空题 添加题型下试题

(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极为电源的
(2)电解饱和食盐水的离子反应方程式是
(3)电极C的电极反应是
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的质子守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性
(6)25℃时,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应完后溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离平衡常数Kb=三、解答题 添加题型下试题

(1)装置甲中,a仪器的名称是
(2)装置乙的作用是
(3)装置丙中,将Na2S和Na2CO3以2:1的物质的量之比配成溶液再通入SO2,便可制得Na2S2O3和CO2。写出反应的化学方程式:
(4)反应结束后过滤丙中的混合物,滤液经蒸发、结晶、过滤、洗涤、干燥等得到产品,生成的硫代硫酸钠粗品可用
 被氧化为SO
被氧化为SO 时消耗高锰酸钾溶液的体积为40.00mL。则:
时消耗高锰酸钾溶液的体积为40.00mL。则:①该反应的离子方程式为:
②产品中Na2S2O3·5H2O(M=248g/mol)的质量分数为
③若酸式滴定管未用标准液润洗,测定结果将
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)。甲容器15 min后达到平衡,此时CO2的转化率为75%。则0〜15 min内用二氧化碳表示平均反应速率v(CO2)=
(3)已知(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g)⇌2NH4HCO3(aq)。将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:

①c点的逆反应速率和d点的正反应速率的大小关系为V逆c
②b、c、d三点的平衡常数K b、K c、 Kd 从大到小的顺序为
③T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是
【知识点】 化学平衡常数的有关计算解读 转化率的相关计算及判断解读

(一定条件下,
 可与Mn2+反应生成MnO2)
可与Mn2+反应生成MnO2)已知: 生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)Al2O3属于两性氧化物,也可以溶解在氢氧化钠溶液中,离子方程式为:
(2)检验滤液中还存在Fe2+的方法是
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ中加入KMnO4的离子方程式为:
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是
③Ⅲ中加入MnSO4的目的是
(4)从多次循环使用后母液中可回收的主要物质是
【知识点】 物质分离、提纯综合应用解读 常见无机物的制备解读
试卷分析
试卷题型(共 25题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 漂白粉和漂粉精 碳酸钠的俗称、物理性质及用途 明矾的净水作用及原理 化学科学对人类文明发展的意义 | |
| 2 | 0.4 | 阿伏加德罗常数 阿伏加德罗定律 氧化还原反应有关计算 | |
| 3 | 0.85 | 有关粒子结构的化学用语 化学用语综合判断 原子结构示意图、离子结构示意图 共价型分子结构式、电子式 | |
| 4 | 0.65 | 中和热的测定与误差分析 中和热的计算 | |
| 5 | 0.85 | 化学反应速率计算 化学平衡的有关计算 | |
| 6 | 0.85 | 勒夏特列原理的应用 易水解的盐溶液的配制 盐类水解在生活、生产中的应用 | |
| 7 | 0.65 | 难溶电解质的溶解平衡 溶度积定义及表达式 | |
| 8 | 0.65 | 化学反应自发过程 化学反应进行方向的判据 | |
| 9 | 0.85 | 化学平衡状态 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 10 | 0.85 | 浓度对化学反应速率的影响 盐类水解规律理解及应用 化学实验方案的设计与评价 | |
| 11 | 0.65 | 化学能与物质稳定性之间的关系 燃烧热概念 反应热大小比较 | |
| 12 | 0.65 | 限定条件下的离子共存 水的离子积常数 pH定义式及计算 盐类双水解反应 | |
| 13 | 0.65 | 电解后溶液的复原 电解过程中溶液pH的变化 铜的电解精炼 电解池有关计算 | |
| 14 | 0.85 | 离子方程式的正误判断 沉淀转化 电解原理的理解及判断 | |
| 15 | 0.85 | 酸碱混合时的定性判断及计算 | |
| 16 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 弱电解质的电离平衡常数 | |
| 17 | 0.4 | 电化学计算 电解原理的应用 | |
| 18 | 0.65 | 浓度对难溶电解质溶解平衡的影响 温度对难溶电解质溶解平衡的影响 溶度积常数相关计算 | |
| 19 | 0.65 | 原电池的结构 原电池正负极判断 原电池电极反应式书写 | |
| 20 | 0.65 | 等效平衡 化学平衡常数 化学平衡的有关计算 温度对化学平衡移动的影响 | |
| 二、填空题 | |||
| 21 | 0.65 | 电化学计算 铅蓄电池 电解原理 电解原理的应用 | |
| 22 | 0.85 | 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 三、解答题 | |||
| 23 | 0.65 | 化学方程式计算中物质的量的运用 二氧化硫的制备 二氧化硫的弱氧化性 常见无机物的制备 | 实验探究题 |
| 24 | 0.65 | 化学平衡常数的有关计算 转化率的相关计算及判断 | 原理综合题 |
| 25 | 0.65 | 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |



