云南省腾冲市第八中学2018-2019学年高二下学期期中考试化学试题
云南
高二
期中
2019-05-26
336次
整体难度:
适中
考查范围:
化学反应原理、认识化学科学、有机化学基础、化学实验基础、常见无机物及其应用、物质结构与性质
一、单选题 添加题型下试题
| A.c(HCl)>c(CH3COOH) |
| B.c(Cl-)=c(CH3COO-) |
| C.等体积的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 |
| D.用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多 |
| A.55 kJ | B.220 kJ | C.550 kJ | D.1108 kJ |
| A.氢氧燃料电池放电时化学能全部转化为电能 |
| B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 |
| C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023 |
| D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快 |
【知识点】 氧化还原反应有关计算 化学反应进行方向的判据 氢氧燃料电池解读 酶
 2NH3(g)ΔH<0,若在恒压容器中发生,下列选项表明反应一定已达平衡状态的是( )
2NH3(g)ΔH<0,若在恒压容器中发生,下列选项表明反应一定已达平衡状态的是( )| A.容器内气体的密度不再变化 |
| B.容器内压强保持不变 |
| C.相同时间内,生成N-H键的数目与断开H-H键的数目相等 |
| D.容器内气体的浓度之比c(N2)∶c(H2)∶c(NH3)=1∶3∶2 |
【知识点】 化学平衡状态 化学平衡状态的判断方法解读
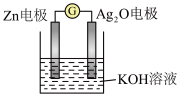
| A.Zn电极是负极 |
| B.Ag2O电极发生还原反应 |
| C.Zn电极的电极反应式:Zn-2e-+2OH-=Zn(OH)2 |
| D.放电前后电解质溶液的pH保持不变 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
| B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
| C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
| D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
| A.A | B.B | C.C | D.D |
【知识点】 溶度积常数与溶解度的关系解读 化学实验方案的设计与评价


A.氢氧燃料电池工作时, 在负极上失去电子 在负极上失去电子 |
B.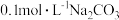 溶液加热后,溶液的pH减小 溶液加热后,溶液的pH减小 |
C.常温常压下,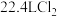 中含有的分子数为 中含有的分子数为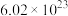 个 个 |
D.室温下,稀释 溶液,溶液的导电能力增强 溶液,溶液的导电能力增强 |
【知识点】 气体摩尔体积 弱电解质的电离平衡 温度对盐类水解的影响解读 原电池原理
| A.纯碱可用于去除物品表面的油污 | B.水可用作钠燃烧的灭火剂 |
| C.植物秸秆可用于制造酒精 | D.氢氧化铁胶体可用作净水剂 |

A.温度T下,该反应的平衡常数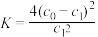 |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
| C.曲线b对应的条件改变可能是加入了催化剂 |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
【知识点】 化学平衡的移动及其影响因素 化学平衡常数 化学平衡图像分析
| A.AgCl的溶解度、Ksp均减小 | B.AgCl的溶解度、Ksp均不变 |
| C.AgCl的溶解度减小、Ksp不变 | D.AgCl的溶解度不变、Ksp减小 |
【知识点】 沉淀溶解平衡的应用 溶度积常数与溶解度的关系解读

A.反应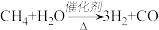 ,每消耗1mol CH4转移12mol 电子 ,每消耗1mol CH4转移12mol 电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
【知识点】 原电池电极反应式书写解读 燃料电池
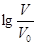 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )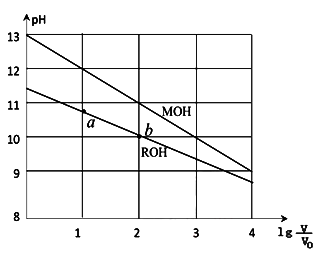
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当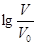 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则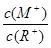 增大 增大 |
| A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存 |
| B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 |
| C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+= Cl-+2Fe3++H2O |
| D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
【知识点】 离子反应的发生及书写 限定条件下的离子共存解读
| A.再通入少量氯气,c(H+)/c(ClO-)减小 |
| B.通入少量SO2,溶液漂白性增强 |
| C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-) |
| D.加入少量水,水的电离平衡向正反应方向移动 |
| A.CH3COOH溶液与Zn反应放出H2 |
| B.0.1 mol/L CH3COONa溶液的pH大于7 |
| C.CH3COOH溶液与Na2CO3反应生成CO2 |
| D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红 |
| A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O) |
| B.加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-) |
| C.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+) |
| D.加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+) |
 )具有强氧化性,其还原产物
)具有强氧化性,其还原产物 在水溶液中呈绿色。在
在水溶液中呈绿色。在 溶液中存在下列平衡:
溶液中存在下列平衡: (橙色)
(橙色) (黄色)
(黄色) 。用
。用 溶液进行如图所示实验,下列说法不正确的是
溶液进行如图所示实验,下列说法不正确的是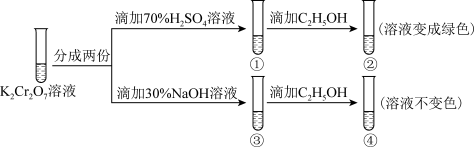
| A.①中溶液橙色加深,③中溶液变为黄色 |
B.②中 被 被 还原 还原 |
C.对比②和④可知, 酸性溶液氧化性强 酸性溶液氧化性强 |
D.若向④中加入70% 溶液至过量,溶液变为橙色 溶液至过量,溶液变为橙色 |
【知识点】 化学平衡的移动及其影响因素 浓度对化学平衡移动的影响解读
 2HI(g) △H<0,当该反应达到平衡时,下列说法正确的是( )
2HI(g) △H<0,当该反应达到平衡时,下列说法正确的是( )A.减小容器体积,平衡向右移动  | B.加入催化剂,HI的产率增大 |
C.增大c(I2),H2的转化率增大  | D.升高温度,I2的转化率增大 |
【知识点】 化学平衡的移动及其影响因素
A.K2SO4  | B.NaOH | C.CuSO4  | D.Na2CO3 |
| A.25℃时,向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 |
B.向0.1mol·L-1CH3COOH溶液中加入少量的CH3COONa晶体, 减小 减小 |
| C.常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小 |
| D.一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小 |
| A.强电解质溶液的导电能力一定比弱电解质溶液的强 |
B.一定温度下,可逆反应2X(g)+Y(g) 2Z(g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 2Z(g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 |
| C.升高温度,AgCl的溶解度增大,Ksp增大 |
| D.FeCl3、KAl(SO4)2、Na2CO3的水溶液均显酸性 |
 合成甲醇(CH3OH)的化学方程式为
合成甲醇(CH3OH)的化学方程式为
 ,按照相同的物质的量投料,测得
,按照相同的物质的量投料,测得 在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是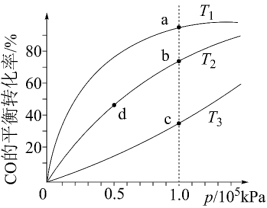
A.温度: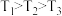 |
B.正反应速率: 、 、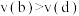 |
C.平衡常数: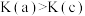 、 、 |
D.平均摩尔质量: 、 、 |
 ,反应一段时间后达到平衡状态,测得生成1.6 mol C。下列说法正确的是
,反应一段时间后达到平衡状态,测得生成1.6 mol C。下列说法正确的是A.该反应的化学平衡常数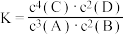 |
| B.B的平衡转化率是40% |
| C.增大压强,化学平衡常数增大 |
| D.增加B的量,B的平衡转化率增大 |
| A.物质发生化学反应时必然伴随着能量变化 |
| B.金属铜导电,故金属铜是电解质 |
| C.自发反应都是熵增大的反应 |
| D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 |
【知识点】 化学反应中能量变化的原因
| A.分子式为C2H6O的有机化合物性质相同 |
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a: ,途径b: ,途径b: |
| C.在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 |
| D.通过化学变化可以直接将水转变为汽油 |
【知识点】 氧化还原反应的规律解读 盖斯定律及其有关计算 同分异构现象
 。下列说法正确的是
。下列说法正确的是A.1L0.1mol· NH4Cl溶液中, NH4Cl溶液中, 的数量为0.1 的数量为0.1 |
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1 |
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2 |
D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 |
【知识点】 阿伏加德罗常数 阿伏加德罗定律 氧化还原反应有关计算
| A.原子半径:r(W) > r(Z) > r(Y) |
| B.由X、Y 组成的化合物中均不含共价键 |
| C.Y 的最高价氧化物的水化物的碱性比Z的弱 |
| D.X 的简单气态氢化物的热稳定性比W的强 |
【知识点】 元素周期律、元素周期表的推断

| A.实验①、②所涉及的物质均为电解质 |
| B.实验②、③均为放热反应实验 |
| C.②、③均未发生氧化还原反应 |
| D.实验①、③反应制得的物质均为纯净物 |
| A.3种溶液pH的大小顺序是③>②>① |
| B.若将3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是① |
| D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
| A.用物质A表示的反应速率为1.2 mol/(L•s) |
| B.用物质B表示的反应速率为0.3mol/(L•s) |
| C.2s时物质A的转化率为40% |
| D.2s时物质B的浓度为0.6mol/L |
二、填空题 添加题型下试题
(1)NaHSO3溶液显酸性:
(2)NaHCO3溶液显碱性:
(3)NH4Cl溶液显酸性:
(4)明矾[KAl(SO4)2]净水:
(5)FeCl3溶液蒸干得到Fe2O3固体:
II.向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2CO3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
三、解答题 添加题型下试题
(1)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4kJ/mol
②NaOH(s)+CO2(g) = NaHCO3(s) ΔH2=−131.5kJ/mol
反应2NaHCO3(s)=Na2CO3(s) +H2O(g) +CO2(g)的ΔH=
(2)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中
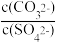 =
=II.Mg﹣H2O2电池可用于驱动无人驾驶的潜航器,该电池以海水为电解质溶液,其工作原理如图所示,电池总反应是:Mg+H2O2+2H+═ Mg2++2H2O

(1)负极材料为
(2)两极电极反应式为:
负极:
(3)有4.8gMg反应时时,外电路中转移电子数为
【知识点】 盖斯定律及其有关计算 化学平衡常数 溶度积常数相关计算解读 原电池
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液。除烧杯和玻璃棒外,还需要的玻璃仪器有
(2)选择酚酞为指示剂进行滴定:
①盛装0.1000mol/L的盐酸标准液应该使用
②滴定时双眼应
③滴定终点的实验现象:
(3)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| ① | 20.00 | 0.50 | 20.78 |
| ② | 20.00 | 1.20 | 21.32 |
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果
③读数时,滴定前仰视,滴定后俯视,会使测定结果
④装标准液之前,没有用标准液润洗滴定管,会使测定结果
试卷分析
试卷题型(共 33题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 | |
| 2 | 0.85 | 燃烧热概念 燃烧热的计算 | |
| 3 | 0.65 | 氧化还原反应有关计算 化学反应进行方向的判据 氢氧燃料电池 酶 | |
| 4 | 0.65 | 化学平衡状态 化学平衡状态的判断方法 | |
| 5 | 0.65 | 新型电池 | |
| 6 | 0.65 | 溶度积常数与溶解度的关系 化学实验方案的设计与评价 | |
| 7 | 0.65 | 气体摩尔体积 弱电解质的电离平衡 温度对盐类水解的影响 原电池原理 | |
| 8 | 0.85 | 胶体的性质和应用 钠 盐类水解在生活、生产中的应用 糖类生产乙醇 | |
| 9 | 0.65 | 化学平衡的移动及其影响因素 化学平衡常数 化学平衡图像分析 | |
| 10 | 0.65 | 沉淀溶解平衡的应用 溶度积常数与溶解度的关系 | |
| 11 | 0.65 | 原电池电极反应式书写 燃料电池 | |
| 12 | 0.65 | 溶液稀释时pH的变化图像 弱电解质的电离平衡 弱电解质电离平衡的影响因素 弱电解质在水溶液中的电离平衡 | |
| 13 | 0.4 | 离子反应的发生及书写 限定条件下的离子共存 | |
| 14 | 0.65 | 浓度对化学平衡移动的影响 影响水电离的因素 弱电解质电离平衡的影响因素 | |
| 15 | 0.65 | 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 盐类水解的应用 | |
| 16 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 17 | 0.65 | 化学平衡的移动及其影响因素 浓度对化学平衡移动的影响 | |
| 18 | 0.65 | 化学平衡的移动及其影响因素 | |
| 19 | 0.65 | 浓度对化学反应速率的影响 原电池原理对化学反应速率的影响 | |
| 20 | 0.65 | 影响水电离的因素 弱电解质电离平衡的影响因素 溶度积定义及表达式 | |
| 21 | 0.64 | 化学平衡 弱电解质的电离 盐类的水解 沉淀溶解平衡 | |
| 22 | 0.85 | 温度对化学平衡移动的影响 压强对化学平衡移动的影响 与转化率变化有关图像的分析 | |
| 23 | 0.65 | 压强对化学平衡移动的影响 化学平衡常数的概念及表达方式 化学平衡常数的影响因素及应用 转化率的相关计算及判断 | |
| 24 | 0.85 | 化学反应中能量变化的原因 | |
| 25 | 0.65 | 氧化还原反应的规律 盖斯定律及其有关计算 同分异构现象 | |
| 26 | 0.4 | 阿伏加德罗常数 阿伏加德罗定律 氧化还原反应有关计算 | |
| 27 | 0.85 | 元素周期律、元素周期表的推断 | |
| 28 | 0.64 | 化学实验基础 卤素及其化合物 | |
| 29 | 0.65 | 弱电解质的电离平衡 一元强酸与一元弱酸的比较 盐溶液中离子浓度大小的比较 | |
| 30 | 0.85 | 化学反应速率计算 化学反应速率与化学计量数之间的关系 | |
| 二、填空题 | |||
| 31 | 0.65 | 影响盐类水解程度的主要因素 水解的离子方程式书写 盐溶液的酸碱性判断 盐类水解在生活、生产中的应用 | |
| 三、解答题 | |||
| 32 | 0.65 | 盖斯定律及其有关计算 化学平衡常数 溶度积常数相关计算 原电池 | 原理综合题 |
| 33 | 0.65 | 酸碱中和滴定 酸碱中和滴定实验相关仪器 酸碱中和滴定的误差分析 | 实验探究题 |



