江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题
江苏
高二
阶段练习
2020-12-24
96次
整体难度:
适中
考查范围:
化学与STSE、有机化学基础、认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题
江苏
高二
阶段练习
2020-12-24
96次
整体难度:
适中
考查范围:
化学与STSE、有机化学基础、认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
名校
解题方法
1. 2020年4月20日,习近平总书记来到秦岭,关注山清水秀。下列做法正确的是( )
| A.集中深埋废旧电池 | B.远海排放工业污水 |
| C.减少冶炼含硫矿物 | D.推广使用一次性木筷 |
【知识点】 大气污染 水污染 固体废弃物的处理 绿色化学与可持续发展解读
您最近一年使用:0次
2020-05-21更新
|
311次组卷
|
4卷引用:江苏省泰州市2020届高三第二次模拟考试(5月) 化学试题
单选题
|
较易(0.85)
名校
解题方法
您最近一年使用:0次
2020-05-30更新
|
80次组卷
|
6卷引用:陕西省西安中学2017-2018学年高二(平行班)下学期期末考试化学试题
单选题
|
适中(0.65)
名校
3. 在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3,下列表述正确的是
| A.[Co(NH3)6]Cl3中Co的化合价是+3 | B.H2O2 的电子式: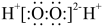 |
| C.NH3和NH4Cl化学键类型相同 | D.中子数为32,质子数为27的钴原子: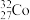 |
您最近一年使用:0次
2019-09-04更新
|
463次组卷
|
13卷引用:北京市石景山区2018届高三3月统一测试(一模)理综化学试题
北京市石景山区2018届高三3月统一测试(一模)理综化学试题安徽省淮北师范大学附属实验中学2018-2019学年高二下学期第二次月考化学试题山东省济宁市2018-2019学年高二期末模块检测化学试题江西省宜春市宜丰中学2020届高三上学期第一次月考化学试题北京市海淀区北京一零一中2019-2020学年高三上学期第五次统一练习化学试题山东省济南外国语学校2019-2020学年高二下学期3月份“空中课堂”阶段性测试化学试题天津滨海新区2020届高三4月份统考化学试题福建省建瓯市芝华中学2019-2020学年高二下学期居家学习检测化学试题江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题河南省新野县第一高级中学校2021-2022学年高一下学期第三次考试化学试题福建省厦门市同安第一中学2021-2022学年高一下学期第一次月考(3月)化学试题福建省三明第一中学2021-2022学年高一下学期期中考试化学试题(已下线)第五章 物质结构与性质元素周期律 第29练 化学键 分子的空间结构
单选题
|
较易(0.85)
解题方法
4. 在给定条件下,下列选项所示的物质间转化一步均能实现的是( )
A.NaCl(aq)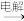 Cl2(g) Cl2(g)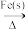 FeCl2(s) FeCl2(s) |
B.MgCl2(aq)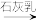 Mg(OH)2(s) Mg(OH)2(s)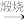 MgO(s) MgO(s) |
C.Fe Fe2(SO4)3(aq) Fe2(SO4)3(aq)  Fe(OH)3 Fe(OH)3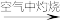 Fe2O3 Fe2O3 |
D.Fe2O3 FeCl3(aq) FeCl3(aq) Fe Fe |
【知识点】 物质的转化 铁 铁三角转化条件分析及判断解读
您最近一年使用:0次
单选题
|
容易(0.94)
名校
解题方法
5. 常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液中:NH 、H+、NO 、H+、NO 、SO 、SO |
B.使酚酞变红色的溶液中:Mg2+、Fe2+、NO 、Cl- 、Cl- |
| C.0.1 mol·L-1 FeCl3溶液中:K+、Na+、Br-、SCN- |
D.c(H+)=1×10-4 mol·L-1的溶液中:K+、Cu2+、Cl-、SO |
【知识点】 限定条件下的离子共存解读
您最近一年使用:0次
2020-05-21更新
|
289次组卷
|
4卷引用:江苏省泰州市2020届高三第二次模拟考试(5月) 化学试题
单选题
|
较易(0.85)
6. 短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
| A.原子半径:r(W)> r(Z)> r(Y)> r(X) |
| B.由X、Y组成的化合物是离子化合物 |
| C.Z的最高价氧化物对应水化物的酸性比W的强 |
| D.W的简单气态氢化物的热稳定性比X的强 |
您最近一年使用:0次
2019-06-10更新
|
9430次组卷
|
67卷引用:2019年江苏省高考化学试题
2019年江苏省高考化学试题(已下线)专题06 物质结构 元素周期律——2019年高考真题和模拟题化学分项汇编河南省南阳市第一中学2018-2019学年高一下学期第六次月考化学试题辽宁省阜新市第二高级中学2018-2019学年高二下学期期末考试化学试题(已下线)考点26 高三化学一轮成果检测卷B——《备战2020年高考精选考点专项突破题集》福建省福州一中2019—2020年高三上学期期末考试化学试题专题2.1 物质结构(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升第一章物质结构元素周期律 模拟高考河南省安阳市林州市第一中学2019-2020学年高一下学期2月月考化学试题广东省潮州市高级中学2020届高三下学期第一次网上模拟测试理科综合化学试题第1章 原子结构——C挑战区 模拟高考(鲁科版选修3)(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训云南省曲靖市会泽县第一中学2019-2020高二上学期开学考试化学试题江苏省东台中学、安丰中学2019-2020学年高一下学期期中联考化学试题西藏自治区拉萨市那曲第二高级中学2020届高三全真模拟联考理综化学试题宁夏吴忠中学2019-2020学年高一下学期期中考试化学试题江苏省震泽中学2019-2020学年高一下学期期中考试(杨班)化学试题河北省鸡泽县第一中学2019-2020学年高一下学期开学考试化学试题甘肃省靖远县第四中学2019-2020学年高一下学期期中考试化学(普通班)试题黑龙江省七台河市第一中学2019-2020学年高一下学期期末考试化学试题吉林省辽源市田家炳高级中学等友好学校2019-2020学年高二下学期期末考试化学试题浙江省金华十校2019-2020学年高二下学期期末调研考试化学试题云南省云天化中学高中联盟学校2019~2020学年高一下学期期末考试化学试题河南省南阳市第一中学2019-2020学年高一下学期期末考前模拟化学试题新疆呼图壁县第一中学2019-2020学年高一下学期期末考试化学试题黑龙江省哈尔滨市三中2020届高三第二次月考化学试题江苏省响水中学2020-2021学年高二上学期学情分析(一)化学试题四川省内江市第六中学2020-2021学年高二上学期开学考试化学试题上海交通大学附属中学2019-2020学年高二上学期期中考试化学试题江苏省淮安市涟水县第一中学2021届高三上学期10月月考化学试题四川省成都经济开发区实验中学2021届高三上学期10月月考理科综合化学试题江苏省徐州市沛县2020-2021学年高二上学期第一次学情调研化学(选修)试题(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)新疆哈密市第八中学2019-2020学年高二下学期期末考试化学试题专题5 第二单元综合拔高练-高中化学苏教2019版必修第一册(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记福建省南平市浦城县2020-2021学年高二下学期第一次月考化学试题四川省雅安中学2020-2021学年高二下学期期中考试理综化学试题内蒙古自治区通辽市科左中旗实验高级中学2020-2021学年高一下学期期末考试化学试题(已下线)课时26 元素周期表(律)及其应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)四川省眉山市彭山区第一中学2021-2022学年高二上学期入学考试化学试题宁夏银川市第六中学2021-2022学年高三上学期第一次月考(9月)化学试题(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-练习上海市进才中学2021-2022学年高二上学期期中考试化学试题(已下线)卷06 物质结构和元素周期律综合推断-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)四川省内江市第六中学2021-2022学年高一下学期第一次月考化学试卷江苏省徐州市沛县2021-2022学年高一下学期第一次学情调研化学试题四川省自贡市2021-2022学年高一下学期期末考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)广东省揭阳市普宁市华侨中学2021—2022学年高一下学期期中考试化学科试题广西百色民族高级中学2021-2022学年高二上学期9月月考化学试题宁夏回族自治区银川市北方民族大学附属中学2021-2022年高一下学期3月月考化学试题(已下线)专题07 元素周期律与元素周期表(练)-2023年高考化学二轮复习讲练测(新高考专用)云南省楚雄天人中学2022-2023学年高二上学期九月月考化学试题江苏省连云港市东海县2022-2023学年高二上学期期中考试化学试题(已下线)专题07 元素周期表与元素周期律江苏省南京市六校联合体2022-2023学年高一下学期期末联合调研化学试题(已下线)2019年高考江苏卷化学试题变式题(单选题6-10)江苏省南京市六校联合体2023-2024学年高二上学期期初调研测试化学试题江苏省连云港市锦屏高中、新浦高中等七校高二上学期期中考试化学试题江苏省泗阳县实验高级中学2023-2024学年高一上学期第二次调研测试化学试卷广东省茂名市高州中学2023-2024学年高一下学期期中考试化学试题
单选题
|
适中(0.65)
7. 化学与生产、实验密切相关。下列有关物质的性质与用途具有对应关系的是( )
| A.Al2O3具有两性,可用于电解冶炼铝。 |
| B.FeCl3溶液呈酸性,可用于腐蚀电路板上的Cu |
| C.热纯碱溶液碱性强,可用于去除油污 |
| D.NaHCO3受热易分解,可用于治疗胃酸过多 |
您最近一年使用:0次
单选题
|
适中(0.65)
8. 下列指定反应的离子方程式正确的是
| A.钠与水反应:Na +2H2O=Na++2OH–+H2↑ |
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O H2↑+Cl2↑+2OH– H2↑+Cl2↑+2OH– |
| C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O |
| D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O |
【知识点】 离子反应的发生及书写
您最近一年使用:0次
2017-08-08更新
|
2085次组卷
|
47卷引用:2017年全国普通高等学校招生统一考试化学(江苏卷精编版)
2017年全国普通高等学校招生统一考试化学(江苏卷精编版)福建省福州市第八中学2016-2017学年高一下学期期末考试化学试题宁夏六盘山高级中学2018届高三上学期第一次月考化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题04 离子方程式类选择题解题方法和策略重庆市第二中学2018届高三3月测试化学试题(已下线)《考前20天终极攻略》-5月20日 离子共存和离子方程式(已下线)解密04 离子反应——备战2018年高考化学之高频考点解密 张燕(已下线)学科网2019年高考化学一轮复习讲练测 2.2 离子反应 离子共存及检验 练【全国百强校】黑龙江省哈尔滨师范大学附属中学2019届高三上学期开学考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】山东省淄博市淄川中学2019届高三上学期10月月考化学试题河南省辉县市第一高级中学2019届高三上学期第二次月考化学试题山西省运城市临猗中学2019届高三上学期第一次月考化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (教学案)(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)(已下线)考点04 离子反应——备战2019年浙江新高考化学考点河北省大名县第一中学2018-2019学年高二(普通班)5月月考化学试题河北省邯郸市大名县第一中学2018-2019学年高二(清北班)5月月考化学试题(已下线)专题2.2 离子反应 离子共存及检验(练)-《2020年高考一轮复习讲练测》百所名校联考-化学物质及其变化云南省广南县第三中学2020届高三上学期开学考试化学试题四川省遂宁二中2020届高三上学期第二次月考化学试题甘肃省张掖市第二中学2019-2020学年高一上学期期中考试化学试题福建省平潭县新世纪学校2019-2020学年高一上学期第二次月考化学试题贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高三上学期期末考试化学试题云南省玉溪市峨山县一中2019-2020学年高三上学期1月月考理综化学化学新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题(已下线)专题五 离子反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题辽宁省沈阳东北育才中学2020年高中毕业班教学质量监测卷理科综合化学试题湖南省株洲市2020年高中毕业班教学质量监测卷理科综合化学试题四川省宜宾市第四中学2020届高三下学期第二次高考适应性考试理综化学试题(已下线)第4单元 氧化还原反应(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷安徽省安庆市宜秀区白泽湖中学2021届高三上学期入学考试化学试题山西省运城市永济涑北中学2020-2021学年高三上学期10月月考化学试题湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题福建省平潭县新世纪学校2020-2021学年高二上学期第一次月考化学试题(学考)江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题专题3 第二单元综合拔高练-高中化学苏教2019版必修第一册江苏省启东市吕四中学2020-2021学年高一下学期第二次月考化学试题云南省玉溪市民族中学2021-2022年高三下学期适应性考试卷(六) 化学试题云南省丽江市第一高级中学2021-2022学年高二下学期4月月考化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题 山东省济宁市兖州区2022-2023学年高一上学期期中考试化学试题北京市第二中学2022-2023学年高一下学期期末考试化学试题云南省丽江润泽高级中学2023-2024学年高一上学期10月月考化学试题
单选题
|
较易(0.85)
名校
解题方法
9. 肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是( )
| A.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+267kJ•mol-1 |
| B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ•mol-1 |
| C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJ•mol-1 |
| D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ•mol-1 |
【知识点】 化学反应热的计算 热化学方程式 热化学方程式书写及正误判断解读
您最近一年使用:0次
2020-12-17更新
|
103次组卷
|
3卷引用:江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题
单选题
|
较难(0.4)
名校
解题方法
10. 一种电化学“大气固碳”电池工作原理如图所示。该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法正确的是


| A.该电池放电时的正极反应为2Li-2e-+CO32-=Li2CO3 |
| B.该电池既可选用含水电解液,也可选无水电解液 |
| C.充电时阳极发生的反应为C+2Li2CO3-4e-=3CO2+4Li+ |
| D.该电池每放、充4 mol电子一次,理论上能固定1 mol CO2 |
您最近一年使用:0次
2020-06-03更新
|
819次组卷
|
5卷引用:江苏省镇江市2020届高三上学期期末考试化学试题
单选题
|
适中(0.65)
真题
名校
11. 氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
| A.一定温度下,反应2H2(g)+O2(g) =2H2O(g)能自发进行,该反应的ΔH<0 |
| B.氢氧燃料电池的负极反应为O2+2H2O+4e−=4OH− |
| C.常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023 |
| D.反应2H2(g)+O2(g) =2H2O(g)的ΔH可通过下式估算:∆H=反应中形成新共价键的键能之和-反应中断裂旧共价键的键能之和 |
您最近一年使用:0次
2019-06-10更新
|
5086次组卷
|
30卷引用:2019年江苏省高考化学试题
2019年江苏省高考化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编山西省祁县第二中学校2020届高三上学期期中考试化学试题陕西省渭南市临渭区尚德中学2020届高三上学期第三次月考化学试题陕西省西安中学2020届高三上学期第三次月考化学试题2019年秋高三化学复习强化练习——化学反应的方向及判断(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题(已下线)第六章能力提升检测卷-2021年高考化学一轮复习讲练测江苏省镇江市吕叔湘中学2019-2020学年高二下学期期中考试化学试题湖南省衡阳市第二十六中学2021届高三上学期9月月考化学试题江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)重庆市缙云教育联盟2020-2021学年高二上学期期末考试化学试题湖北省荆州中学2020-2021学年高二12月月考化学试题辽宁省沈阳市郊联体2021届高三上学期期末考试化学试题黑龙江省哈尔滨市呼兰区第一中学校等三校2020-2021学年高二上学期期末联考化学试题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记(已下线)【浙江新东方】高中化学20210304-003(已下线)【镇江新东方】高二下21心湖期中安徽省淮北市树人高级中学2020-2021学年高二上学期第四阶段考试化学试题(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)福建省厦门第一中学2020-2021学年高二上学期期中考试化学试题(已下线)2019年高考江苏卷化学试题变式题(不定项选择题)天津市武清区城关中学2023-2024学年高三上学期第二次阶段性练习化学试题重庆十八中两江实验中学校2022-2023学年高二上学期第一次月考化学试题
二、多选题 添加题型下试题
12. 下列判断正确的是( )

| A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线 |
| B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线 |
C.高温下能自发进行的反应CO2(g)+H2(g) CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0 CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0 |
D.图4可表示反应N2(g)+3H2(g) 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线 |
您最近一年使用:0次
2020-05-21更新
|
342次组卷
|
4卷引用:江苏省泰州市2020届高三第二次模拟考试(5月) 化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
13. 根据下列实验操作和现象所得出的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
| B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
| C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
| D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
| A.A | B.B | C.C | D.D |
【知识点】 溶度积常数与溶解度的关系解读 化学实验方案的设计与评价
您最近一年使用:0次
2018-06-10更新
|
8012次组卷
|
23卷引用:2018年全国普通高等学校招生统一考试化学(江苏卷)
2018年全国普通高等学校招生统一考试化学(江苏卷)(已下线)2018年高考题及模拟题汇编 专题11 化学实验基础江苏省盐城市田家炳中学2019届高三上学期开学考试化学试题陕西省城固县第一中学2019届高三上学期第一次月考化学试题辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题【全国百强校】江苏省启东市启东中学2019届高三上学期第一次月考化学试题江苏师范大学附属实验学校2019届高三上学期10月学情调研化学试题云南省腾冲市第八中学2018-2019学年高二下学期期中考试化学试题湖北省利川市第三中学2019届高三一模化学试题江西省宜春市万载中学2019-2020学年高二上学期期中考试化学试题(衔接班)江苏省启东市2020届高三上学期期中考试化学试题江苏省苏州市五校2020届高三12月月考化学试题四川省成都市实验中学2020届高三上学期第十八次周考理科综合化学试题新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题江苏省苏州新草桥中学2020届高三上学期10月月考化学试题江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2020年江苏卷化学高考真题变式题11-15(已下线)不定项选择题
四、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
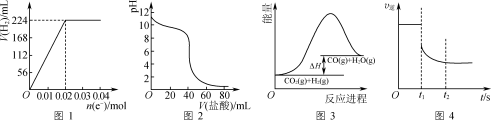
14. 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍能形成多种不同的化合物。图1是镍的一种配合物的结构,图2是一种镍的氧化物的晶胞。判断下列说法不正确的是( )

| A.图2可能表示的是氧化镍(NiO)的晶胞 |
| B.氧化镍中Ni2+、O2-的配位数都是6 |
| C.镍原子位于元素周期表中第4周期ⅧB族,属于ds区元素 |
| D.图1分子中存在的化学键有共价键、配位键、氢键 |
您最近一年使用:0次
2020-05-08更新
|
306次组卷
|
2卷引用:江苏省苏州市苏州中学园区校2019-2020学年高二下学期期初化学试题
五、单选题 添加题型下试题
单选题
|
适中(0.65)
15. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
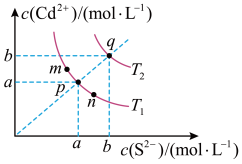

| A.图中a和b分别为T1、T2温度下CdS在水中的溶解度 |
| B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) |
| C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 |
| D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 |
您最近一年使用:0次
2019-06-09更新
|
18569次组卷
|
83卷引用:2019年全国统一考试化学试题(新课标Ⅱ)
2019年全国统一考试化学试题(新课标Ⅱ)(已下线)专题10 水溶液中的离子平衡——2019年高考真题和模拟题化学分项汇编安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题(已下线)专题8.4 难溶电解质的溶解平衡(讲)-《2020年高考一轮复习讲练测》(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》贵州省遵义市南白中学2019-2020学年高二上学期第三次月考化学试题(已下线)2019年12月31日《每日一题》 人教版(选修4)——沉淀的生成与溶解宁夏银川一中2019-2020学年高二上学期期末考试化学试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训西藏自治区林芝市第二高级中学2020届高三上学期第一次月考理科综合化学试题江苏省扬州中学2019-2020学年高二下学期4月月考化学试题四川省南充市白塔中学2019-2020学年高二下学期第二次月考化学试题四川省雅安中学2019-2020学年高二6月月考(期中)理综化学试题江西省九江市第一中学2019-2020学年高二下学期期末考试化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3章 综合检测鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测宁夏石嘴山市第三中学2021届高三上学期第一次月考化学试题人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)江西省南昌市新建一中2021届高三上学期第一次月考化学试题(已下线)第03章 水溶液中的离子反应与平衡(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关(已下线)第28讲 难溶电解质的溶解平衡 (精讲)——2021年高考化学一轮复习讲练测(已下线)3.4 难溶电解质的溶解平衡(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)陕西省咸阳市实验中学2020-2021学年高二上学期第四次月考化学试题四川省邻水实验学校2020-2021学年高二上学期第三阶段考试化学试题安徽省池州市第一中学2020-2021学年高二12月月考化学试题湖北省石首一中2020-2021学年高三上学期11月月考化学试题(已下线)专题12 水溶液中离子平衡(攻克各种图像问题)-2021年高考化学必做热点专题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题07 电解质溶液——备战2021年高考化学纠错笔记(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)黑龙江省哈尔滨市师大附中2020-2021学年高二上学期期末考试化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)选择性必修1(SJ)专题3专题培优专练广东省惠州市惠城区2021--2022学年高三上学期8月开学摸底化学试题(已下线)考点26 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)广东省珠海市第二中学2020-2021学年高二上学期10月月考化学试题(已下线)第24讲 沉淀溶解平衡(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题湖北省武汉市蔡甸区实验高级中学2020-2021学年高二上学期10月联合考试化学试题(已下线)第5讲 沉淀溶解平衡-【微专题·大素养】备战2022年高考化学核心突破(水溶液中的离子反应与平衡)重庆育才中学2021-2022学年高二上学期第四次定时练习化学试题(已下线)专题27 难溶电解质的溶解平衡(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)3.4.2 沉淀溶解平衡的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)四川省泸州市泸县第五中学2021-2022学年高二下学期开学考试化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习福建省福州第一中学2021-2022学年高二上学期期末考试化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点07 图像数据和结果的分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)回归教材重难点04 水溶液中的离子平衡-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题6 Ksp专练(已下线)专题10水溶液中的离子平衡-五年(2018~2022)高考真题汇编(全国卷)新疆喀什市普通高中2021-2022学年高三上学期期末考试化学试题(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)第三章 综合拔高练湖北省武汉市青山区2021-2022学年高二上学期期末考试化学试题(已下线)第24讲 沉淀溶解平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)河南省漯河市高级中学2022-2023学年高二上学期第二次月考化学试题(已下线)专题22 沉淀溶解平衡及图像分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省茂名市电白区2022-2023学年高二上学期期末考试化学(选择性考试)试题江西省新余市2022-2023学年高二上学期期末质量检测化学试题(已下线)第八章 水溶液中的离子反应与平衡 第53讲 沉淀溶解平衡图像的分析(已下线)题型142 有关沉淀溶解平衡图像宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题福建省福州格致中学2022-2023学年高二上学期期末考试化学试题(已下线)专题16 水溶液中的离子平衡云南省宣威市第三中学2022-2023学年高二下学期第三次月考化学试题(已下线)T12-难溶电解质的沉淀溶解平衡微专题(九)——沉淀溶解平衡曲线(已下线)第32讲难溶电解质的溶解平衡四川省南充市嘉陵第一中学2022-2023学年高二下学期5月期中考试化学试题福建省福清市虞阳中学2022-2023学年高二上学期期末考试化学试题甘肃省兰州第一中学2023-2024学年高二上学期1月期末化学试题陕西省宝鸡市渭滨区2023-2024学年高二上学期期末考试化学试题甘肃省平凉市第二中学2022-2023学年高二上学期期末考试(延考)化学试题
六、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
16. 以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
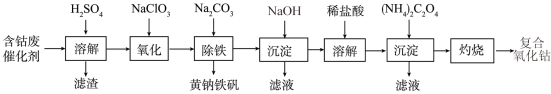
(1)用H2SO4溶解后过滤,得到的滤渣是____ (填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是_________________________________ 。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是__________ 。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3− =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4− = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是_________________________________ 。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)已知CoCl2的溶解度曲线如图所示。
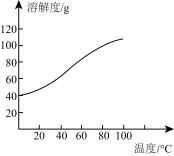
向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是_________________ 。

(1)用H2SO4溶解后过滤,得到的滤渣是
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3− =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4− = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是
(4)已知CoCl2的溶解度曲线如图所示。

向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
解题方法
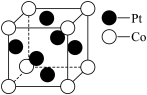
17. I、钴的合金及其配合物用途非常广泛。
(1)Co3+基态核外电子排布式为________ 。
(2)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为________ 。
(3) BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO 的空间构型为
的空间构型为________ (用文字描述)。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是________ (已知 的结构式为
的结构式为 )。
)。
③NaNT可由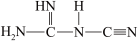 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为________ ,1 mol该分子中含σ键的数目为________ 。
II、研究表明,利用FeCl2、NH4H2PO4、Li2CO3和苯胺(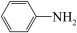 )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
)制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
(1) N、P、O三种元素的电负性由大到小的顺序为________ 。
(2)与 互为等电子体的一种分子为
互为等电子体的一种分子为________ (填化学式)。
(3)苯胺与甲苯的相对分子质量相近,但苯胺的沸点高于甲苯,其原因是__________________ 。
(1)Co3+基态核外电子排布式为
(2)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为

(3) BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO
 的空间构型为
的空间构型为②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是
 的结构式为
的结构式为 )。
)。③NaNT可由
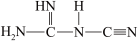 (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为II、研究表明,利用FeCl2、NH4H2PO4、Li2CO3和苯胺(
 )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
)制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。(1) N、P、O三种元素的电负性由大到小的顺序为
(2)与
 互为等电子体的一种分子为
互为等电子体的一种分子为(3)苯胺与甲苯的相对分子质量相近,但苯胺的沸点高于甲苯,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
18. I、NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=a kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=b kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=___________ kJ·mol−1.
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_________________________________ 。
II、电解Na2CO3溶液,原理如图所示。

阳极的电极反应式为_____________________ ,阴极产生的物质A的化学式____________ 。
III、已知:H2SO3 Ka1=1.54×10-2Ka2=1.02×10-7 HClO Ka=2.95×10-8 H2CO3 Ka1=4.4×10-7 Ka2=4.7×10-11
室温下,0.1 mol/L NaClO溶液的pH________ (填“大于”“小于”或“等于”)0.1 mol/L Na2SO3溶液的pH。
浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中, 、
、 、
、 、
、 浓度从大到小的顺序为
浓度从大到小的顺序为________________________________ 。
(1)用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=a kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=b kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:
II、电解Na2CO3溶液,原理如图所示。

阳极的电极反应式为
III、已知:H2SO3 Ka1=1.54×10-2Ka2=1.02×10-7 HClO Ka=2.95×10-8 H2CO3 Ka1=4.4×10-7 Ka2=4.7×10-11
室温下,0.1 mol/L NaClO溶液的pH
浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,
 、
、 、
、 、
、 浓度从大到小的顺序为
浓度从大到小的顺序为
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
19. 碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为_________________________ 。
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为______ 。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl0.1722g;③另取25.00mL溶液A,调节pH4~5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00mL。通过计算确定该样品的化学式(写出计算过程)__________ 。
(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为

(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl0.1722g;③另取25.00mL溶液A,调节pH4~5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00mL。通过计算确定该样品的化学式(写出计算过程)
您最近一年使用:0次
2017-08-08更新
|
3148次组卷
|
9卷引用:2017年全国普通高等学校招生统一考试化学(江苏卷精编版)
2017年全国普通高等学校招生统一考试化学(江苏卷精编版)河北省定州中学2018届高三(承智班)上学期第一次调研化学试题(已下线)《考前20天终极攻略》6月3日 专项三 化学计算(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第4讲 守恒思想在化学中的应用——守恒法解题技巧【教学案】(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第3讲 化学计算中常用的几种方法【教学案】河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题江苏省苏州市新草桥中学2019-2020学年高二下学期6月月考化学试题河北省秦皇岛市青龙县2022-2023学年高三上学期期中考试化学试题
试卷分析
整体难度:适中
考查范围:化学与STSE、有机化学基础、认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
试卷题型(共 19题)
题型
数量
单选题
13
多选题
2
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 大气污染 水污染 固体废弃物的处理 绿色化学与可持续发展 | |
| 2 | 0.85 | 分子的手性 | |
| 3 | 0.65 | 共价型分子结构式、电子式 原子的基本构成 化学键与物质类别关系的判断 配合物的概念、组成及形成条件 | |
| 4 | 0.85 | 物质的转化 铁 铁三角转化条件分析及判断 | |
| 5 | 0.94 | 限定条件下的离子共存 | |
| 6 | 0.85 | 元素非金属性强弱的比较方法 微粒半径大小的比较方法 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 7 | 0.65 | 碳酸氢钠的俗称、物理性质及用途 印刷电路板 盐类水解在生活、生产中的应用 | |
| 8 | 0.65 | 离子反应的发生及书写 | |
| 9 | 0.85 | 化学反应热的计算 热化学方程式 热化学方程式书写及正误判断 | |
| 10 | 0.4 | 原电池原理 新型电池 电解原理 | |
| 11 | 0.65 | 化学反应原理综合考查 根据△H=反应物的键能之和-生成物的键能之和进行计算 复合判据 氢氧燃料电池 | |
| 13 | 0.65 | 溶度积常数与溶解度的关系 化学实验方案的设计与评价 | |
| 15 | 0.65 | 沉淀溶解平衡的应用 溶度积 沉淀的溶解与生成 | |
| 二、多选题 | |||
| 12 | 0.65 | 化学反应速率与化学平衡的综合应用 复合判据 酸碱中和滴定 电解池电解基本判断 | |
| 14 | 0.65 | 元素周期表提供的元素信息 氢键概念及特征 根据晶胞结构确定晶体化学式 | |
| 三、解答题 | |||
| 16 | 0.65 | 氧化还原反应方程式的配平 亚铁盐 物质分离、提纯综合应用 常见阳离子的检验 | 工业流程题 |
| 17 | 0.65 | 物质结构与性质综合考查 杂化轨道理论 简单配合物的成键 根据晶胞结构确定晶体化学式 | 结构与性质 |
| 18 | 0.65 | 盖斯定律的应用 应用电离平衡分析生活中实例 盐类水解规律理解及应用 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |
| 19 | 0.4 | 氧化还原反应方程式的配平 常见无机物的制备 物质含量的测定 综合实验设计与评价 | 实验探究题 |