江苏省震泽中学2019-2020学年高一下学期期中考试(杨班)化学试题
江苏
高一
期中
2020-06-05
652次
整体难度:
容易
考查范围:
认识化学科学、物质结构与性质
一、单选题 添加题型下试题
A.中子数为18的氯原子: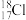 |
| B.N2的结构式:N=N |
C.Na+的结构示意图: |
D.H2O的电子式: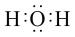 |
【知识点】 化学用语综合判断 原子核外电子的排布 核素 共价键与离子键的比较解读
| A.原子半径:r(W)> r(Z)> r(Y)> r(X) |
| B.由X、Y组成的化合物是离子化合物 |
| C.Z的最高价氧化物对应水化物的酸性比W的强 |
| D.W的简单气态氢化物的热稳定性比X的强 |
A.中子数为8的氮原子: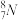 | B.HCl 的电子式: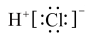 |
C.NH3的结构式: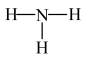 | D.Cl−的结构示意图: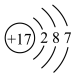 |
【知识点】 有关粒子结构的化学用语 核素 核外电子排布规律解读 共价键与离子键的比较解读
| A.原子半径:r(W) > r(Z) > r(Y) |
| B.由X、Y 组成的化合物中均不含共价键 |
| C.Y 的最高价氧化物的水化物的碱性比Z的弱 |
| D.X 的简单气态氢化物的热稳定性比W的强 |
【知识点】 元素周期律、元素周期表的推断
A.质量数为31的磷原子: |
B.氟原子的结构示意图: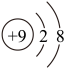 |
C.CaCl2的电子式: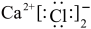 |
| D.明矾的化学式:Al2(SO4)3 |
| A.原子半径:r(X) < r(Y) < r(Z) < r(W) |
| B.W的最高价氧化物的水化物是一种弱碱 |
| C.Y的单质的氧化性比Z的强 |
| D.X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
【知识点】 “位构性”关系理解及应用解读
A.中子数为10的氧原子: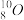 |
B.Mg2+的结构示意图: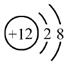 |
C.硫化钠的电子式: |
| D.甲酸甲酯的结构简式:C2H4O2 |
【知识点】 原子结构示意图、离子结构示意图解读 电子式的书写与判断解读
| A.元素X、W的简单阴离子具有相同的电子层结构 |
| B.由Y、Z两种元素组成的化合物是离子化合物 |
| C.W的简单气态氢化物的热稳定性比Y的强 |
| D.原子半径:r(X)<r(Y)<r(Z)<r(W) |
【知识点】 元素周期律、元素周期表的推断
A.质子数为17、中子数为20的氯原子: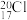 |
B.氯离子(Cl-)的结构示意图: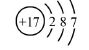 |
C.氯分子的电子式: |
| D.氯乙烯分子的结构简式:H3C-CH2Cl |
| A.原子最外层电子数由多到少的顺序:Y、X、W、Z |
| B.原子半径由大到小的顺序:W、Z、Y、X |
| C.元素非金属性由强到弱的顺序:Z、W、X |
| D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
| A.1s22s22p63s23p2→1s22s22p63s23p1 |
| B.1s22s22p63s23p3→1s22s22p63s23p2 |
| C.1s22s22p63s23p4→1s22s22p63s23p3 |
| D.1s22s22p63s23p63d104s24p2→1s22s22p63s23p63d104s24p1 |
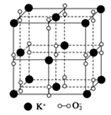
| A.K2O | B.K2O2 | C.K2O3 | D.KO2 |
【知识点】 根据晶胞结构确定晶体化学式解读 晶胞的有关计算解读
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高正化合价:④>③=②>① |
| A.水加热到很高的温度都难以分解 |
| B.水结成冰体积膨胀,密度变小 |
| C.HF、HCl、HBr、HI的热稳定性依次减弱 |
| D.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
【知识点】 分子间作用力解读 氢键对物质性质的影响解读
二、多选题 添加题型下试题
| A.氮气的化学性质比氧气稳定 |
| B.常温常压下,溴呈液体,碘为固体 |
| C.稀有气体一般很难发生化学反应 |
| D.金刚石的熔点非常高 |
| A.在24 g石墨中,含C-C共价键键数为3 mol |
| B.在12 g金刚石中,含C-C共价键键数为4 mol |
| C.在60 g二氧化硅中,含Si-O共价键键数为4 mol |
| D.在NaCl晶体中,与Na+最近且距离相等的Na+有6个 |
三、单选题 添加题型下试题
| A.熔点:CF4<CCl4<CBr4<Cl4 |
| B.硬度:金刚石>碳化硅>晶体硅 |
| C.晶格能:NaF>NaCl>NaBr>Nal |
| D.熔点:Na>Mg>Al |
| A.ns2np2和ns2np4 | B.ns2和ns2np4 | C.ns2和ns2np5 | D.ns1和ns2 |
【知识点】 根据原子结构进行元素种类推断解读 电子排布式解读
四、解答题 添加题型下试题

(2)请写出比元素1的原子序数大8的元素的基态原子电子排布式
(3)元素7的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。

若已知7的原子半径为d cm,NA代表阿伏加 德罗常数,7的相对原子质量为M,请回答:
①晶胞中7原子的配位数为
②该晶体的密度为
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的价层电子的轨道表示式为
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物沸点高低
(1)X的电子排布式为
(2)ZX2的分子式是
(3)Y与Z形成的化合物的分子式是
五、填空题 添加题型下试题
(1)Cu2+基态核外电子排布式为
(2)SO42-的空间构型为
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为

(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为
(1)SO42-中心原子轨道的杂化类型为
(2)Fe2+基态核外电子排布式为
(3)与O3分子互为等电子体的一种阴离子为
(4)(CN)2分子中σ键与π键的数目比n(σ)∶n(π)=
试卷分析
试卷题型(共 23题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 化学用语综合判断 原子核外电子的排布 核素 共价键与离子键的比较 | |
| 2 | 0.85 | 元素非金属性强弱的比较方法 微粒半径大小的比较方法 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 3 | 0.85 | 有关粒子结构的化学用语 核素 核外电子排布规律 共价键与离子键的比较 | |
| 4 | 0.85 | 元素周期律、元素周期表的推断 | |
| 5 | 0.94 | 有关粒子结构的化学用语 化学用语综合判断 原子结构示意图、离子结构示意图 | |
| 6 | 0.65 | “位构性”关系理解及应用 | |
| 7 | 0.65 | 原子结构示意图、离子结构示意图 电子式的书写与判断 | |
| 8 | 0.65 | 元素周期律、元素周期表的推断 | |
| 9 | 0.65 | 化学用语综合判断 原子结构示意图、离子结构示意图 有机物的结构式、结构简式、比例模型、球棍模型、最简式 共价型分子结构式、电子式 | |
| 10 | 0.85 | 元素金属性与非金属性递变规律的理解及应用 元素非金属性强弱的比较方法 微粒半径大小的比较方法 根据物质性质进行元素种类推断 | |
| 11 | 0.65 | 电离能变化规律 | |
| 12 | 0.65 | 根据晶胞结构确定晶体化学式 晶胞的有关计算 | |
| 13 | 0.65 | 微粒半径大小的比较方法 电子排布式 电离能 电负性 | |
| 14 | 0.65 | 分子间作用力 氢键对物质性质的影响 | |
| 17 | 0.65 | 原子晶体的物理性质 晶格能 | |
| 18 | 0.65 | 根据原子结构进行元素种类推断 电子排布式 | |
| 二、多选题 | |||
| 15 | 0.65 | 范德华力对物质性质的影响 键能、键长、键角及应用 化学键与分子间作用力 | |
| 16 | 0.65 | 常见原子晶体的结构 常见离子晶体的结构 | |
| 三、解答题 | |||
| 19 | 0.65 | 元素周期律、元素周期表的推断 核外电子排布的表示形式 电离能变化规律 晶胞的有关计算 | 结构与性质 |
| 20 | 0.65 | 氧化还原反应方程式的配平 元素周期律、元素周期表的推断 核外电子排布的表示形式 含有氢键的物质 | 无机推断题 |
| 21 | 0.85 | 共价型分子结构式、电子式 根据原子结构进行元素种类推断 电子排布式 轨道表示式 | 无机推断题 |
| 四、填空题 | |||
| 22 | 0.65 | 电子排布式 价层电子对互斥理论 杂化轨道理论理解 晶胞的有关计算 | |
| 23 | 0.65 | 共价键的形成及主要类型 等电子原理的应用 价层电子对互斥理论 利用杂化轨道理论判断化学键杂化类型 | |



