2016届陕西省西安市第七十中学高三上学期10月月考化学试卷
陕西
高三
阶段练习
2017-07-27
384次
整体难度:
适中
考查范围:
认识化学科学、物质结构与性质、常见无机物及其应用、化学实验基础、化学反应原理
2016届陕西省西安市第七十中学高三上学期10月月考化学试卷
陕西
高三
阶段练习
2017-07-27
384次
整体难度:
适中
考查范围:
认识化学科学、物质结构与性质、常见无机物及其应用、化学实验基础、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
真题
名校
1. 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.2.0gH218O与D2O的混合物中所含中子数为NA |
| B.常温常压下,4.4g乙醛所含σ键数目为0.7NA |
| C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
| D.50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
【知识点】 阿伏加德罗常数的求算解读 物质的量有关计算
您最近一年使用:0次
2019-01-30更新
|
3326次组卷
|
25卷引用:2015年全国普通高等学校招生统一考试化学(四川卷)
2015年全国普通高等学校招生统一考试化学(四川卷)2016届河南省扶沟县高级中学高三上学期开学考试化学试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2016届四川省攀枝花十二中高三下学期第一次月考化学试卷2015-2016学年湖南省长沙一中等三校高一下期末化学试卷2017届湖南省衡阳八中实验班高三上第一次质检化学试卷安徽省淮北市第一中学2016-2017学年高二下学期期中考试化学试题湖南省长沙市长郡中学2017届高三高考模拟卷(一)理综化学试题新疆呼图壁县第一中学2018届高三期初考试化学试题山西省原平市范亭中学2016-2017学年高二下学期期末考试化学试题福建省龙海市第二中学2019届高三年级上学期开学考化学试题苏教版必修1高考题单元试卷:专题1 化学家眼中的物质世界(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量(已下线)2019高考热点题型和提分秘籍 第一章 物质的量 第1讲 物质的量 气体摩尔体积 (教学案)(已下线)2019高考备考二轮复习精品资料-专题2 化学常用计量(教学案)河北省邯郸市大名县第一中学2018-2019学年高二(清北班)5月月考化学试题河南省南阳市第一中学2020届高三上学期第一次月考化学试题2020届高三高考化学总复习考点强化练习:从实验学化学(已下线)专题三 化学常用计量与阿伏加德罗常数(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训山西省忻州市第一中学2019-2020学年高二下学期期中考试化学试题吉林省长春市东北师大附中2020届高中毕业班四月份教学质量监测卷理科综合化学部分山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题(已下线)专题01 阿伏加德罗常数正误判断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)天津市西青区张家窝中学2021-2022学年高三下学期一模检测化学试题湖南省岳阳市岳阳县2021-2022学年高三上学期入学考试化学试题
单选题
|
适中(0.65)
2. 下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子: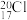 |
B.氯离子(Cl-)的结构示意图: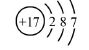 |
C.氯分子的电子式: |
| D.氯乙烯分子的结构简式:H3C-CH2Cl |
您最近一年使用:0次
2019-01-30更新
|
1521次组卷
|
28卷引用:2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)
2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷2016届江苏省东海县石榴高级中学高三上学期第一次月考化学试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2016届山东省临沂市高三上学期10月阶段性教学质检化学试卷吉林省辽源市田家炳高级中学2018届高三上学期期中考试化学试题(已下线)解密01 物质的组成、性质和分类 化学用语——备战2018年高考化学之高频考点解密苏教版必修1高考题单元试卷:专题1 化学家眼中的物质世界云南省广南一中2019届高三上学期10月月考化学试题(已下线)2019高考备考二轮复习精品资料-专题1 物质的组成、性质、分类与化学用语(教学案)江苏省苏州市第五中学2017-2018学年高一下学期选修期末考试化学试题2019年秋高三化学复习强化练习——化学用语上海市奉贤区2016年高考一模化学试题上海市闸北区2016届高三4月期中练习(二模)化学试题(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训安徽省马鞍山市2020届高考第二次模拟理综化学试题吉林省长春市东北师大附中2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分吉林省长春市东北师大附中2020届高中毕业班四月份教学质量监测卷理科综合化学部分天津市南开中学2020届高三教学质量监测理科综合化学部分河北省衡水中学2020届高三下学期二月份网络教学质量监测理科综合化学试题江苏省震泽中学2019-2020学年高一下学期期中考试(杨班)化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷陕西省榆林市第十二中学2021届高三上学期第二次月考化学试题上海市嘉定区2021届高三一模化学试题(已下线)重点3 化学用语-2021年高考化学专练【热点·重点·难点】云南省曲靖市第二中学2021-2022学年高二上学期开学收心检测化学试题福建省厦门第六中学2021-2022学年高二上学期开学适应性练习化学试题上海市宝山中学2022-2023学年高三上学期期中考试化学试题
单选题
|
较易(0.85)
3. 下列各组中两种微粒所含电子数不相等的是
| A.H3O+和OH- | B.CO和N2 | C.HNO2和NO2- | D.CH3+和NH4+ |
您最近一年使用:0次
2019-01-30更新
|
1475次组卷
|
20卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(上海卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(上海卷)(已下线)2013-2014江西省南昌市八一中学高二下学期期末考试化学试卷2014-2015学年吉林省长春市十一中高一下期中化学试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2015-2016学年河北省邢台一中高一下第一次月考化学试卷2015-2016学年江西省玉山一中高一下第一次月考化学试卷12015-2016学年广东省普宁一中高一下学期第二次月考化学试卷2015-2016学年河南省漯河高中高一下期末化学试卷2015-2016学年辽宁省实验中学高一下学期期末考试化学卷山东省潍坊市2016-2017学年高一下学期期中考试化学试题江西省玉山县第一中学2016-2017学年高一(19-31班)下学期期中考试化学试题山东省昌乐第一中学2017-2018学年高一下学期第一次月考化学试题山东省枣庄市第三中学2017-2018学年高一下学期期中考试化学试题四川省威远中学2017-2018学年高一下学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)【全国百强校】贵州省铜仁市第一中学2018-2019学年高一下学期期中考试化学试题【全国百强校】四川省雅安中学2018-2019学年高一下学期期中考试化学试题上海交通大学附属中学2018-2019学年高一下学期摸底化学试题福建省泉州第十六中学2019-2020学年高一下学期5月月考化学试题四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题
单选题
|
较易(0.85)
4. 下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是
①NaHCO3②(NH4)2SO3③Al2O3④Al(OH)3⑤Al ⑥NaAlO2
①NaHCO3②(NH4)2SO3③Al2O3④Al(OH)3⑤Al ⑥NaAlO2
| A.全部 | B.只有①③④⑤ |
| C.只有③④⑤⑥ | D.只有①②③④⑤ |
您最近一年使用:0次
2016-12-09更新
|
430次组卷
|
3卷引用:2016届陕西省西安市第七十中学高三上学期10月月考化学试卷
单选题
|
适中(0.65)
5. 原子序数依次增大的元素 、
、 、
、 、
、 ,它们的最外层电子数分别为1、6、7、1。
,它们的最外层电子数分别为1、6、7、1。 的电子层结构与氦相同,
的电子层结构与氦相同, 和
和 的次外层有8个电子,
的次外层有8个电子,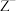 和
和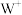 的电子层结构相同。下列叙述错误的是
的电子层结构相同。下列叙述错误的是
 、
、 、
、 、
、 ,它们的最外层电子数分别为1、6、7、1。
,它们的最外层电子数分别为1、6、7、1。 的电子层结构与氦相同,
的电子层结构与氦相同, 和
和 的次外层有8个电子,
的次外层有8个电子,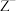 和
和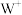 的电子层结构相同。下列叙述错误的是
的电子层结构相同。下列叙述错误的是A.元素的非金属性顺序为 |
B. 和其它3种元素均能形成离子化合物 和其它3种元素均能形成离子化合物 |
C. 和其它3种元素均能形成共价化合物 和其它3种元素均能形成共价化合物 |
D.元素 、 、 、 、 各自最高和最低化合价的代数和分别为0、4、6 各自最高和最低化合价的代数和分别为0、4、6 |
您最近一年使用:0次
2021-07-07更新
|
1881次组卷
|
52卷引用:2015年全国普通高等学校招生统一考试化学(新课标II卷)
2015年全国普通高等学校招生统一考试化学(新课标II卷)2014-2015学年吉林省实验中学高一下学期期末化学试卷2014-2015学年辽宁省沈阳二中高一下学期期末考试化学试卷2016届河北省衡水市冀州中学高三复习班上月考化学试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2015-2016学年安徽省屯溪一中高二上期中测试化学试卷2015-2016学年四川南山中学高二下3月入学考试化学试卷2015-2016学年广东省普宁市华侨中学高一下第一次月考化学试卷2015-2016学年江苏省淮阴中学高一下4月阶段测化学试卷2015-2016学年宁夏六盘山高中高一下期中化学试卷2015-2016学年四川省双流中学高一下期中化学试卷2015-2016学年安徽黄山屯溪一中高一下期中化学试卷2015-2016学年辽宁沈阳二中高二6月小班成果验收化学卷2015-2016学年福建省师大附中高一下期末化学试卷2015-2016学年江西省丰城九中高一下学期期末考试化学试卷2016-2017学年山东省实验中学高二上开学测化学试卷2016-2017学年河北武邑中学高二上12.4周考化学卷2016-2017学年江西省景德镇市第一中学高二(素质班)上学期期末考试化学试卷2016-2017学年黑龙江哈尔滨三中高一下学期第一次验收考试化学试卷广东省仲元中学2016-2017学年高一下学期期中考试(理)化学试题四川省眉山中学2016-2017学年高二下学期期中考试理综化学试题四川省树德中学2016-2017学年高二5月月考化学试题广西桂林市桂林中学2017届高三6月考前适应性模拟理科综合化学试题湖南省益阳市箴言中学2016-2017学年高一下学期期末化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.6 物质结构、元素周期表和元素周期律吉林省长春汽车经济开发区第六中学2017-2018学年高一下学期4月月考化学试题【全国百强校】四川省南充高级中学2017-2018学年高一下学期期中考试化学试题【全国百强校】广西陆川县中学2017-2018学年高二5月月考化学试题【全国百强校】重庆市巴蜀中学2017-2018学年高一下学期期末考试化学试题湖南省衡阳县2017-2018学年高一下学期期末考试化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)【全国百强校】河北省武邑中学2018-2019学年高一上学期12月月考化学试题【全国百强校】河南省洛阳市第一中学2018-2019学年高一下学期3月月考化学试题江西省宜春市上高二中2018-2019学年高一下学期第一次月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二下学期期中考试化学试题黑龙江省大庆十中2018-2019学年高一下学期第二次月考化学试题吉林省蛟河市一中2018-2019学年高一下学期第三次测试化学试题(已下线)2019年9月1日 《每日一题》2020年高考一轮复习-每周一测四川省成都市实验中学2020届高三上学期第十四次周考理科综合化学试题(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训湖南省双峰县第一中学2019-2020学年高一下学期入学考试化学试题陕西省咸阳市2020届高三高考模拟检测(二) 理综化学试题(二模)(已下线)专题06 物质结构 元素周期律-2020年高考真题和模拟题化学分项汇编(已下线)第04章 物质结构 元素周期律(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)云南省红河州弥勒市2019-2020学年高一下学期期末考试化学试题(已下线)易错07 元素周期律-备战2021年高考化学一轮复习易错题苏教版(2020)高一必修第一册专题5 总结检测人教版(2019)高一必修第一册 第四章素养检测(已下线)第17讲 原子结构 化学键(精练)-2021年高考化学一轮复习讲练测(已下线)第四章 单元过关检测--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)河南省洛阳市2020-2021学年高一下期期末考试化学试题山东省烟台市莱州第一中学2021-2022学年高二12月月考化学试题
单选题
|
较难(0.4)
6. 常温下,某未知溶液中c(H+)/c(OH-)=1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检验就能加以否定的离子是
| A.①③⑤ | B.②③④ | C.①②⑥ | D.④⑤⑥ |
【知识点】 离子共存 无附加条件的离子共存解读 物质共存解读 限定条件下的离子共存解读
您最近一年使用:0次
2016-12-09更新
|
424次组卷
|
6卷引用:2011-2012学年浙江省杭州第二中学高二下学期期中考试化学试卷
(已下线)2011-2012学年浙江省杭州第二中学高二下学期期中考试化学试卷(已下线)2014届海南省琼海市嘉积中学高三上学期教学质量监测化学试卷2014-2015重庆市重庆一中高二上学期期中化学(理)试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2015-2016浙江宁波效实中学高二上期中考试化学试题卷2016-2017学年湖南浏阳一中等两校高二12月联考化学卷
单选题
|
较易(0.85)
7. 短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是( )
| A.原子最外层电子数由多到少的顺序:Y、X、W、Z |
| B.原子半径由大到小的顺序:W、Z、Y、X |
| C.元素非金属性由强到弱的顺序:Z、W、X |
| D.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W |
您最近一年使用:0次
2020-02-15更新
|
728次组卷
|
35卷引用:2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)
2015年全国普通高等学校招生统一考试理科综合能力测试化学(江苏卷)2016届湖北省天门中学高三优录班8月月考化学试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2016届江苏省盐城市射阳二中高三上学期第二次调研化学试卷2015-2016学年海南文昌中学高一下期末考化学(理)试题2017届湖北省老河口市江山中学高三10月月考化学卷2015-2016学年青海省西宁市第五中学高一下学期期末(理)化学试卷甘肃省河西五市部分普通高中2017届高三下学期第二次联合考试化学试题2018版化学(苏教版)高考总复习专题五课时跟踪训练--元素周期律和元素周期表云南省中央民族大学附属中学芒市国际学校2016-2017学年高一下学期期末考试化学试题云南省楚雄州2016-2017学年高二下学期期末考试化学试题河南省林州一中分校(林虑中学)2017-2018学年高一下学期开学考试化学试题(已下线)狂刷05 元素周期表和元素周期律的应用—《小题狂刷》2017-2018学年高一化学人教必修2河南省林州一中分校(林虑中学)2017-2018学年高一4月调研考试化学试题江西省宁都中学2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)【全国百强校】河北省武邑中学2018-2019学年高一上学期12月月考化学试题江苏省苏州市第五中学2017-2018学年高一下学期选修期末考试化学试题(已下线)2019年4月9日 《每日一题》三轮复习——有关“位-构-性”的综合应用类试题福建省福州市2019—2020学年高三上学期9月调研考试化学试题(A)云南省通海三中2019-2020学年高一上学期期末考试化学试题黑龙江省大兴安岭漠河县第一中学2018-2019学年高一上学期期中考试化学试题人教版高一化学必修2同步练习:第一章第二节第二课时《元素周期律的应用》福建省厦门市思明区厦门外国语学校2019-2020学年高三上学期周末练习12——化学试题湖南省永州市第四中学2019-2020学年高一下学期3月月考化学试题(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训江苏省震泽中学2019-2020学年高一下学期期中考试(杨班)化学试题高一必修第一册(苏教2019)专题5 第一单元 元素周期律和元素周期表4江苏省苏州市西安交通大学苏州附属中学2020-2021学年高一上学期月考化学试卷2广东省惠来县第一中学2020-2021学年高一下学期第一阶段考试化学试题黑龙江绥化市第七中学校2020-2021学年高一下学期第二次月考化学试题广东省揭阳市惠来一中、揭东一中2016-2017学年高一下学期期末联考化学试题福建省福州市四校联考2021-2022学年高三上学期期中考试化学试题内蒙古通辽市科尔沁左翼中旗实验高级中学2021-2022学年高一下学期期中考试(A卷)化学试题2024届江苏省盐城市射射阳中学高三上学期三模化学试题
单选题
|
适中(0.65)
8. 下列关于物质或离子检验的叙述正确的是
| A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ |
| B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 |
| C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ |
| D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
您最近一年使用:0次
2019-01-30更新
|
4903次组卷
|
76卷引用:2015年全国普通高等学校招生统一考试化学(天津卷)
2015年全国普通高等学校招生统一考试化学(天津卷)2015—2016学年湖北省孝感高中高二上学期9月调研考试化学试卷2016届山西省忻州市第一中学高三上学期第一次月考化学试卷2016届湖南省浏阳第一中学高三上学期入学考试化学试卷2016届甘肃省天水市秦安县第二中学高三上第一次检测考试化学试卷2016届江苏省海门中学高三上学期9月学情调研化学试卷2016届湖南省长沙市明德中学高三上学期第三次月考化学试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2016届江西省高安市第二中学高三上学期第二次段考化学试卷2016届甘肃省张掖、嘉峪关、山丹部分高中高三上学期期中联考化学试卷2016届河南省三门峡市陕州中学高三上学期第二次月考化学试卷2015-2016学年河北省永年二中高一上学期12月月考化学试卷2015-2016学年云南省昆明三中高一上学期期末化学试卷2015-2016学年黑龙江大庆实验中学高一下开学测化学试卷2016届黑龙江省哈尔滨师大附中高三上开学考试化学试卷2016-2017学年山东省实验中学高二上开学测化学试卷2017届湖北省襄阳五中高三上学期9月月考化学试卷2017届河北省定州中学高三上期中化学试卷1吉林省吉林大学附属中学2017届高三第七次模拟考试理综化学试题湖南省岳阳县第一中学2018届高三上学期第一次月考化学试题河北省成安县第一中学2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习专题十对接高考精练--物质的分离、提纯与检验安徽省淮北市第一中学2017-2018学年高二上学期第一次月考化学试题安徽省淮北市第一中学2017-2018学年高一上学期第一次月考(开学考)化学试题河北省衡水市安平中学2017-2018学年高一上学期第三次月考化学试题2(已下线)2017-2018学年第一学期期末复习备考之精准复习模拟题高一化学(必修1)(A卷)(已下线)二轮复习 专题5 金属及其化合物 押题专练湖南省长沙市明德中学2016届高三上学期第三次月考化学试题(已下线)解密04 离子反应——备战2018年高考化学之高频考点解密 张燕(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第1讲 钠及其氧化物【教学案】(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【教学案】内蒙古自治区五原县第一中学2017-2018学年高二期末考试化学试题【全国百强校】山西省山西大学附属中学2019届高三上学期9月模块诊断化学试题福建省厦门市湖滨中学2019届高三上学期阶段测试(二)化学试题【全国百强校】广西壮族自治区河池市高级中学2019届高三上学期第二次月考化学试题【校级联考】天津市七校(静海一中,杨村中学,宝坻一中,大港一中等)2019届高三上学期期中联考化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第1讲 钠及化合物 (教学案)【校级联考】天津市静海区2019届高三上学期12月四校联考化学试题(已下线)2019高考备考二轮复习精品资料-专题5 金属及其化合物(押题专练)(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)黑龙江省伊春市第二中学2018-2019学年高一(理)上学期期末考试化学试题甘肃省武威第十八中学2018-2019学年高二下学期期末考试化学试题浙江省宁波三中2019-2020学年高二10月月考化学试题云南省曲靖市陆良县第八中学2019-2020学年高二上学期12月月考化学试题(已下线)专题五 离子反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训上海市长宁区2020届高三第二次模拟化学试题山东省济宁市泗水县2020届高三上学期期中考试化学试题广东省中山市中山纪念中学2020届高三第二次质量检测化学试题江西省宜春市上高二中2021届高三上学期第一次月考化学试题甘肃省天水市第一中学2021届高三上学期第一学段考试化学试题(已下线)【南昌新东方】1. 进贤二中 田荣达甘肃省白银市会宁县第四中学2021届高三上学期第二次月考化学试题贵州省思南中学2021届高三上学期期中考试化学试题山东省德州一中2021届高三10月月考化学试题陕西省西安中学2021届高三上学期期中考试化学试题宁夏固原市五原中学补习部2021届高三上学期期中考试化学试题湖北省利川市第五中学2021届高三上学期期中考试化学试题江西省鹰潭市第一中学2021届高三上学期期中考试化学试题天津市第三中学2021届高三上学期12月月考化学试题(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点30 物质的分离、提纯和检验-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时52 物质的分离、提纯和检验-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题3.1.3 铁盐与亚铁盐(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题黑龙江省鹤岗市第一中学2021-2022学年高二下学期6月月考化学试题(已下线)考点50 物质的分离、提纯和检验-备战2023年高考化学一轮复习考点帮(全国通用)吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题吉林省吉林市普通中学2022-2023学年高三上学期10月调研化学试题吉林省延边第二中学2022-2023学年高三上学期10月月考化学试题山东省滨州市沾化区实验高级中学2022-2023学年高三上学期第二次月考化学试题(已下线)江苏省南通市如皋市2022-2023学年高三上学期期末考试化学试题(已下线)第3讲 离子反应的应用(离子共存、离子检验和推断)(已下线)考点03 离子共存、离子的检验与推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆伊犁哈萨克自治州奎屯市第一高级中学2023-2024学年高三上学期9月月考化学试题天津市武清区杨村第一中学2023-2024学年高三上学期第一次学业质量检测 化学试题
单选题
|
适中(0.65)
真题
名校
9. X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法正确的是
| A.原子最外层电子数:X>Y>Z | B.单质沸点:X>Y>Z |
| C.离子半径:X2->Y+>Z- | D.原子序数:X>Y>Z |
您最近一年使用:0次
2016-12-09更新
|
6910次组卷
|
41卷引用:2014年全国普通高等学校招生统一考试理科综合能力测试化学(新课标I卷)
2014年全国普通高等学校招生统一考试理科综合能力测试化学(新课标I卷)(已下线)2015届山西省垣曲中学高三上学期第一次月考化学试卷2015届浙江省金华市艾青中学高三上学期期中化学试卷2014-2015广西桂林市第十八中学高一下学期期中考试化学试卷2016届吉林省长春市第十一高中高三上学期期中测试化学试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2016届山西省曲沃中学高三上学期11月阶段性测试化学试卷2015-2016学年湖南省岳阳市岳阳一中高一下3月月考化学试卷2015-2016学年湖北省沙市中学高二下学期期中化学试卷2016-2017学年山西省大同市第一中学高一3月月考化学试卷2016-2017学年山西省山西大学附属中学高一3月月考化学试卷2017届江西省崇义中学高三下学期第一次月考化学试卷2016-2017学年广西桂林第18中学高一下学期期中模拟化学试卷黑龙江省哈尔滨市第六中学2016-2017学年高一下学期期中考试化学试题云南省大理州南涧彝族自治县民族中学2016-2017学年高二下学期6月月考化学试题海南省文昌中学2016-2017学年高一下学期期末考试(理)化学试题2018版化学(苏教版)高考总复习专题五对接高考精练--元素周期律和元素周期表广东省深圳市福田外国语高级中学2017-2018学年高一下学期期中考试化学试题【全国百强校】广西南宁市第二中学2017-2018学年高一下学期期中考试(理)化学试题河北省衡水市景县梁集中学2017-2018学年高一下学期期中考试化学试题河北景县梁集中学2017-2018学年高一下学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题7 物质结构与元素周期律(教学案)【全国百强校】河北省武邑中学2018-2019学年高一上学期12月月考化学试题河北省邢台市第二中学2018-2019学年下学期高一第四次月考化学试题上海市高二上学期第二章《初识元素周期律》综合测试题上海市(长宁、宝山、嘉定、青浦)四区2016届高三4月质量调研测试(二模)化学试题(已下线)考点13 物质结构 元素周期律 化学键——《备战2020年高考精选考点专项突破题集》四川省三台县芦溪中学2018届高三上学期第一次月考理综化学试题(已下线)上海市行知中学2015届高三上学期第二次月考化学试题(已下线)上海市格致中学2015届高三上学期摸底考试化学试题新疆昌吉市教育共同体2019-2020学年高一下学期期中考试化学试题四川省内江市市中区天立学校2019-2020学年高一下学期第二次月考化学试题黑龙江省海林市朝鲜族中学2019-2020学年高一下学期期末考试化学试题(已下线)5.1.1 元素周期律练习(1)——《高中新教材同步备课》(苏教版 必修第一册)河北省衡水市阜城中学2020-2021学年高二上学期开学考试化学试题(已下线)专题讲座(五) “位-构-性”综合推断题的解题方法(精练)-2021年高考化学一轮复习讲练测(已下线)练习13 元素周期律-2020-2021学年【补习教材·寒假作业】高一化学(人教版)福建省莆田第二十五中学2020-2021学年高二下学期第一次月考化学试题江西省景德镇一中2020-2021学年高一下学期期中考试化学(2班)试题福建省莆田第四中学2019-2020学年高一下学期第一次线上考试化学试题福建省莆田第七中学2021-2022学年高二上学期期末考试化学试题
单选题
|
适中(0.64)
10. 下列装置能达到实验目的的是
A.验证碳酸的酸性强于硅酸 | B.分离苯和酒精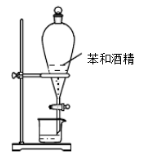 | C.制取少量氧气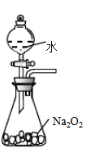 | D.收集少量二氧化氮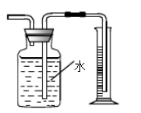 |
【知识点】 化学实验基础
您最近一年使用:0次
2015-11-24更新
|
136次组卷
|
4卷引用:2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷
二、未知 添加题型下试题
三、单选题 添加题型下试题
单选题
|
较难(0.4)
真题
名校
12. 某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是| A.m=2 |
| B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 |
| D.第二次平衡时,Z的浓度为0.4 mol·L-1 |
您最近一年使用:0次
2019-01-30更新
|
4011次组卷
|
53卷引用:2015年全国普通高等学校招生统一考试化学(天津卷)
2015年全国普通高等学校招生统一考试化学(天津卷)河北省衡水中学2015-2016学年高二上一调考试化学试卷2015-2016学年河北省衡水中学高二上学期调考化学试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2015-2016学年湖南省冷水江一中高二上学期期中(理)化学试卷2015-2016学年湖南常德石门第一中学高二上期中理化学卷2015-2016学年广东省宝安第一外国语学校高二上期中考试化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2015-2016学年浙江省东阳中学高二上学期12月阶段测化学试卷2015-2016学年山西省忻州一中高二下期中化学试卷2016届山西省平遥中学高三第二轮训练三化学试卷2016-2017学年河北省冀州中学高二上期中化学卷安徽师范大学附属中学2017-2018学年高二上学期10月月考化学试题重庆市巴蜀中学2017-2018学年高二10月月考化学试题甘肃省兰州第一中学2017-2018学年高二上学期期中考试化学(理)试题四川省成都树德中学2017-2018学年高二上学期12月月考化学试题北京师大附中2017-2018学年上学期高二年级期中考试化学试卷(已下线)二轮复习 专题9 化学反应速率与化学平衡 押题专练河南省安阳市林虑中学2017-2018学年高二下学期开学考试化学试题【全国百强校】内蒙古集宁一中(东校区)2017-2018学年高一下学期期末考试化学试题湖南省衡阳县第四中学2018-2019学年高二第一学期实验班9月月考化学试题【全国百强校】黑龙江省大庆实验中学2018-2019学年高二上学期10月月考化学试题吉林省长春市一五O中2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(押题专练)(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)【全国百强校】甘肃省天水一中2018-2019学年高二下学期寒假作业检测化学试题河南省南阳市2018-2019学年高二上学期期中质量评估化学试题陕西省西安中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.3 化学平衡常数 化学反应进行的方向(练)-《2020年高考一轮复习讲练测》(已下线)专题7.3 化学平衡常数 化学反应进行的方向(讲)-《2020年高考一轮复习讲练测》山西省朔州市怀仁一中2018-2019学年高二上学期第五次月考化学试题甘肃省武山一中2019-2020学年高二第一学期期中考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题2020届高三化学选修4二轮专题练——化学平衡常数的应用【精编23题】【懂做原理题】2020届高三化学选修4二轮专题练——浓度商及其应用【精编23题】贵州省荔波高级中学2019-2020学年高二上学期期末考试化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训陕西省咸阳市实验中学2019-2020学年高二上学期第三次月考化学试题湖南省长沙市雅礼中学2020届高三上学期第3次月考化学试题重庆市缙云教育联盟2020-2021学年高二上学期10月月考化学试题天津市耀华中学2020届高三下学期二月月考化学试题内蒙古自治区赤峰二中2020-2021学年高二上学期第一次月考化学试题(已下线)第24讲 化学平衡常数及转化率的计算 (精讲)——2021年高考化学一轮复习讲练测鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 易错疑难集训(一)安徽省黄山市屯溪第一中学2020-2021学年高二上学期期中考试化学试题湖南师范大学附属中学2019-2020学年高一下学期期末考试化学试题云南省富宁县一中2020-2021学年高二下学期第一次月考化学试题天津市南开中学2021-2022学年高二上学期期中检测化学试题(已下线)第七单元 化学反应速率与化学平衡(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)陕西省西安中学2021-2022学年高二上学期期中考试化学试题山西省长治市上党区第一中学校2021-2022学年高二上学期9月月考化学试题 天津市新华中学2022-2023学年高三上学期期末考试化学试题上海市实验学校2023届高三下学期3月月考化学试题
单选题
|
适中(0.64)
13. 下表中“实验操作”与“预期现象”对应关系正确的是
| 选项 | 实验操作 | 预期现象 |
| A | 向AlCl3溶液中滴入过量的氨水 | 先有白色沉淀,后沉淀消失 |
| B | 向AgCl浊液中滴入KI溶液,振荡 | 白色浑浊逐渐转化为黑色沉淀 |
| C | 向Ca(ClO)2溶液中通入CO2,再滴入少量品红溶液 | 出现浑浊,滴入的品红变无色 |
| D | 向BaCl2溶液中先通入SO2,再通入NO2 | 先有白色沉淀,后沉淀消失 |
| A.A | B.B | C.C | D.D |
【知识点】 化学实验基础
您最近一年使用:0次
单选题
|
适中(0.65)
14. 某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)
| A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=Cl-+ ClO-+ H2O |
B.该消毒液的pH约为12:ClO-+ H2O HClO+ OH- HClO+ OH- |
| C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O |
| D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+CH3COO— |
您最近一年使用:0次
2019-01-30更新
|
3492次组卷
|
46卷引用:2015年全国普通高等学校招生统一考试化学(北京卷)
2015年全国普通高等学校招生统一考试化学(北京卷)2016届河南省扶沟县高级中学高三上学期开学考试化学试卷2016届福建省福州市第八中学高三上学期第二次质量检测考试化学试卷2016届河南省三门峡市陕州中学高三上学期第一次精英对抗赛化学试卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2016届江西省南昌市第二中学高三上学期第三次考试化学试卷2016届江苏省盐城市射阳二中高三上学期第二次调研化学试卷2016届湖南省郴州市高三第一次教学质量监测化学试卷河南省周口市中英文学校2018届高三上学期开学摸底考试化学试题河南省三门峡市陕州区第一高级中学2018届高三上学期第一次月考化学试题青海省西宁市第二十一中学2018届高三10月月考化学试题(已下线)《考前20天终极攻略》-5月20日 离子共存和离子方程式(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氧及其化合物【教学案】(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (教学案)云南省昭通市威信县第一中学2018-2019学年高一上学期12月份考试化学试题(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(教学案)(已下线)2019高考备考二轮复习精品资料-专题4 离子反应(教学案)(已下线)考点04 离子反应——备战2019年浙江新高考化学考点【全国百强校】陕西省西安市长安区第一中学2018-2019学年高二(理)下学期寒假学情检测化学试题重庆市第三十中学2018-2019学年高二下学期期中考试化学试题河北省邯郸市大名县第一中学2018-2019学年高二(清北班)5月月考化学试题吉林省延边第二中学2018-2019学年高二下学期期末考试化学试题吉林省延边第二中学2019-2020学年高二上学期期中考化学(理)试题(已下线)考点06 典型的非金属元素及其化合物——《备战2020年高考精选考点专项突破题集》2020届高三化学总复习考点强化练习:非金属及其化合物(已下线)专题五 离子反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训江苏省扬州中学2019-2020学年高二下学期4月月考化学试题山东省济宁市泗水县2020届高三上学期期中考试化学试题人教版(2019)高一必修第一册 第二章 第二节课时1 氯气的性质吉林省长春市第五中学2021届高三上学期期中考试化学试题吉林松原市油田第十一中学2021届高三第二次阶段考试化学试题(已下线)第10周 周测卷-备战2022年高考化学周测与晚练(新高考专用)陕西省泾阳县2020-2021学年高三上学期期中考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第4节 离子反应北京市回民学校2022届高三下学期统测化学试题上海市格致中学2021-2022学年高三下学期模拟考试化学试题上海市格致中学2021-2022学年高三下学期模拟考试化学试题(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题20 新型含氯化合物的制备与性质探究(ClO2、NOCl等)-备战2023年高考化学一轮复习考点微专题(已下线)专题02 海水中的重要元素——钠和氯-2023年高考化学一轮复习小题多维练(全国通用)陕西省汉中中学2021-2022学年高二下学期5月月考化学试题江西省南昌市第八中学2022-2023学年高三上学期11月月考化学试题(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用作业(二十四) 离子反应的应用北京师范大学附属实验中学2023-2024学年高二上学期10月月考化学试题北京工业大学附属中学2022-2023学年高三上学期开学测试化学试题
单选题
|
较易(0.85)
名校
15. 为了使宇航员在飞船中得到一个稳定的,良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 ( )
| A.Na2O2中阴、阳离子的个数比为1∶1 |
| B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 |
| C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 |
| D.Na2O2的漂白原理与SO2的漂白原理相同 |
【知识点】 过氧化钠
您最近一年使用:0次
2016-12-09更新
|
352次组卷
|
13卷引用:2016届陕西省西安市第七十中学高三上学期10月月考化学试卷
2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2016届宁夏长庆高级中学高三上学期第三次月考理综化学试卷2016届江苏省清江中学高三下冲刺模拟四化学试卷2017届河北省涞水县波峰中学高三8月月考化学试卷2017届北京市中央民族大学附中高三上9.12周练化学卷河北省鸡泽县第一中学2016-2017学年高二下学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第1讲 钠及其氧化物【押题专练】【全国百强校】甘肃省静宁县第一中学2019届高三上学期第一次模拟考试化学试题海南省桥中三亚学校2019届高三上学期第二次月考化学试题贵州省习水县一中2019届高三上学期12月份考试理科综合化学试题吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题上海市控江中学2020-2021学年高二下学期等级班期中考试化学试题
单选题
|
较易(0.85)
名校
解题方法
16. 已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Fe2+<H2O2<I-<SO2,则下列反应不能发生的是
A.2Fe3++SO2+2H2O=2Fe2++ +4H+ +4H+ |
| B.H2O2+H2SO4=SO2↑+O2↑+2H2O |
| C.I2+SO2+2H2O=H2SO4+2HI |
| D.2Fe3++H2O2=2Fe2++O2↑+2H+ |
【知识点】 离子方程式的正误判断解读 氧化还原反应的规律解读
您最近一年使用:0次
2021-10-19更新
|
527次组卷
|
30卷引用:2016届陕西省西安市第七十中学高三上学期10月月考化学试卷
2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2018版化学(苏教版)高考总复习课时跟踪训练:氧化还原反应基础(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】福建省厦门市湖滨中学2019届高三上学期第一次阶段检测化学试题【全国百强校】山东省枣庄市第八中学东校区2019届高三9月月考化学试题陕西省渭南市尚德中学2019届高三上学期第一次教学质量检测化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (题型专练)广东省惠州市第一中学2018-2019学年高一下学期分班考试化学试题步步为赢 高二化学暑假作业:作业三 氧化还原反应辽宁省实验中学2019-2020学年高一上学期期中考试化学试题辽宁省朝阳市凌源三中2019-2020学年高一上学期第二次月考化学试题山东省滨州市邹平双语学校2019年高一上学期《氧化还原专题》检测(已下线)上海市六校2013届高三3月模拟考试化学试题天津市南开中学2019-2020学年高一上学期期末考试化学试题(已下线)专题2.3 氧化还原反应 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》陕西省吴起高级中学2019-2020学年高二下学期第一次质量检测化学试题(已下线)1.3.3 氧化还原反应的规律及应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)辽宁省沈阳市郊联体2020-2021学年高一上学期期中考试化学试题(已下线)练习2 氧化还原反应-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)湖南省常德市第一中学2020-2021学年高一上学期第2次月考化学试题黑龙江省嫩江市高级中学2020-2021学年高一上学期期中考试化学试题甘肃省天水市田家炳中学2021-2022学年高三上学期第一阶段考试化学试题吉林省长春市十一高中2021-2022学年高一上学期第一学程考试化学试题黑龙江省鸡西市第一中学2021-2022学年高一上学期期中考试化学试题河北省衡水市武强中学2021-2022学年高一上学期第三次月考化学试题宁夏固原市第一中学2023届高三上学期第一次月考化学试题云南省昭通市盐津县第三中学2021-2022学年高一上学期12月考试化学试题新疆昌吉州行知学校2021-2022学年高一上学期期中考试化学试题甘肃省武威市民勤县2022-2023学年高一上学期10月月考化学试题云南省玉溪市玉溪市二中2022-2023年高一上学期期中考试化学试题
四、解答题 添加题型下试题
解答题-无机推断题
|
困难(0.15)
17. X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)_______________________ 。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)____________________ 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A B (在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:
B (在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:________ ;D的电子式:________ 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为________________ ;由A转化为B的离子方程式为______________________ 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:_________________________________ 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是_________________ ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有___________ 。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A
 B (在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:
B (在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:
您最近一年使用:0次
2019-01-30更新
|
2073次组卷
|
6卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷)
2013年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷)(已下线)2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(已下线)2014届高考化学二轮复习必做训练 物质结构、元素周期律练习卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷四川省广安市第二中学2019届高三上学期第一次月考化学试题百所名校联考-物质结构 元素周期律
解答题-工业流程题
|
适中(0.65)
名校
解题方法
18. 用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ. 向铝灰中加入过量稀H2SO4,过滤;
Ⅱ. 向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ. 加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ. 加入MnSO4至紫红色消失,过滤;
Ⅴ. 加热浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是__________________ 。
(2)KMnO4氧化Fe2+的离子方程式补充完整:_________________

(3)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的_______________ ;
(4)已知:一定条件下, MnO4-可与Mn2+反应生成MnO2,
MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是____________ 。
②Ⅳ中加入MnSO4的目的是_____________________ 。
Ⅰ. 向铝灰中加入过量稀H2SO4,过滤;
Ⅱ. 向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ. 加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ. 加入MnSO4至紫红色消失,过滤;
Ⅴ. 加热浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是
(2)KMnO4氧化Fe2+的离子方程式补充完整:

(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的
(4)已知:一定条件下,
 MnO4-可与Mn2+反应生成MnO2,
MnO4-可与Mn2+反应生成MnO2,①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是
②Ⅳ中加入MnSO4的目的是
您最近一年使用:0次
2016-12-09更新
|
826次组卷
|
4卷引用:2014-2015学年黑龙江省齐齐哈尔市实验中学高二下学期期末化学试卷
五、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
19. 消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________ (填序号)。
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为______________ ,H2O2被称为“绿色氧化剂”的理由是______________________ 。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________ 。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_____________ (用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________ 。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是
| A.Cl2 | B.H2O2 |
| C.ClO2 | D.O3 |
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是
【知识点】 氧化还原反应的应用 氧化还原反应有关计算 氯气 漂白粉和漂粉精
您最近一年使用:0次
2016-12-09更新
|
1296次组卷
|
12卷引用:2014年高考化学一轮复习课后规范训练2-3练习卷
(已下线)2014年高考化学一轮复习课后规范训练2-3练习卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2017届江西省铅山一中、横峰中学高三上学期暑假联考化学试卷2016-2017学年安徽省六安市第一中学高一下学期第一次阶段检测化学试卷云南省澄江县第一中学2019届高三9月月考理科综合化学试题云南省漾濞二中2020届高三上学期开学考试化学试题江西省南昌市第十中学2020届高三上学期期中考试化学试题云南省广南县二中2019-2020学年高三上学期期末考试化学试题山西省忻州市第一中学高一化学下学期(远程)目标检测(4)化学试题(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测江西省丰城市第九中学2020届高三上学期期中考试化学试题安徽省定远县育才学校2021届高三上学期第二次月考化学试题
填空题
|
适中(0.64)
真题
名校
20. X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1) Y在元素周期表中的位置为_______ 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______ (写化学式),非金属气态氢化物还原性最强的是_______ (写化学式)。
(3) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______ (写出其中两种物质的化学式)。
(4) X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧反应的热化学方程式:_______ 。
(5)ZX的电子式为_______ ;ZX与水反应放出气体的化学方程式为_______ 。
(6) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如图),反应原理为:2Z+ FeG2 Fe+2ZG;放电时,电池的正极反应式为
Fe+2ZG;放电时,电池的正极反应式为_______ :充电时,_______ (写物质名称)电极接电源的负极;该电池的电解质为_______ 。

请回答下列问题:
(1) Y在元素周期表中的位置为
(2)上述元素的最高价氧化物对应的水化物酸性最强的是
(3) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有
(4) X2M的燃烧热ΔH= -a kJ·mol-1,写出X2M燃烧反应的热化学方程式:
(5)ZX的电子式为
(6) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如图),反应原理为:2Z+ FeG2
 Fe+2ZG;放电时,电池的正极反应式为
Fe+2ZG;放电时,电池的正极反应式为
【知识点】 元素周期表 元素周期律
您最近一年使用:0次
2019-01-30更新
|
1162次组卷
|
4卷引用:2012年普通高等学校招生全国统一考试理综化学部分(天津卷)
试卷分析
整体难度:适中
考查范围:认识化学科学、物质结构与性质、常见无机物及其应用、化学实验基础、化学反应原理
试卷题型(共 20题)
题型
数量
单选题
15
未知
1
解答题
2
填空题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 阿伏加德罗常数的求算 物质的量有关计算 | |
| 2 | 0.65 | 化学用语综合判断 原子结构示意图、离子结构示意图 有机物的结构式、结构简式、比例模型、球棍模型、最简式 共价型分子结构式、电子式 | |
| 3 | 0.85 | 结合物质结构基础知识与NA相关推算 原子中相关数值及其之间的相互关系 具有相同结构的多种离子的性质相关分析及判断 | |
| 4 | 0.85 | 氢氧化铝 其他含铝化合物 | |
| 5 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 化学键与物质类别关系的判断 | |
| 6 | 0.4 | 离子共存 无附加条件的离子共存 物质共存 限定条件下的离子共存 | |
| 7 | 0.85 | 元素金属性与非金属性递变规律的理解及应用 元素非金属性强弱的比较方法 微粒半径大小的比较方法 根据物质性质进行元素种类推断 | |
| 8 | 0.65 | 焰色试验 Fe3+的检验 物质的检验 | |
| 9 | 0.65 | 元素周期律、元素周期表的推断 微粒半径大小的比较方法 原子核外电子的排布 | |
| 10 | 0.64 | 化学实验基础 | |
| 12 | 0.4 | 等效平衡理论的综合应用 化学平衡常数的影响因素及应用 | |
| 13 | 0.64 | 化学实验基础 | |
| 14 | 0.65 | 次氯酸及其性质 漂白粉和漂粉精 氯气与碱溶液反应 漂白粉和漂粉精的制备原理 | |
| 15 | 0.85 | 过氧化钠 | |
| 16 | 0.85 | 离子方程式的正误判断 氧化还原反应的规律 | |
| 二、未知 | |||
| 11 | 0.85 | 蒸馏与分馏 | 未知 |
| 三、解答题 | |||
| 17 | 0.15 | 共价型分子结构式、电子式 盐溶液中离子浓度大小的比较 元素周期律、元素周期表的推断 微粒半径大小的比较方法 | 无机推断题 |
| 18 | 0.65 | 离子方程式的书写 有关铁及其化合物转化的流程题型 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 四、填空题 | |||
| 19 | 0.65 | 氧化还原反应的应用 氧化还原反应有关计算 氯气 漂白粉和漂粉精 | |
| 20 | 0.64 | 元素周期表 元素周期律 | |



