云南省澄江县第一中学2019届高三9月月考理科综合化学试题
云南
高三
阶段练习
2018-09-30
404次
整体难度:
适中
考查范围:
认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用
云南省澄江县第一中学2019届高三9月月考理科综合化学试题
云南
高三
阶段练习
2018-09-30
404次
整体难度:
适中
考查范围:
认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
适中(0.64)
名校
1. 常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:K+、Fe2+、MnO4-、SO42- |
| B.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.与铝反应生成氢气的溶液中:NH4+、K+、Cl-、SiO32- |
【知识点】 离子共存
您最近一年使用:0次
2016-12-09更新
|
211次组卷
|
6卷引用:2014届北京市东城区高三上学期期末统一练习化学试卷
单选题
|
适中(0.65)
名校
2. 安全气囊碰撞时发生反应:10NaN3+2KNO3===K2O+5Na2O+16N2↑,下列判断正确的是
| A.每生成16 mol N2转移30 mol电子 |
| B.NaN3中N元素被还原 |
| C.N2既是氧化剂又是还原剂 |
| D.还原产物与氧化产物质量之比为1∶15 |
【知识点】 氧化还原反应基本概念
您最近一年使用:0次
2016-12-09更新
|
648次组卷
|
13卷引用:2014-2015福建省厦门市高三上学期期末质量检查化学试卷
2014-2015福建省厦门市高三上学期期末质量检查化学试卷2016届湖南省师范大学附属中学高三上月考化学试卷云南省澄江县第一中学2019届高三9月月考理科综合化学试题广东省佛山一中、石门中学、顺德一中、国华纪中四校2018-2019学年高一下学期期末联考化学试题山东省济宁市鱼台县第一中学2020届高三上学期期中考试化学试题湖北省黄冈市浠水县实验高级中学2020届高三8月月考化学试题江西省抚州市金溪县第一中学2020-2021学年高二上学期入学考试化学试题福建省莆田二中、泉州一中、南安一中三校2020-2021学年高三下学期联考化学试题云南省景东彝族自治县第一中学2021-2022学年高三下学期3月份考试化学试题江西省抚州市金溪县第一中学2021-2022学年高二下学期开学考试化学试题山东省青岛第一中学2022-2023学年高一上学期期中考试化学试题山东省新泰市第一中学2022—2023学年高一上学期期中考试化学试题福建省三明第一中学2023-2024学年高一上学期期中考试化学试题
单选题
|
较易(0.85)
名校
3. 在水溶液中能大量共存的一组离子是
| A.H+、Na+、SO42-、SiO32- |
| B.Ba2+、Al3+、Cl-、SO42- |
| C.K+、Mg2+、SO42-、NO3- |
| D.H+、Fe2+、ClO-、NO3- |
【知识点】 离子反应的发生条件解读 无附加条件的离子共存解读
您最近一年使用:0次
2018-09-30更新
|
121次组卷
|
3卷引用:2014届广东省江门市高三调研测试理综化学试卷
单选题
|
较易(0.85)
名校
4. 在pH=1的溶液中能大量共存的一组离子或分子是
| A.Na+、Mg2+、ClO—、NO3— | B.Al3+、 NH4+、 Br-、Cl- |
| C.K+、Cr2O72-、CH3CHO、 SO42- | D.Na+、K+、SiO32-、Cl- |
【知识点】 离子反应的发生条件解读 限定条件下的离子共存解读
您最近一年使用:0次
2018-09-30更新
|
85次组卷
|
3卷引用:2011届广东省高三全真高考模拟(四)(理综)化学部分
单选题
|
较易(0.85)
5. 已知在碱性溶液中可发生如下反应:
2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是()
2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是()
| A.+3 | B.+4 | C.+5 | D.+6 |
【知识点】 离子反应的发生及书写
您最近一年使用:0次
2019-01-30更新
|
6406次组卷
|
174卷引用:2015年全国普通高等学校招生统一考试理科综合能力测试化学(海南卷)
2015年全国普通高等学校招生统一考试理科综合能力测试化学(海南卷)2016届山东省枣庄市第二中学高三9月阶段性学情检测化学试题2016届山西省忻州市第一中学高三上学期第一次月考化学试卷2016届浙江省建人高复学校高三上学期第一次月考化学试卷12016届江苏省东海县石榴高级中学高三上学期第一次月考化学试卷2016届宁夏六盘山高级中学高三上学期期中考试化学试卷2016届江苏省淮安市四星级高中高三上学期10月阶段测化学试卷2016届吉林省东北师范大学附属中学高三上第三次模拟化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测一化学试卷2015-2016学年山东省郯城县第一中学高一上学期12月月考化学试卷2015-2016学年内蒙古巴彦淖尔一中高一上期末化学试卷22016届湖南省湘阴县高三上学期第一次联考化学试卷2016届浙江省建人高复学校高三上学期第一次月考化学试卷22017届河北武邑中学高三上学期周考(8.14)化学试题2016届黑龙江省哈尔滨师大附中高三上开学考试化学试卷2017届内蒙古杭锦后旗奋斗中学高三上第一次月考化学试卷2016-2017学年辽宁省六校协作体高一上期中化学试卷2016-2017学年山西省大同一中高一12月月考化学试卷2016-2017学年山东省师大附中高一上期中化学试卷四川省遂宁市2016-2017学年高一上学期教学水平监测化学试题黑龙江省双鸭山市第一中学2016-2017学年高二下学期期末考试化学试题2018版化学(苏教版)高考总复习对接高考精练--氧化还原反应基础山东省枣庄市第三中学2018届高三10月质量检测化学试题新疆石河子第二中学2018届高三上学期第一次月考化学试题天津市和平区2017-2018学年高一上学期期中质量调查化学试题广东省佛山市第一中学2017-2018学年高一上学期期中考试化学试题天津市静海县第一中学、杨村一中、宝坻一中等六校2017-2018学年高一上学期期中联考化学试题山西省康杰中学2017-2018学年高一上学期期中考试化学试题江苏省泰州中学2017-2018学年高一上学期期中考试化学试题新疆维吾尔自治区阿克苏市农一师高级中学2017-2018学年高一第二次月考化学试卷河南省鹤壁市淇滨高级中学2017-2018学年高一上学期第三次月考化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高一12月月考化学试题(A卷)内蒙古巴彦淖尔市第一中学2017-2018学年高一12月月考化学试题(B卷)河北省冀州市中学2017-2018学年高一上学期分班后第一次月考化学试题浙江省诸暨市牌头中学2017-2018学年高一上学期期中考试化学(B卷)试题吉林省扶余市第一中学2017-2018学年高一上学期期末考试化学试题(已下线)二轮复习 专题3 氧化还原反应 押题专练黑龙江省双鸭山市2016-2017学年高二化学下学期期末考试试题(已下线)学科网2019年高考化学一轮复习讲练测2.4 氧化还原反应的规律及应用 练(已下线)2019高考备考一轮复习精品资料 第一章 从实验学化学 第2讲 物质的量浓度及一定物质的量浓度溶液的配制(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】云南省澄江县第一中学2019届高三9月月考理科综合化学试题【全国百强校】黑龙江省双鸭山市第一中学2019届高三上学期第一次月考化学试题河南省西华县第一高级中学2017-2018学年高一上学期期末考试化学试题江西省上饶二中2018-2019学年高一上学期期中考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一上学期第二次月考化学试题【全国百强校】河北省武邑中学2018-2019学年高一上学期第三次月考化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)(已下线)2019高考热点题型和提分秘籍 第一章 物质的量 第2讲 物质的量在化学实验中的应用( 教学案)湖北省随州一中2018-2019学年高一上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(押题专练)【校级联考】福建省八县(市)一中2018-2019学年高一上学期期末考试化学试题河北省辛集一中2018-2019学年高二下学期返校考试化学试题广东省湛江市2018-2019学年高一化学(人教版)第一学期期末调研化学试题河北省邯郸市大名县第一中学2018-2019学年高二(清北班)5月月考化学试题福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题黑龙江省伊春市第二中学2018届高三上学期期中考试化学试题山东省禹城市综合高中2017-2018学年高一上学期期中考试化学试题1山东省禹城市综合高中2017-2018学年高一上学期期中考试化学试题2黑龙江省龙东南联合体2018-2019学年高二下学期期末考试化学试题黑龙江省哈尔滨市呼兰区第一中学2020届高三上学期第一次(9月)月考化学试题福建省平潭县新世纪学校2020届高三上学期第一次月考化学试题海南省定安县定安中学2020届高三上学期第二次月考化学试题新疆乌什县阿克托海乡中学2019届高三年级四月调研考试理综化学试题山东省淄博市第一中学2019-2020学年高一上学期期中考试化学试题江西省南昌市八一中学、洪都中学、十七中、实验中学、南师附中五校2019-2020学年高一上学期期中联考化学试题广东省中山市第一中学2019-2020学年高一上学期第二次段考化学试题湖南省张家界市慈利县2019-2020学年高一上学期期中考试化学试题甘肃省静宁县第一中学2019-2020学年高一上学期期中考试化学试题福建省莆田市第十一中学2019-2020学年高三上学期期中考试化学试题云南省玉溪市新平彝族傣族自治县第三中学2019-2020学年高一上学期期中考试化学试题湖北省黄冈市罗田县2019-2020学年高一上学期期中考试化学试题云南省玉溪市新平三中2019-2020学年高一上学期12月月考化学试题宁夏回族自治区吴忠市青铜峡市高级中学2019-2020学年高一上学期第二次月考化学试题步步为赢 高一化学寒假作业:作业六 氧化还原反应江西省南昌市新建区第一中学2019-2020学年高一上学期第二次月考(共建部)化学试题陕西省西安中学2019-2020学年高一12月月考化学试题山东省德州市夏津县双语中学2019-2020学年高一12月月考化学试题吉林省长春市榆树市2019-2020学年高一上学期期末考试化学试题重庆市第三十中学2019-2020学年高一10月月考化学试题云南省华宁二中2019-2020学年高一上学期期末考试化学试题云南省麻栗坡民族中学2019-2020学年高一上学期期末考试化学试题云南省开远市第二中学校2019-2020学年高一上学期期末考试化学试题福建省永泰县第一中学2019-2020学年高一上学期期末考试化学试题云南省昆明市禄劝县第一中学2019-2020学年高一上学期期中考试化学试题人教版高中化学必修1第二章《化学物质及其变化》测试卷2人教版高中化学必修1第二章《化学物质及其变化》测试卷5贵州省正安县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)【南昌新东方】2019 新建二中 高一上期中湖北省天门市2019-2020学年高一上学期11月考试化学试题湖南省长沙市长郡中学2020届高三4月份教学质量监测理综化学试题(已下线)【南昌新东方】2019-2020 八一、洪都、南师附中 高一(上)期中联考 002陕西省榆林市绥德县绥德中学2019-2020学年高一下学期第二次阶段检测化学试题山西省晋中市祁县第二中学2019-2020学年高二下学期期末考试化学试题苏教版(2020)高一必修第一册专题3 总结检测人教版(2019)高一必修第一册第一章 物质及其变化 高考挑战区鲁科版(2019)高一必修第一册第二章C 高考挑战区 过模拟 2年模拟精编精练福建省泰宁第一中学2018-2019学年高一上学期第二阶段考试化学试题四川省成都市新津中学2021届高三上学期开学考试化学试题吉林省白城市洮南市第一中学2020-2021学年高一上学期第一次月考化学试题吉林省长春外国语学校2020-2021学年高一上学期第一次月考化学(理)试题广东省湛江市2018-2019学年高一上学期期末考试化学试题 黑龙江省鹤岗市第一中学2020-2021学年高一10月月考化学试题吉林省长春市榆树市实验高级中学2020-2021学年高一上学期第一次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高一(英才、卓越)10月月考化学试题山西省运城市永济中学校2020-2021学年高一上学期9月月考化学试题山西省太原师范学院附属中学师苑中学2020-2021学年高一上学期第一次月考化学试题辽宁省大连市育明高级中学2020-2021学年高一上学期月考化学试题广东省汕头市金山中学2020-2021学年高一上学期10月月考化学试题(已下线)【浙江新东方】29(已下线)【浙江新东方】25(已下线)【浙江新东方】38广东省东莞市东华高级中学2020-2021学年高一上学期第一次月考化学试题黑龙江省哈尔滨市第三中学2020-2021学年高一上学期期中考试化学试题陕西省榆林市第十二中学2021届高三上学期第二次月考化学试题青海省西宁市海湖中学2021届高三上学期第一阶段测试化学试题湖南省邵东县第一中学2020-2021学年高一上学期期中考试化学试题安徽省亳州市第二中学2020-2021学年高一上学期期中考试化学试题安徽省定远县育才学校2020-2021学年高一上学期11月质量检测化学试题云南省保山市第九中学2021届高三上学期阶段测试化学试题黑龙江省农垦建三江管理局第一高级中学2020-2021学年高一上学期期中考试化学试题海南省海口市第四中学2020-2021学年高一上学期期中考试化学试题河南省周口市中英文学校2021届高三上学期期中考试化学试题陕西省西安市长安区第一中学2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【hd-lp414】【化学】贵州省毕节市实验高级中学2020-2021学年高一上学期期中考试化学试题吉林省汪清县汪清第四中学2020-2021学年高一上学期期中考试化学试题河南省滑县实验学校2020-2021学年高一上学期11月半月考试化学试题云南省保山市第九中学2021届高三上学期期中考试化学试题甘肃省天水市一中2020-2021学年高一下学期开学考试化学试题辽宁省辽河油田第二高级中学2020-2021学年高一3月开学考试化学试题山东省莘州中学2020-2021学年高一上学期第一次质量检测(实验班)化学试题湖南省武冈市第二中学2020-2021学年高一上学期第一次月考化学试题辽宁省盘锦市第二高级中学2020-2021学年高一上学期第二次阶段考试化学试题广西南宁市英华学校2020-2021学年高一上学期期中考试化学试题陕西省洋县中学2020-2021学年高一下学期第三次月考化学试题辽宁省辽河油田第二高级中学2019-2020学年高一上学期第一次月考化学试题广东省汕头市潮南区田心中学2020-2021学年高一上学期第一次月考化学试题黑龙江省鸡西实验中学2020-2021学年高一上学期第一次月考化学试题河北省石家庄市第二中学2021-2022学年高一上学期10月月考化学试题四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题青海省西宁市海湖中学2021-2022学年高三上学期第一次月考化学试题河南省新乡县龙泉高级中学2021-2022学年高一上学期9月月考化学试题湖南省邵阳邵东市第一中学2021-2022学年高一上学期第一次月考化学试题黑龙江省哈尔滨市第三中学校2021-2022学年上学期高一学年第一次验收考试化学试题天津市耀华中学2021-2022学年高一上学期期中考试化学试题重庆育才中学2021-2022学年高一上学期第一次定时训练化学试题广东省东莞市新世纪英才学校2021-2022学年高一上学期第一次教学质量检测化学试题河南省濮阳市第一高级中学2021-2022学年高一上学期期中考试化学试题重庆市育才中学校2021-2022学年高一上学期期中考试化学试题 安徽省黄山市屯溪第一中学2021-2022学年高一上学期期中考试化学试题新疆乌鲁木齐第四中学2021-2022学年高一上学期期中考试化学试题甘肃省民勤县第一中学2021-2022学年高一上学期第一次月考化学试题黑龙江省佳木斯市第一中学2021-2022学年高一上学期12月月考化学试题四川省成都市树德中学2022-2023学年高一上学期10月阶段性测试化学试题四川省内江市威远中学校2022-2023学年高一上学期期中考试化学试题北京市第二十二中学2022-2023 学年高一上学期期中考试化学试题广东省揭阳市惠来县第一中学2022-2023学年高一上学期期中考试化学试题吉林省榆树市第一高级中学校2021-2022学年高一上学期期中考试化学试题海南省海口市第一中学2022-2023学年高一上学期期中考试化学试题重庆市育才中学2021-2022学年高一上学期期中考试化学试题(已下线)第5讲 氧化还原反应方程式的配平与计算辽宁省名校联盟2023-2024学年高一上学期10月联合考试化学试题湖南省长沙市第一中学2023-2024学年高一上学期第一次阶段性检测(月考)化学试题四川省阆中中学校2023-2024学年高一上学期11月月考化学试题北京市通州区2023-2024学年高一上学期期中质量检测化学试题河南省原阳县第一高级中学2023-2024学年高一上学期10月月考化学试题天津市滨海新区塘沽第一中学2023-2024学年高一上学期11月期中化学试题河北省石家庄市第二十三中学2023-2024学年高一上学期期中考试化学试题(已下线)北京市第四中学2023-2024学年高一上学期期中考试化学试题河北省石家庄外国语学校(四十三中)2023-2024学年高一上学期期中考试化学试题甘肃省天水市甘谷第一中学2023-2024学年高一上学期第二次月考化学试题
单选题
|
容易(0.94)
名校
6. 下列有关化学用语表示正确的是
A.中子数为20的氯原子: 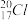 |
B.CO2的比例模型: |
C.铝原子的结构示意图: |
D.聚丙烯的结构简式: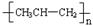 |
您最近一年使用:0次
单选题
|
适中(0.65)
7. 为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g 样品加热,其质量变为w2 g ,则该样品的纯度(质量分数)是
A.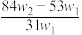 | B.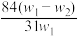 | C. | D.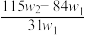 |
【知识点】 碳酸钠、碳酸氢钠混合物的有关求算解读
您最近一年使用:0次
2019-01-30更新
|
4431次组卷
|
70卷引用:2009年普通高等学校招生统一考试理综试题化学部分(全国卷Ⅰ)
2009年普通高等学校招生统一考试理综试题化学部分(全国卷Ⅰ)2009高考真题汇编-碱金属元素及其化合物2009高考真题汇编-化学计算(已下线)2010年吉林实验中学高三第二次模拟考试理综化学部分(已下线)2012届广西桂林十八中高三第一次月考化学试卷(已下线)2011-2012学年辽宁省沈阳东北育才学校高一上学期期中考试化学试卷(已下线)2012-2013学年甘肃省兰州一中高一上学期期末考试化学试卷(已下线)2012-2013学年甘肃省天水三中高一第三次(期末)月考化学试卷(已下线)2014届江苏省常州市某重点中学高三第一次月考化学试卷(已下线)2013-2014河北省石家庄一中上学期开学考试高二化学试卷2015-2016学年河北省隆化县存瑞中学高一上学期第二次月考化学试卷2015-2016学年内蒙古巴彦淖尔一中高一上期末化学试卷12015-2016学年河北省唐山市开滦二中高二下期末化学试卷2017-2018学年高一人教版必修一:15 钠的重要化合物焰色反应课时训练化学试题云南省澄江县第一中学2019届高三9月月考理科综合化学试题(已下线)【备战2019年浙江新高考-考点】——考点02 物质的量(已下线)2018年10月31日 《每日一题》人教必修1-Na2CO3和NaHCO3河北省承德市隆化县存瑞中学2018-2019学年高一上学期第二次质检化学试题云南省元江县一中2018-2019学年高一上学期12月考试化学试题陕西省澄城县澄城中学2018-2019学年高一上学期基础知识检测(三)化学试题(已下线)【走进新高考】(人教版必修一)3.2.1几种重要金属化合物——钠的重要化合物 同步练习01【全国百强校】河北省武邑中学2018-2019学年高二上学期期末考试化学试题山西省朔州市怀仁一中2018-2019学年高一上学期第五次月考化学试题陕西省西安中学2019-2020学年高一12月月考化学试题江西省上高县第二中学2019-2020学年高一上学期第三次月考化学试题2019年秋高三化学复习强化练习—— 化学计量的相关计算河北省武邑中学2019-2020学年高一12月月考化学试题2020届高三化学大二轮增分强化练——化学计算中的常用方法与技巧专练安徽省亳州市黉学高级中学2019-2020学年高一上学期期中考试化学试题(英才班)河北省保定市唐县第一中学2019-2020学年高一上学期期中考试化学试题福建省莆田市第四中学2019-2020学年高一上学期期中考试化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)云南省大理市下关第一中学2019-2020学年高一上学期期末考试化学试题广西壮族自治区河池市东兰县高级中学2019-2020学年高一上学期期末考试化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高一上学期第三次月考化学试题河南省新乡市延津县高级中学2019-2020学年高一上学期第一次月考化学试题(已下线)福建省平和一中、南靖一中等五校2018-2019学年高一年上学期第二次联考化学试题辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题(已下线)【浙江新东方】19河南省郑州市八所省示范高中2020-2021学年高一上学期期中联考化学试题河北省秦皇岛市抚宁一中2020-2021学年高一上学期期中考试化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记甘肃省金昌市第一中学2020-2021学年高一上学期期末考试化学试题山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高一下学期开学考试化学试题(已下线)专题02 物质的量在化学实验中的应用(热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)专题06 钠及其化合物(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)衔接点14 钠的化合物-2021年初升高化学无忧衔接(已下线)专题讲座(一) 化学计算的常用方法(精讲)-2022年一轮复习讲练测甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题甘肃省兰州市第一中学2021-2022学年高三上学期第一次月考(10月)化学试题宁夏长庆高级中学 2021-2022学年高三上学期第一次月考化学试题山东省济南市历城第一中学2021-2022学年高一10月月考化学试题(已下线)必考点07 钠盐及焰色试验-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)(已下线)易错专题12 Na2CO3和NaHCO3的性质、鉴别与除杂-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)(已下线)专题02 化学计算中常用的几种方法-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)吉林省洮南市第一中学2021-2022学年高一上学期第三次月考化学试题陕西省宝鸡市金台区2021-2022学年高一上学期期末考试化学试题(已下线)第14讲 化学方程式的计算-【暑假自学课】2022年新高一化学暑假精品课(沪科版2020必修第一册)(已下线)微专题04 以物质的量为中心的计算-备战2023年高考化学一轮复习考点微专题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题讲座(一) 化学计算的常用方法(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)衔接点15 钠的化合物-2022年初升高化学无忧衔接?(已下线)1.2.1 物质的量 阿伏加德罗常数-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)上海市松江二中2021-2022学年高一上学期期中考试化学试题宁夏回族自治区银川一中2022-2023学年高一上学期期中考试化学试题黑龙江省黑河市第九中学2021--2022学年高一上学期期中考试化学试题(已下线)【2022】【高一化学】【期中考】-183(已下线)微专题 化学计算的思想方法湖北省武汉市第三中学2023-2024学年高一上学期10月月考化学试题四川省宜宾市叙州区第二中学校2023-2024学年高一上学期10月月考化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
8. 消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________ (填序号)。
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为______________ ,H2O2被称为“绿色氧化剂”的理由是______________________ 。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________ 。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_____________ (用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________ 。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是
| A.Cl2 | B.H2O2 |
| C.ClO2 | D.O3 |
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是
【知识点】 氧化还原反应的应用 氧化还原反应有关计算 氯气 漂白粉和漂粉精
您最近一年使用:0次
2016-12-09更新
|
1296次组卷
|
12卷引用:2014年高考化学一轮复习课后规范训练2-3练习卷
(已下线)2014年高考化学一轮复习课后规范训练2-3练习卷2016届陕西省西安市第七十中学高三上学期10月月考化学试卷2017届江西省铅山一中、横峰中学高三上学期暑假联考化学试卷2016-2017学年安徽省六安市第一中学高一下学期第一次阶段检测化学试卷云南省澄江县第一中学2019届高三9月月考理科综合化学试题云南省漾濞二中2020届高三上学期开学考试化学试题江西省南昌市第十中学2020届高三上学期期中考试化学试题云南省广南县二中2019-2020学年高三上学期期末考试化学试题山西省忻州市第一中学高一化学下学期(远程)目标检测(4)化学试题(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测江西省丰城市第九中学2020届高三上学期期中考试化学试题安徽省定远县育才学校2021届高三上学期第二次月考化学试题
填空题
|
适中(0.65)
名校
解题方法
9. 微型化学实验可以有效实现化学实验绿色化的要求。如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好根据上述描述涉及到的元素,回答下列问题:

(1)a中反应的化学反应方程式为________________________________________ ,证明KI中含有钾元素的方法是:____________________________ 。
(2)c中反应的离子反应方程式为_______________________________________ ,b中的现象是________________________________________________ 。
(3)短周期原子半径最大的原子共有______ 种不同能量的电子。它与同周期原子半径最小元素形成晶体,该晶体中每个阳离子周围距离最近有_______ 个阴离子。
(4)把少许KMnO4撒入盛水烧杯中溶解,包含物理过程(即__________ 过程和化学过程(即_____________ 过程。所以,溶液中的有色离子应该是__________________ (写名称)。
(5)NH3与H2O分别能与H+结合成NH4+与H3O+。与NH4+具有相同空间构型的微粒是_______ ;
a.H3O+b.CH4 c.P4 d.NH3
(6)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2___________________ L(标准状况,保留2位小数)。

(1)a中反应的化学反应方程式为
(2)c中反应的离子反应方程式为
(3)短周期原子半径最大的原子共有
(4)把少许KMnO4撒入盛水烧杯中溶解,包含物理过程(即
(5)NH3与H2O分别能与H+结合成NH4+与H3O+。与NH4+具有相同空间构型的微粒是
a.H3O+b.CH4 c.P4 d.NH3
(6)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2
您最近一年使用:0次
填空题
|
适中(0.65)
名校
10. 已知五种元素的原子序数的大小顺序为C>A>B>D>E,A,C同周期,B,C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________ 、B:________ 、C:________ 、D:________ 、E:________ 。
(2)用电子式表示离子化合物A2B的形成过程:______________________ 。
(3)写出下列物质的电子式:
①D元素形成的单质:_______________________________________________ 。
②E与B形成的化合物:_____________________________________________ 。
③A,B,E形成的化合物:___________________________________________ 。
④D与E形成的化合物:______________________________________________ 。
⑤C,D,E形成的离子化合物:________________________________________ 。
(1)写出五种元素的元素符号:A:
(2)用电子式表示离子化合物A2B的形成过程:
(3)写出下列物质的电子式:
①D元素形成的单质:
②E与B形成的化合物:
③A,B,E形成的化合物:
④D与E形成的化合物:
⑤C,D,E形成的离子化合物:
您最近一年使用:0次
三、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
11. [2016·新课标I]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]_______________ ,有__________ 个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是______________________________ 。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________ 。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________________________ 。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______________ ,微粒之间存在的作用力是_______________ 。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______________ 。_____ g·cm−3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为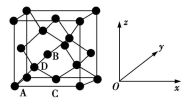
您最近一年使用:0次
2016-12-09更新
|
7016次组卷
|
32卷引用:2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)
2016年全国普通高等学校招生统一考试化学(新课标1卷精编版)2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷河南省郑州市八校2016-2017学年高二下学期期中联考化学试题2017届山东省潍坊市实验中学高三下学期第四次单元过关测试理科综合化学试卷云南民族大学附属中学2017-2018学年高二下学期第一次月考化学试题(已下线)《考前20天终极攻略》5月30日 物质结构与性质(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密云南省澄江县第一中学2019届高三9月月考理科综合化学试题云南省玉溪市峨山一中2019届高三9月上学期月考化学试题云南省玉溪市新平县第一中学2019届高三第一次月考理综化学试题云南省新平一中2019届高三上学期12月考试化学试题2016年全国普通高等学校招生统一考试化学(全国1卷参考版)广东省深圳外国语学校2019届高三第一次月考理综化学试题鲁科版高中化学选修3模块综合测评卷新疆乌鲁木齐县柴窝堡林场中学2019届高三四月调研考试理综化学试题百所名校联考-物质结构与性质云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题贵州省三都水族自治县高级中学2019-2020学年高三上学期期末考试理综化学试题贵州省剑河县第二中学2019-2020学年高三上学期期末考试化学试题宁夏石嘴山市第三中学2019-2020学年高二下学期期中考试化学试题湖南省衡阳市2020年高中毕业班教学质量监测卷理科综合化学宁夏海原县第一中学2019-2020学年高二下学期第一次月考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题广东省深圳市罗湖区2022届高三上学期第一次质量检测化学试题贵州省威宁县第八中学2021-2022学年高三上学期第一次月考化学试题陕西省武功县2021-2022学年高三上学期第二次质量检测理科综合化学试题 陕西省汉中市2022届高三下学期第五次校级联考理科综合化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题湖南省岳阳市汨罗市第二中学2022届高三下学期期中考试化学试题山东省德州市2021-2022学年高二下学期物质结构与性质模块综合测评化学试题山东省青岛一中2023-2024学年高二下学期第二次月考化学试卷
解答题-有机推断题
|
较难(0.4)
12. 氰基丙烯酸酯在碱性条件下能快速聚合为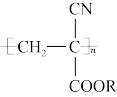 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
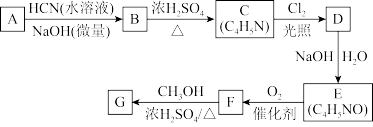
已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰


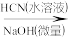
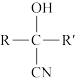
回答下列问题:
(1)A的化学名称为_______ 。
(2)B的结构简式为______ ,其核磁共振氢谱显示为______ 组峰,峰面积比为______ 。
(3)由C生成D的反应类型为________ 。
(4)由D生成E的化学方程式为___________ 。
(5)G中的官能团有___ 、 ____ 、_____ 。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____ 种。(不含立体异构)
 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
已知:
①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰


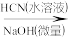

回答下列问题:
(1)A的化学名称为
(2)B的结构简式为
(3)由C生成D的反应类型为
(4)由D生成E的化学方程式为
(5)G中的官能团有
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有
您最近一年使用:0次
2019-01-30更新
|
3762次组卷
|
21卷引用:2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)
2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2015-2016学年福建省晋江市季延中学高二下学期期末化学试卷2015-2016学年黑龙江省哈尔滨六中高一下期末化学试卷黑龙江省双鸭山市第一中学2016-2017学年高二下学期期中考试化学试题江西省玉山县第一中学2016-2017学年高二下学期期中考试化学试题云南省澄江县第一中学2019届高三9月月考理科综合化学试题云南省玉溪市新平县第一中学2019届高三第一次月考理综化学试题【全国百强校】内蒙古自治区巴彦淖尔一中2018-2019学年高二上学期10月月考化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)【市级联考】陕西省西安市2017-2018学年高二下学期期末考试化学试题【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二下学期第二次月考化学试题重庆市第三十中学2018-2019学年高二5月月考化学试题3.3合成高分子化合物基础达标四川省内江市资中县球溪高级中学2018-2019学年高二下学期第二次月考化学试题贵州省长顺县二中2019-2020学年高三上学期期末考试理综化学试题云南省玉溪市新平县一中2019-2020学年高三上学期1月月考理综化学试题第五章 进入合成有机高分子化合物的时代—— C 挑战区 模拟高考(人教版选修5)(鲁科版2019)选3第2章 微项目湖北省武汉市华中师范大学第一附属中学2020届高三3月份网络教学质量监测卷理综化学试题山东省烟台第二中学2021-2022学年高二4月月考化学试题河南省南阳市第一中学校2022-2023学年高二下学期4月月考化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、有机化学基础、物质结构与性质、常见无机物及其应用
试卷题型(共 12题)
题型
数量
单选题
7
填空题
3
解答题
2
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.64 | 离子共存 | |
| 2 | 0.65 | 氧化还原反应基本概念 | |
| 3 | 0.85 | 离子反应的发生条件 无附加条件的离子共存 | |
| 4 | 0.85 | 离子反应的发生条件 限定条件下的离子共存 | |
| 5 | 0.85 | 离子反应的发生及书写 | |
| 6 | 0.94 | 化学用语综合判断 有机物结构的表示方法 核外电子排布规律 元素、核素、同位素 | |
| 7 | 0.65 | 碳酸钠、碳酸氢钠混合物的有关求算 | |
| 二、填空题 | |||
| 8 | 0.65 | 氧化还原反应的应用 氧化还原反应有关计算 氯气 漂白粉和漂粉精 | |
| 9 | 0.65 | 氧化还原反应有关计算 微粒半径大小的比较方法 利用杂化轨道理论判断分子的空间构型 离子配位数 | |
| 10 | 0.65 | 共价型分子结构式、电子式 同主族元素性质递变规律 微粒半径大小的比较方法 根据原子结构进行元素种类推断 | |
| 三、解答题 | |||
| 11 | 0.65 | 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 12 | 0.4 | 同分异构体的数目的确定 卤代烃的性质 有机合成综合考查 有机推断综合考查 | 有机推断题 |



