云南省开远市第二中学校2019-2020学年高一上学期期末考试化学试题
云南
高一
期末
2020-01-25
291次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
| A.阴离子只有还原性 |
| B.含有最高价元素的化合物,只有氧化性,不具有还原性 |
| C.Zn和稀硫酸反应既属于离子反应,也属于氧化还原反应 |
| D.没有单质参加也没有单质生成的反应一定不是氧化还原反应 |
| A.0.120 mol | B.0.110 mol | C.0.080 mol | D.0.100 mol |
| A.2Na+2H2O=2NaOH+H2↑ | B.Cl2+H2O=HCl+HClO |
| C.2F2+2H2O=4HF+O2 | D.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
二、未知 添加题型下试题
| A.溴离子具有氧化性 | B.氯气的氧化性比溴单质强 |
| C.该反应属于复分解反应 | D.氯气是还原剂 |
三、单选题 添加题型下试题
| A.金的熔点高,难以熔化 |
| B.金的化学性质稳定,不易与其他物质反应 |
| C.金越炼越纯 |
| D.金的硬度大,高温下难以变形 |
【知识点】 金属通性
| A.0.1 mol/L | B.0.5 mol/L | C.1 mol/L | D.4 mol/L |
【知识点】 依据物质的量浓度公式的基础计算解读

| A.二者物质的量之比为3∶2 |
| B.二者质量之比为3∶2 |
| C.二者摩尔质量之比为2∶3 |
| D.二者消耗H2SO4的物质的量之比为2∶3 |
| A.Al2O3和水混合加热 |
| B.过量的稀HCl加入到Na[Al(OH)4]溶液中 |
| C.过量的NaOH溶液加入到AlCl3溶液中 |
| D.过量的氨气通入到AlCl3溶液中 |
【知识点】 氢氧化铝的制备解读 偏铝酸钠与盐酸的反应解读
2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是()
| A.+3 | B.+4 | C.+5 | D.+6 |
【知识点】 离子反应的发生及书写
| A.Al2(SO4)3=2Al3++3SO42- |
| B.AlCl3=Al3++Cl3- |
| C.Mg(NO3)2=Mg+2+2NO3- |
| D.KMnO4=K++Mn7++4O2- |
 MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(标准状况),下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4 L Cl2(标准状况),下列有关说法中不正确的是| A.这种软锰矿石中MnO2的质量分数为75% |
| B.被氧化的HCl的物质的量为4 mol |
| C.参加反应的HCl的质量为146 g |
| D.被还原的MnO2的物质的量为1 mol |
【知识点】 氧化还原反应有关计算 基于氧化还原反应守恒规律的计算解读
| A.Na2O2、Fe3O4、CuO均为碱性氧化物 |
| B.稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C.烧碱、冰醋酸、四氯化碳均为电解质 |
| D.盐酸、水玻璃、氨水均为混合物 |
【知识点】 物质的分类
| A.H2 | B.CO | C.乙酸(CH3COOH) | D.甲烷(CH4) |
| A.标准状况下,22.4 L氢气中含有2NA个中子 |
| B.0.1NA个氯化氢分子占有体积为2.24 L |
| C.2克金属钙变成钙离子时失去的电子数为0.1NA |
| D.50 mL 0.1 mol·L-1H2SO4溶液中含有H+数为0.005NA |
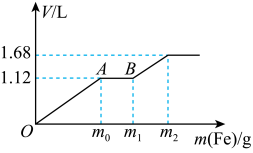
| A.开始时产生的气体为H2 |
| B.AB段产生的反应为置换反应 |
| C.所用混合溶液中c(HNO3)=0.5mol·L-1 |
| D.参加反应铁粉的总质量m2=5.6g |
| A.除去石灰水中悬浮的碳酸钙颗粒 |
| B.除去氯化钠晶体中混有的碘单质 |
| C.分离汽油和煤油的混合物 |
| D.分离水和苯的混合物 |
| A.硫酸滴加到偏铝酸钠溶液中 |
| B.氢氧化钡溶液滴加到硫酸铝溶液中 |
| C.氨水滴加到硫酸铝溶液中 |
| D.硫酸铝溶液滴加到氢氧化钠溶液中 |
【知识点】 铝盐与强碱溶液反应解读 偏铝酸钠与盐酸的反应解读
方案Ⅰ:铜铝混合物
 测定生成气体的体积
测定生成气体的体积方案Ⅱ:铜铝混合物
 测定剩余固体的质量
测定剩余固体的质量下列有关判断中不正确的是
| A.溶液A和B均可以是盐酸或氢氧化钠溶液 |
| B.溶液A和B均可以选用稀硝酸 |
| C.若溶液B选用氯化铁溶液,则实验难以实现 |
| D.实验方案Ⅱ更便于实施 |
| A.N2O | B.NO | C.NO2 | D.N2O3 |
【知识点】 氧化还原反应有关计算 基于氧化还原反应守恒规律的计算解读
①铁钉表面产生气泡 ②溶液由无色逐渐变为浅绿色 ③铁钉的质量减轻 ④溶液的质量减轻
| A.②③ | B.①②④ | C.①②③ | D.①②③④ |
【知识点】 铁与非氧化性酸的反应解读
| A.赤铁矿的主要成分是Fe3O4 |
| B.铁矿石的主要成分与铁锈的主要成分相同 |
| C.磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色 |
| D.FeO俗称铁红 |
【知识点】 铁的氧化物 铁盐与亚铁盐鉴别试剂的选择解读
 +2H+=H2O+CO2↑表示
+2H+=H2O+CO2↑表示| A.碳酸盐与盐酸之间的反应 | B.一切碳酸盐与一切酸之间的反应 |
| C.可溶性碳酸盐与酸之间的反应 | D.可溶性碳酸盐与强酸之间的反应 |
【知识点】 离子反应概念解读 离子反应的发生及书写
| A.可用加热法分离氯化钠和碳酸钙 |
| B.蒸馏和蒸发都用来分离液体混合物 |
| C.工业上制无水酒精通常是将生石灰与95%酒精混合后蒸馏 |
| D.碘水中加四氯化碳振荡静置后,上层为紫色,下层几乎为无色 |
【知识点】 物质分离、提纯的常见物理方法 蒸馏与分馏解读
四、解答题 添加题型下试题
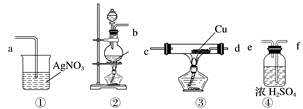
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→
(2)装置②中主要玻璃仪器的名称
(3)实验室制备Cl2的离子方程式为
(4)装置③中Cu的作用
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到
五、填空题 添加题型下试题
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号)
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO
 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O写出该氧化还原反应的化学方程式:
(4)请配平以下化学方程式:
 Al+
Al+ NaNO3+
NaNO3+ NaOH===
NaOH=== NaAlO2+
NaAlO2+ N2↑+
N2↑+ H2O
H2O六、解答题 添加题型下试题

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为
【知识点】 碳与浓硫酸反应产物的检验解读
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
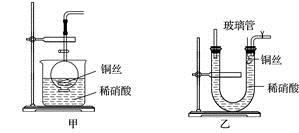
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是
②让反应停止的操作方法及原因是
(4)以下收集NO气体的装置,合理的是
(5)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
①NO的体积为
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为

(1)写出A~F物质的化学式:
A
(2)写出E→F的化学方程式
(3)鉴别物质F中阴离子的方法是
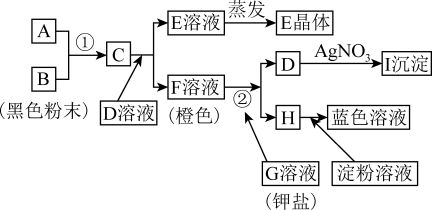
(1)写出反应①的离子方程式:
(2)推出下列物质的化学式:E
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为
试卷分析
试卷题型(共 31题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 氧化还原反应的规律 | |
| 2 | 0.85 | 物质的量有关计算 镁 铝与酸溶液反应 铁 | |
| 3 | 0.65 | 常见氧化剂与还原剂 | |
| 5 | 0.94 | 金属通性 | |
| 6 | 0.65 | 依据物质的量浓度公式的基础计算 | |
| 7 | 0.85 | 物质的量有关计算 镁 铝 | |
| 8 | 0.85 | 氢氧化铝的制备 偏铝酸钠与盐酸的反应 | |
| 9 | 0.85 | 离子反应的发生及书写 | |
| 10 | 0.65 | 电离方程式 | |
| 11 | 0.65 | 氧化还原反应有关计算 基于氧化还原反应守恒规律的计算 | |
| 12 | 0.85 | 铁与水蒸气的反应 | |
| 13 | 0.85 | 物质的分类 | |
| 14 | 0.65 | 过氧化钠的相关计算 | |
| 15 | 0.65 | 阿伏加德罗常数的应用 22.4L/mol适用条件 物质的量浓度的计算 | |
| 16 | 0.85 | 铁与强氧化性酸的反应 铁与非氧化性酸的反应 铁与铁离子反应 | |
| 17 | 0.85 | 蒸馏与分馏 萃取和分液 过滤 升华 | |
| 18 | 0.65 | 铝盐与强碱溶液反应 偏铝酸钠与盐酸的反应 | |
| 19 | 0.65 | 硝酸的强氧化性 铝与强碱溶液反应 物质含量的测定 化学实验方案的设计与评价 | |
| 20 | 0.65 | 氧化还原反应有关计算 基于氧化还原反应守恒规律的计算 | |
| 21 | 0.65 | 铁与非氧化性酸的反应 | |
| 22 | 0.85 | 铁的氧化物 铁盐与亚铁盐鉴别试剂的选择 | |
| 23 | 0.94 | 氯离子的检验 常见阴离子的检验 | |
| 24 | 0.94 | 离子反应概念 离子反应的发生及书写 | |
| 25 | 0.65 | 物质分离、提纯的常见物理方法 蒸馏与分馏 | |
| 二、未知 | |||
| 4 | 0.65 | 氧化还原反应的几组概念 氧化还原反应定义、本质及特征 氧化性、还原性强弱的比较 | 未知 |
| 三、解答题 | |||
| 26 | 0.4 | 化学实验基础 卤素及其化合物 | 实验探究题 |
| 28 | 0.65 | 碳与浓硫酸反应产物的检验 | 实验探究题 |
| 29 | 0.65 | 一氧化氮的化学性质 二氧化氮与水反应 铜与强氧化性酸的反应 综合实验设计与评价 | 实验探究题 |
| 30 | 0.4 | 氨气 铵盐 二氧化硫 | 无机推断题 |
| 31 | 0.65 | 无机综合推断 氯气的化学性质 氯气的实验室制法 卤素离子 | 无机推断题 |
| 四、填空题 | |||
| 27 | 0.65 | 氧化还原反应的几组概念 氧化还原反应的应用 氧化还原反应方程式的配平 氧化还原反应的规律 | |



