2016届浙江省建人高复学校高三上学期第一次月考化学试卷2
浙江
高三
阶段练习
2017-07-27
534次
整体难度:
适中
考查范围:
化学反应原理、物质结构与性质、认识化学科学、化学实验基础、常见无机物及其应用、化学与STSE
一、单选题 添加题型下试题
| A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 |
| B.道尔顿、汤姆生、卢瑟福和门捷列夫等对原子结构模型的建立均作出了卓越的贡献 |
| C.化学反应能制造出新的物质,也能制造出新的元素,并伴有能量变化 |
| D.感染MERS致死率较高,为防止感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |
【知识点】 反应热
A.硫原子的原子结构示意图: |
B.H2O的电子式: |
C.原子核内有10个中子的氧原子:  |
D.CO2的比例模型: |
【知识点】 元素周期表 元素周期律
| A.化合物:干冰,冰水混合物,烧碱,小苏打 |
| B.非电解质:乙醇,四氯化碳,氯气,葡萄糖 |
| C.同素异形体:活性炭,C60,石墨烯,金刚石 |
| D.混合物:铝热剂,纯净矿泉水,水玻璃,漂白粉 |
【知识点】 物质的分类
①酸性氧化物肯定是非金属氧化物
②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物
④金属氧化物都是碱性氧化物
⑤酸性氧化物均可与水反应生成相应的酸
⑥与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物
⑦不能跟酸反应的氧化物一定能跟碱反应
| A.①②③④ | B.⑤⑥⑦ | C.②③⑥⑦ | D.③⑥ |
【知识点】 氧化还原反应
| A.氢氟酸具有强酸性,可用于雕刻玻璃 |
| B.明矾净水是因为Al(OH)3胶体能消毒 |
| C.MgO、Al2O3熔点高,它们都可用于制作耐火材料 |
| D.高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
【知识点】 仪器使用与实验安全
| A.用到金属钠时,要用镊子取、再用小刀切下所需量,剩余的钠不能放回原试剂瓶中 |
| B.大型中央空调的制冷剂可用液氨 |
| C.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
| D.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
【知识点】 仪器使用与实验安全
①NaAlO2(aq)
 AlCl3
AlCl3 Al
Al ② NH3
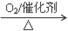 NO
NO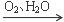 HNO3
HNO3③NaCl(饱和)
 NaHCO3
NaHCO3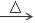 Na2CO3
Na2CO3④FeS2
 SO3
SO3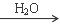 H2SO4
H2SO4| A.②③ | B.①④ | C.②④ | D.③④ |
②盛溴的试剂瓶里加少量水以减少溴的挥发
③钾、钠、白磷都应保存在水中
④做焰色反应实验时所用铂丝,每次用完后用稀硫酸洗涤后再使用
| A.①② | B.②④ | C.①③ | D.①③④ |
【知识点】 仪器使用与实验安全
| A.常温下,将1 g铝片投入20 mL 18.4 mol·L-1的硫酸中 |
| B.向100 mL 3 mol·L-1的硝酸中加入5.6 g铁 |
| C.用50 mL浓盐酸与足量MnO2共热 |
| D.在5×107 Pa、500 ℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
【知识点】 化学计量
①二氧化硅是电子工业中常用的半导体材料
②氢氧化铝可用于治疗胃酸过多
③氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
④天然气、石油和煤均属于不可再生能源
⑤用食醋清洗热水瓶中的水垢
⑥用纯碱溶液洗涤餐具上的油污
⑦用米汤检验含碘盐中的碘酸钾
⑧医疗上可用碳酸钡作x射线透视肠胃的内服药,是因为碳酸钡不溶于水
⑨某雨水样品放置一段时间后pH由4.68变为4.00,是因为水中溶解的CO2增多
⑩加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
| A.①③④⑦⑩ | B.②③④⑤⑥ | C.①⑦⑧⑨⑩ | D.①②④⑦⑨⑩ |
| A.标准状况下,5.6L SO3含有的分子数为0.25NA |
| B.标况下,0.1mol苯中含有C=C键数目为0.3NA |
| C.46g NO2和N2O4的混合气体中含有的原子个数为3NA |
| D.7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂 |
【知识点】 化学计量
A.将氯气溶于水制备次氯酸:Cl2 + H2O 2H+ + Cl-+ ClO— 2H+ + Cl-+ ClO— |
| B.碳酸氢铵与过量的NaOH溶液反应:NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O |
| C.NaOH溶液中通入少量二氧化硫:SO2+ 0Hˉ= HSO3- |
| D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
【知识点】 离子反应的发生及书写
| A.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
| B.有NO3- 存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| C.碳酸氢钠溶液中:K+、ClO-、Cl-、OH- |
| D.使酚酞变红的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- |
【知识点】 离子共存
| A.作为酸 | B.作为漂白剂 | C.作为还原剂 | D.作为氧化剂 |
【知识点】 氧化还原反应基本概念 二氧化硫
2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是()
| A.+3 | B.+4 | C.+5 | D.+6 |
【知识点】 离子反应的发生及书写
| A.阳离子都只有氧化性 |
| B.H2O2既有氧化性,又有还原性,与KMnO4反应时表现H2O2的还原性 |
| C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 |
| D.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 |
【知识点】 物质的分类
A. Fe(NO3)x,中的x为 |
| B.反应中每生成0.2 mol还原产物,就有0.6 mol电子转移 |
| C. HNO3在反应中只体现氧化性 |
| D.磁性氧化铁中的铁元素全部被氧化 |
【知识点】 氧化还原反应的应用 基于氧化还原反应守恒规律的计算解读

| A.实验I:液体分层,下层呈无色 |
| B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C.实验Ⅲ:试管中溶液颜色仍无色 |
| D.实验Ⅳ:放一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
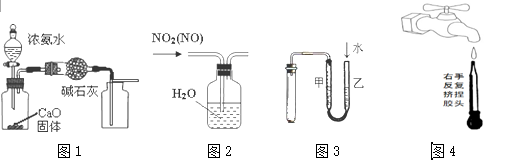
| A.用图1装置制取并收集干燥纯净的NH3 |
| B.用图2所示装置可除去NO2中的NO |
| C.用图3所示装置检验装置的气密性 |
| D.图④是实验室洗涤胶头滴管的操作 |
①向饱和碳酸钠溶液中通入过量CO2 ②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀NaOH溶液 ④向硅酸钠溶液中逐滴加入过量的盐酸
⑤向AgNO3溶液中逐滴加入稀氨水
| A.①② | B.②③ | C.①④ | D.④⑤ |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A.A | B.B | C.C | D.D |
【知识点】 Fe2+的鉴别及其应用解读 化学实验方案的设计与评价
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤溶液中共发生了2个氧化还原反应
| A.①②③④ | B.①②③④⑤ | C.①③④⑤ | D.②④⑤ |
【知识点】 弱电解质的电离
| A.33.2 g | B.25.4 g | C.22.4 g | D.19.6 g |
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加入盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失;
③另取一定量的原溶液中加入5mL0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g。
下列说法中正确的是
| A.该溶液中一定不含NH4+、Al3+、SiO32-、Cl- |
| B.该溶液中一定含有Al3+、CO32-、Cl- |
| C.Cl-可能含有 |
| D.该溶液中一定含有AlO2-、CO32-、Cl- |
二、填空题 添加题型下试题
③[ ]K2Cr2O7+ ]FeSO4+ [ ] H2SO4 = [ ]Fe2(SO4)3+ [ ]Cr2(SO4)3+ [ ]K2SO4+ [ ]H2O
(1)上述三个反应中,属于氧化还原反应的是
(2)配平反应③的化学方程式
(3)K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序:
【知识点】 氧化还原反应
(1)优氯净中氮元素的化合价为。
(2)亚硫酸钠将水中多余次氯酸除去的离子反应方程式为。
(3)亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法。
【知识点】 离子反应
(2)根据下列描述写出下列化学方程式:
①已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的离子方程式:
② 联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素【CO(NH2)2】和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式:
【知识点】 离子反应的发生及书写
三、解答题 添加题型下试题

已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡 Sn(OH)Cl]。
(1) 写出物质A的名称:
(2) SnCl2用盐酸而不用水溶解的原因是
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:
(5) 实验室中“漂洗”沉淀的实验操作方法是
四、计算题 添加题型下试题

(1)加入盐酸后总共产生的气体在标准状况下的体积为
(2)盐酸中HCl的物质的量浓度
(3)反应后的固体的成分(填化学式)
(4)x=
【知识点】 离子反应的发生及书写 过氧化钠 碳酸氢钠 探究物质组成或测量物质的含量解读
试卷分析
试卷题型(共 29题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 反应热 | |
| 2 | 0.94 | 元素周期表 元素周期律 | |
| 3 | 0.85 | 物质的分类 | |
| 4 | 0.85 | 氧化还原反应 | |
| 5 | 0.94 | 仪器使用与实验安全 | |
| 6 | 0.85 | 仪器使用与实验安全 | |
| 7 | 0.65 | 硝酸 含硫化合物之间的转化 电解法制取铝 氯碱工艺 | |
| 8 | 0.94 | 仪器使用与实验安全 | |
| 9 | 0.85 | 化学计量 | |
| 10 | 0.65 | 氯气的用途 硫、氮氧化物对人体、环境的危害 酸雨 氢氧化铝的物理性质及用途 化学在工业中的应用 | |
| 11 | 0.64 | 化学计量 | |
| 12 | 0.4 | 离子反应的发生及书写 | |
| 13 | 0.64 | 离子共存 | |
| 14 | 0.4 | 氧化还原反应基本概念 二氧化硫 | |
| 15 | 0.85 | 离子反应的发生及书写 | |
| 16 | 0.85 | 物质的分类 | |
| 17 | 0.65 | 氧化还原反应的应用 基于氧化还原反应守恒规律的计算 | |
| 18 | 0.65 | 化学实验方案的设计与评价 实验方案设计的基本要求 物质性质实验方案的设计 | |
| 19 | 0.64 | 化学实验基础 氮族元素及其化合物 | |
| 20 | 0.65 | 明矾与氢氧化钡溶液反应的离子方程式 铝盐与强碱溶液反应 偏铝酸钠与盐酸的反应 | |
| 21 | 0.65 | Fe2+的鉴别及其应用 化学实验方案的设计与评价 | |
| 22 | 0.94 | 弱电解质的电离 | |
| 23 | 0.85 | 硝酸的强氧化性 | |
| 24 | 0.65 | 离子共存 离子反应的实际应用 离子反应在化合物组成的分析、鉴定的应用 | |
| 二、填空题 | |||
| 25 | 0.85 | 氧化还原反应 | |
| 26 | 0.85 | 离子反应 | |
| 27 | 0.85 | 离子反应的发生及书写 | |
| 三、解答题 | |||
| 28 | 0.65 | 化学实验基础操作 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 四、计算题 | |||
| 29 | 0.4 | 离子反应的发生及书写 过氧化钠 碳酸氢钠 探究物质组成或测量物质的含量 | |



