四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题
四川
高二
阶段练习
2021-10-29
654次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、化学反应原理、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
| A.氯化钠的分子式:NaCl | B.H-的结构示意图: |
C.氧化镁的电子式: | D.一氯甲烷的结构简式: |
【知识点】 化学用语综合判断 原子结构示意图、离子结构示意图解读
| A.氨水 | B.硝酸 | C.醋 | D.卤水 |
【知识点】 硝酸的强氧化性解读 化学科学对人类文明发展的意义解读
A | B | C | D | |
| 垃圾 | 废易拉罐 | 废塑料瓶 | 废荧光灯管 | 不可再生废纸 |
| 垃圾分类 |  可回收物 |  其他垃圾 |  有害垃圾 |  可燃垃圾 |
| A.A | B.B | C.C | D.D |
| A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 |
| B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 |
| C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 |
| D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 |
| A.硅胶可用作食品干燥剂 |
| B.P2O5不可用作食品干燥剂 |
| C.六水合氯化钙可用作食品干燥剂 |
| D.加工后具有吸水性的植物纤维可用作食品干燥剂 |
 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )| A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 |
| B.一个N≡N键断裂的同时,有3个H—H键生成 |
| C.其他条件不变时,混合气体的密度不再改变 |
| D.v正(N2)=2v逆(NH3) |
【知识点】 化学平衡状态的判断方法解读
2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是()
| A.+3 | B.+4 | C.+5 | D.+6 |
【知识点】 离子反应的发生及书写
| A.16g甲烷燃烧放出890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1 |
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6kJ·mol-1 2NH3(g) ΔH=-38.6kJ·mol-1 |
C.已知在120℃、101kPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为H2(g)+ O2(g) O2(g) H2O(g) ΔH=-242kJ·mol-1 H2O(g) ΔH=-242kJ·mol-1 |
| D.25℃、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-57.3kJ·mol-1 |
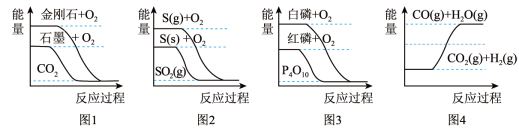
据此判断下列说法中正确的是( )
| A.由图1知,石墨转变为金刚石是吸热反应 |
| B.由图2知,S(g)+O2(g)=SO2(g) ΔH1,S(s)+O2(g)=SO2(g)ΔH2,则ΔH1>ΔH2 |
| C.由图3知,白磷比红磷稳定 |
| D.由图4知,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0 |
 可被氧化为NO
可被氧化为NO 。已知反应2NO
。已知反应2NO (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq) ΔH1=-146.0kJ·mol-1,NO
(aq) ΔH1=-146.0kJ·mol-1,NO (aq)+O2(g)=NO
(aq)+O2(g)=NO (aq)+O(g) ΔH2=xkJ·mol-1,O=O键断裂需要的能量为499.0kJ·mol-1。则x的值为
(aq)+O(g) ΔH2=xkJ·mol-1,O=O键断裂需要的能量为499.0kJ·mol-1。则x的值为| A.+176.5 | B.-176.5 | C.+322.5 | D.-322.5 |
【知识点】 盖斯定律及其有关计算 盖斯定律与热化学方程式解读
A. | B.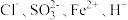 |
C.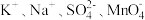 | D.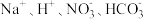 |
【知识点】 离子共存 无附加条件的离子共存解读
| A.同温同压下,C18O与N2的密度相同 |
| B.同体积同密度的C2H4与C3H6含有的分子数相同 |
| C.标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D.在过氧化钠与水的反应中,固体每增重mg,转移电子的数目为mNA/2 |
【知识点】 阿伏加德罗常数的求算解读
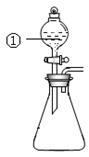
| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A.A | B.B | C.C | D.D |
| A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ |
| B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 |
| C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ |
| D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |

| A.上述反应每转移0.2mol电子就能生成2.24LO2 |
| B.过氧化铬中含有极性共价键、非极性共价键和离子键 |
| C.过氧化铬具有较强的氧化性 |
| D.CrO5中Cr元素的化合价为+5 |
【知识点】 氧化还原反应有关计算
| A.0.44 s | B.1 s | C.1.33 s | D.2 s |
【知识点】 化学反应速率与化学计量数之间的关系解读
 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的速率可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的速率可表示为| A.υ(NH3)=0.01 mol∙L−1∙s−1 | B.υ(O2)=0.001 mol∙L−1∙s−1 |
| C.υ(NO)=0.001 mol∙L−1∙s−1 | D.υ(H2O)=0.045 mol∙L−1∙s−1 |
 2Z(g),有关下列图像的说法正确的是
2Z(g),有关下列图像的说法正确的是



| A.依据图a可判断正反应为吸热反应 |
| B.在图b中,虚线可表示压强增大 |
| C.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0 |
| D.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动 |
【知识点】 浓度对化学平衡移动的影响解读
| A.Be(OH)2既可以和强酸反应,又可以和强碱反应 |
| B.①硫酸比次氯酸稳定;②S2-易被氯气氧化,均能说明氯元素的非金属性比硫元素强 |
| C.中学教材所附周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4 |
| D.HF的沸点比HCl 高,是因为H-F键比H-Cl键强 |
 CH3OCH3(g)+H2O(g) ΔH=-25kJ·mol-1,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH=-25kJ·mol-1,下列说法正确的是| A.2mol甲醇参加反应,放出的热量为25kJ |
| B.浓硫酸在反应中只作催化剂 |
| C.2v(CH3OH)=v(CH3OCH3) |
| D.升高温度或增大压强均可加快反应速率 |
【知识点】 硫酸 影响化学反应速率的因素 可逆反应及反应限度解读

A.该反应的热化学方程式为:X(g)+3Y(g) 2Z(g);△H>0 2Z(g);△H>0 |
| B.若其它条件不变,升高温度,正、逆反应速率均增大,X的转化率减小 |
| C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
【知识点】 化学平衡的移动及其影响因素 化学平衡图像分析

| A.加入催化剂,减小了反应的热效应 |
| B.加入催化剂,可提高H2O2的平衡转化率 |
| C.H2O2分解的热化学方程式:H2O2→H2O+O2+Q |
| D.反应物的总能量高于生成物的总能量 |
①H2S(g)+
 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1②2H2S(g)+SO2(g)=
 S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2③H2S(g)+
 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
| A.△H4=2/3(△H1+△H2-3△H3) |
| B.△H4=2/3(3△H3-△H1-△H2) |
| C.△H4=3/2(△H1+△H2-3△H3) |
| D.△H4=3/2(△H1-△H2-3△H3) |
【知识点】 化学反应热的计算 盖斯定律及其有关计算
 aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是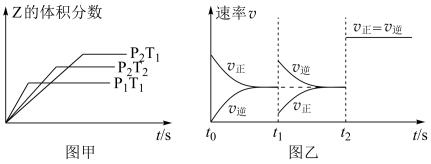
| A.图甲,P1>P2,a < 3 |
| B.图甲,T1<T2,Q>0 |
| C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体 |
| D.图乙,如果a=3, t2时表示向体系中加入了催化剂 |
【知识点】 化学平衡的移动及其影响因素 化学平衡图像分析
| A.酸使亚氯酸的氧化性增强 | B.溶液中的H+起催化作用 |
| C.溶液中的Cl-起催化作用 | D.逸出的ClO2使生成物的浓度降低 |
【知识点】 催化剂对化学反应速率的影响解读
(
 )来研究反应物浓度与反应速率的关系。反应速率
)来研究反应物浓度与反应速率的关系。反应速率 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:| 实验序号 | 初始浓度 | 溴颜色消失所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.0010 | 290 |
| ② | 1.60 | 0.20 | 0.0010 | 145 |
| ③ | 0.80 | 0.40 | 0.0010 | 145 |
| ④ | 0.80 | 0.20 | 0.0020 | 580 |
A.增大 增大 增大 | B.实验②和③的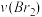 相等 相等 |
C.增大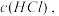 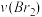 增大 增大 | D.增大 , ,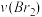 增大 增大 |
【知识点】 影响化学反应速率的因素 浓度对化学反应速率的影响解读
二、未知 添加题型下试题
 PCl5(g) ΔH<0。有关数据如下:
PCl5(g) ΔH<0。有关数据如下:| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
| A.10 min内,v(Cl2)=0.04 mol/(L·min) |
| B.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 |
| C.当容器中Cl2为1.2 mol时,反应达到平衡 |
| D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
三、单选题 添加题型下试题
 xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。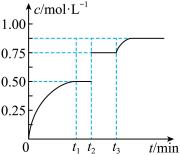
下列说法正确的是
| A.反应方程式中的x=1 | B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是移去少量物质Q | D.t1~t3间该反应的平衡常数均为4 |
【知识点】 影响化学反应速率的外因 化学平衡图像分析
四、解答题 添加题型下试题
 2NO(g) ΔH>0。已知该反应在2404℃,平衡常数K=6.4×10-3。请回答下列问题。
2NO(g) ΔH>0。已知该反应在2404℃,平衡常数K=6.4×10-3。请回答下列问题。(1)该反应的平衡常数表达式为
(2)该温度下,向2L密闭容器中充入N2和O2各2mol,平衡时,N2的转化率是
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是
A.
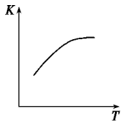 B.
B.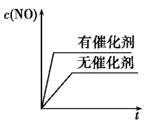 C.
C.
 2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为bkJ。
2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为bkJ。(1)比较a
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为ckJ,C的浓度
(3)在相同条件下要想得到2aKJ热量,加入各物质的物质的量可能是
| A.4molA和2mol | B.B.4molA、2molB和2molC |
| C.4molA和4molB | D.6molA和4molB |
| A.及时分离出C气体 | B.适当升高温度 |
| C.增大B的浓度 | D.选择高效催化剂 |
(6)在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量
五、填空题 添加题型下试题
(1)达到平衡时,C在反应混合气中的体积分数是
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C
【知识点】 化学平衡的有关计算
六、解答题 添加题型下试题

回答下列问题:
(1)钛铁矿中铁元素化合价
(2)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为

(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:分析40℃时TiO2·xH2O转化率最高的原因
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
(4)Li2Ti5O15中Ti的化合价为+4,其中负一价的氧与负二价的氧的质量比为
(5)写出滤液②

 FePO4沉淀的离子方程式
FePO4沉淀的离子方程式试卷分析
试卷题型(共 34题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 化学用语综合判断 原子结构示意图、离子结构示意图 | |
| 2 | 0.85 | 硝酸的强氧化性 化学科学对人类文明发展的意义 | |
| 3 | 0.85 | 固体废弃物的处理 “白色污染”危害及防治 工业固体废弃物的处理 金属废弃物的回收及利用 | |
| 4 | 0.85 | 含硅的无机非金属材料 化学对材料制造和应用的作用 传统硅酸盐材料 | |
| 5 | 0.85 | 能源开发利用新理念 化石能源 | |
| 6 | 0.94 | 硅酸 食品添加剂 | |
| 7 | 0.65 | 化学平衡状态的判断方法 | |
| 8 | 0.85 | 离子反应的发生及书写 | |
| 9 | 0.85 | 热化学方程式 中和热 | |
| 10 | 0.85 | 能量的相互转化 化学能与热能的相互转化 化学能与物质稳定性之间的关系 反应热大小比较 | |
| 11 | 0.94 | 盖斯定律及其有关计算 盖斯定律与热化学方程式 | |
| 12 | 0.85 | 离子共存 无附加条件的离子共存 | |
| 13 | 0.65 | 阿伏加德罗常数的求算 | |
| 14 | 0.65 | 铝的钝化 铝盐与强碱溶液反应 化学实验方案的设计与评价 物质性质实验方案的设计 | |
| 15 | 0.65 | 焰色试验 Fe3+的检验 物质的检验 | |
| 16 | 0.65 | 氧化还原反应有关计算 | |
| 17 | 0.85 | 化学反应速率与化学计量数之间的关系 | |
| 18 | 0.94 | 化学反应的速率 化学反应速率的定量表示方法 化学反应速率计算 化学反应速率与化学计量数之间的关系 | |
| 19 | 0.65 | 浓度对化学平衡移动的影响 | |
| 20 | 0.85 | 元素周期律的应用 元素非金属性强弱的比较方法 氢键对物质性质的影响 | |
| 21 | 0.85 | 硫酸 影响化学反应速率的因素 可逆反应及反应限度 | |
| 22 | 0.65 | 化学平衡的移动及其影响因素 化学平衡图像分析 | |
| 23 | 0.85 | 化学反应中热量(Q)及(△H)相关判断 催化剂对化学反应速率的影响 化学平衡的移动及其影响因素 | |
| 24 | 0.65 | 化学反应热的计算 盖斯定律及其有关计算 | |
| 25 | 0.65 | 化学平衡的移动及其影响因素 化学平衡图像分析 | |
| 26 | 0.85 | 催化剂对化学反应速率的影响 | |
| 27 | 0.65 | 氯气的实验室制法 氨气的实验室制法 | |
| 28 | 0.65 | 影响化学反应速率的因素 浓度对化学反应速率的影响 | |
| 30 | 0.65 | 影响化学反应速率的外因 化学平衡图像分析 | |
| 二、未知 | |||
| 29 | 0.4 | 化学平衡常数的影响因素及应用 转化率的相关计算及判断 | 未知 |
| 三、解答题 | |||
| 31 | 0.65 | 化学平衡图像分析 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 转化率的相关计算及判断 | 原理综合题 |
| 32 | 0.4 | 化学平衡的有关计算 化学平衡的移动 温度对化学平衡移动的影响 等效平衡理论的综合应用 | 原理综合题 |
| 34 | 0.4 | 物质分离、提纯综合应用 常见无机物的制备 物质制备的探究 | 工业流程题 |
| 四、填空题 | |||
| 33 | 0.65 | 化学平衡的有关计算 | |

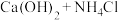

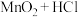 (浓)
(浓)
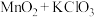

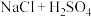 (浓)
(浓)


