模拟卷02——2020年秋高二化学开学摸底考试卷(全国通用)
全国
高二
开学考试
2020-08-07
380次
整体难度:
容易
考查范围:
认识化学科学、化学与STSE、常见无机物及其应用、化学实验基础、有机化学基础、物质结构与性质、化学反应原理
一、单选题 添加题型下试题
| A.CO2 | B.Na2O2 | C.SiO2 | D.CaO |
【知识点】 酸、碱、盐、氧化物的概念及其相互联系解读
| A.SO2 | B.NH3 | C.NO2 | D.CO2 |
【知识点】 氧化还原反应基本概念
| A.质量为18g | B.含氧原子数约为6.02×1023 |
| C.含电子数约为10×6.02×1023 | D.标准状况下的体积约为22.4L |
| 选项 | A | B | C | D |
| 垃圾 | 废金属 | 剩饭菜 | 过期药品 | 废塑料瓶 |
垃圾分类 |  可回收物 |  厨余垃圾 |  有害垃圾 |  其他垃圾 |
| A.A | B.B | C.C | D.D |
【知识点】 固体废弃物的处理
A.氨基(-NH2)的电子式: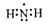 |
B.钾离子的结构示意图:  |
C.二氧化碳分子的比例模型: |
D.碳酸的电离方程式:H2CO3 CO32-+ 2H+ CO32-+ 2H+ |
【知识点】 有关粒子结构的化学用语 化学用语综合判断
| A.海带提碘 | B.氯碱工业 |
| C.氨碱法制碱 | D.海水提溴 |
A.提取食盐后母液 含Br2的液体 含Br2的液体 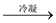 粗溴 粗溴 纯溴 纯溴 |
B.石英砂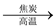 粗硅 粗硅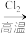 粗四氯化硅 粗四氯化硅 高纯硅 高纯硅 |
C.FeS2 SO2 SO2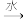 H2SO3 H2SO3 H2SO4 H2SO4 |
D.铝土矿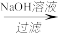 Na[Al(OH)4]溶液 Na[Al(OH)4]溶液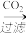 Al(OH)3 Al(OH)3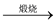 Al2O3 Al2O3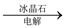 铝 铝 |
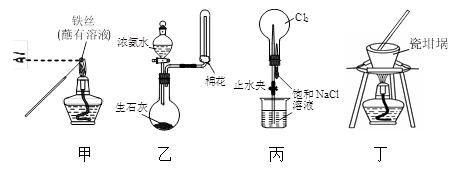
| A.用装置甲检验溶液中是否有K+ |
| B.用装置乙制取并收集少量NH3 |
| C.用装置丙进行喷泉实验 |
| D.用装置丁加热熔融NaOH固体 |
【知识点】 物质性质实验方案的设计解读
| A.蔗糖是一种还原性糖,能够发生银镜反应 |
| B.油脂水解的共同产物是甘油,与乙醇互为同系物 |
| C.植物油、裂化汽油均能使酸性高锰酸钾褪色 |
| D.糖类、油脂和蛋白质一定都含有碳、氢、氧和氮元素 |
| A.原子序数A>B | B.电子总数A->B2+ |
| C.离子半径A->B2+ | D.原子半径A>B |
| A.石油在国民经济中有着重要地位,被誉为“黑色的金子”“工业的血液” |
| B.乙烯是一种植物生长调节剂,也是水果的催熟剂,其产量可衡量国家石油化工水平 |
| C.德国科学家凯库勒从梦境中得到启发,成功地提出了关于苯环结构的学说 |
| D.1869年俄国化学家舍勒根据原子半径大小排列出了第一张元素周期表 |
【知识点】 乙烯 苯 元素周期表结构 石油物理性质及组成成分解读
| A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 |
| B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 |
| C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 |
| D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 |
| A.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O |
| B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===2Fe2++Fe3++4H2O |
| C.将金属铝加入NaOH溶液中:2Al+2OH-+2H2O===2AlO2-+3H2↑ |
| D.金属钠与水反应:2Na+2H2O===2Na++2OH-+H2↑ |
【知识点】 离子方程式的正误判断解读
A.三联苯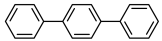 与四联苯 与四联苯 互为同系物 互为同系物 |
| B.苯、乙酸、乙醇均能发生取代反应 |
C.可用燃烧法鉴别丙烯、苯、 |
| D.石油分馏属于物理变化,煤的干馏属于化学变化 |
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 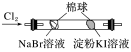 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有强氧化性 |
| A.A | B.B | C.C | D.D |
【知识点】 氧化性、还原性强弱的比较解读 硝酸 氨水 化学实验方案的设计与评价
| A.Y的单质的氧化性比W的弱 |
| B.原子半径:r(X)< r(Y)< r(W)< r(Z) |
| C.化合物X2Y和Z2Y3,含有相同类型的化学键 |
| D.元素Y、Z形成的化合物熔点高,不能用电解法制备其中的金属单质 |
| 选项 | 甲 | 乙 |  |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH | |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A.A | B.B | C.C | D.D |
【知识点】 离子反应的发生及书写 离子方程式的书写解读 离子方程式的正误判断解读
(
 )来研究反应物浓度与反应速率的关系。反应速率
)来研究反应物浓度与反应速率的关系。反应速率 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:| 实验序号 | 初始浓度 | 溴颜色消失所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.0010 | 290 |
| ② | 1.60 | 0.20 | 0.0010 | 145 |
| ③ | 0.80 | 0.40 | 0.0010 | 145 |
| ④ | 0.80 | 0.20 | 0.0020 | 580 |
A.增大 增大 增大 | B.实验②和③的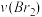 相等 相等 |
C.增大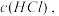 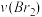 增大 增大 | D.增大 , ,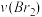 增大 增大 |
【知识点】 影响化学反应速率的因素 浓度对化学反应速率的影响解读
 Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A.0~4s容器内的压强逐渐增大 |
| B.生成Cl2的平均反应速率,0~2s比2~4s快 |
| C.8s时向容器中再充入一定量的氦气,反应速率又会加快 |
| D.该条件下,COCl2的最大转化率为40% |
【知识点】 化学平衡的有关计算 化学平衡题中基于图表数据的相关计算解读
二、解答题 添加题型下试题
| 84消毒液 有效成分 NaClO 规格 1 000 ml 质量分数 25% 密度 1.19 g·cm-3 |
(1)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL该消毒液。下列说法正确的是
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器

B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(3)配制溶液的过程如下,该同学的错误步骤有


A.1处 B.2处 C.3处 D.4处
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 L 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。需用浓硫酸的体积为
【知识点】 一定物质的量浓度的溶液的配制
三、填空题 添加题型下试题
(1)科学家最近研制出利用太阳能产生激光,使海水分解。太阳光分解海水时,光能转化为
(2)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。若断开1mol氢气中的化学键消耗的能量为Q1kJ,断开1mol氧气中的化学键消耗的能量为Q2kJ,形成1mol水中的化学键释放的能量为Q3kJ,则下列关系正确的是
A.Q1+Q2<Q3 B.2Q1+Q2<2Q3 C.2Q1+Q2>2Q3 D.Q1+Q2>Q3
(3)反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势如图所示:
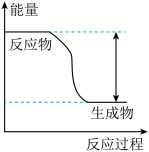
①该反应为
②若要使该反应的反应速率加快,下列措施可行的是
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
③若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
四、解答题 添加题型下试题

请回答下列问题:
(1)写出C的结构简式:
(2)写出下列反应的反应类型:①
(3)写出下列反应的化学方程式:①
(4)某同学欲用下图装置制备物质C,将试管B中的物质C分离出来,用到的主要玻璃仪器有:烧杯、

(1)F在元素周期表中的位置为
(2)用电子式表示D2F的形成过程
(3)在2 L的密闭容器中,充入2 mol B2和3 mol A2,在一定条件下发生反应,5 s后测得A2为1.8 mol,则以B2的表示的反应速率v(B2)为
(4)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为
(5)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol A4B4熔融电离生成两种离子各1mol,则该物质熔融时的电离方程式为
(6)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。
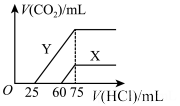
则曲线Y表明M中的溶质为
试卷分析
试卷题型(共 24题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 酸、碱、盐、氧化物的概念及其相互联系 | |
| 2 | 0.94 | 四种基本反应类型 | |
| 3 | 0.85 | 氧化还原反应基本概念 | |
| 4 | 0.94 | 阿伏加德罗常数的求算 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 5 | 0.85 | 固体废弃物的处理 | |
| 6 | 0.85 | 有关粒子结构的化学用语 化学用语综合判断 | |
| 7 | 0.65 | 氧化还原反应基本概念 氯气的工业制法 海水提取溴 海带中碘的提取及检验 | |
| 8 | 0.65 | 硅的制备 铝土矿提取铝的原理 常见无机物的制备 海水提取溴 | |
| 9 | 0.65 | 物质性质实验方案的设计 | |
| 10 | 0.65 | 同系物的判断 油脂的性质 蔗糖与麦芽糖组成与结构 石油裂化、裂解 | |
| 11 | 0.85 | 微粒半径大小的比较方法 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 12 | 0.85 | 乙烯 苯 元素周期表结构 石油物理性质及组成成分 | |
| 13 | 0.85 | 含硅的无机非金属材料 化学对材料制造和应用的作用 传统硅酸盐材料 | |
| 14 | 0.85 | 离子方程式的正误判断 | |
| 15 | 0.65 | 乙酸的酯化反应 物质的检验 石油分馏 煤的干馏 | |
| 16 | 0.65 | 氧化性、还原性强弱的比较 硝酸 氨水 化学实验方案的设计与评价 | |
| 17 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 根据物质性质进行元素种类推断 结合物质计算的元素周期律、元素周期表相关推断 | |
| 18 | 0.65 | 离子反应的发生及书写 离子方程式的书写 离子方程式的正误判断 | |
| 19 | 0.65 | 影响化学反应速率的因素 浓度对化学反应速率的影响 | |
| 20 | 0.65 | 化学平衡的有关计算 化学平衡题中基于图表数据的相关计算 | |
| 二、解答题 | |||
| 21 | 0.4 | 一定物质的量浓度的溶液的配制 | 实验探究题 |
| 23 | 0.65 | 乙醇催化氧化 乙酸乙酯制备实验的综合考查 淀粉和纤维素组成与结构 糖类生产乙醇 | 有机推断题 |
| 24 | 0.4 | 电离方程式 碳酸钠、碳酸氢钠混合物的有关求算 热化学方程式 根据原子结构进行元素种类推断 | 无机推断题 |
| 三、填空题 | |||
| 22 | 0.65 | 化学反应中能量变化的原因 吸热反应和放热反应 原电池电子流向判断及应用 原电池电极反应式书写 | |



