鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题
全国
高一
课后作业
2018-10-08
405次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、有机化学基础、化学实验基础、化学反应原理
鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题
全国
高一
课后作业
2018-10-08
405次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、有机化学基础、化学实验基础、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
1. 下列物质的分类正确的是
| 碱 | 酸 | 盐 | 酸性氧化物 | 混合物 | |
| A. | NaOH | H2SO4 | BaCO3 | CO2 | 硫酸 |
| B. | KOH | HCl | NaCl | CO | 豆浆 |
| C. | Mg(OH)2 | CH3COOH | CaCl2 | SO2 | 盐酸 |
| D. | 纯碱 | HNO3 | CaCO3 | SO3 | 空气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-12-09更新
|
320次组卷
|
3卷引用:2016-2017学年四川省成都市树德中学高一上学期10月月考化学试卷
2. 下列化工生产过程中,未涉及氧化还原反应的是( )
| A.海带提碘 | B.氯碱工业 |
| C.氨碱法制碱 | D.海水提溴 |
您最近一年使用:0次
2016-06-13更新
|
2542次组卷
|
49卷引用:2016年全国普通高等学校招生统一考试化学(上海卷精编版)
2016年全国普通高等学校招生统一考试化学(上海卷精编版)2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届内蒙古临河区巴彦淖尔一中高三上9月月考化学卷2017届湖北省襄阳五中高三上学期9月月考化学试卷2017届河南省郑州一中高三上期中化学试卷2016-2017学年江苏省扬州中学高一上期中化学卷河南省安阳市第三十五中学2016-2017学年高二下学期期末考试化学试题江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题内蒙古包头市2018届高三第一次模拟考试理综化学试题上海市虹口区2018届高三下学期教学质量监控(二模)化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高二下学期期末考试化学试题(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)学科网2019年高考化学一轮复习讲练测2.3 氧化还原反应的基本概念 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】福建省厦门市湖滨中学2019届高三上学期第一次阶段检测化学试题江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题四川省成都市七中实验学校2019届高三上学期10月月考化学试题【市级联考】四川省攀枝花市2019届高三上学期第一次统一考试化学试题河北省衡水市安平县安平中学2019届高三上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)安徽省阜阳市临泉县第一中学2019届高三上学期第三次模拟(12月)化学试题河北省盐山中学2018-2019学年高一上学期12月月考化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)江苏省扬州市扬州中学2019届高三上学期12月月考化学试题2016年全国普通高等学校招生统一考试化学(上海卷参考版)(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题湖南省邵阳市邵东县第十中学2020届高三9月月考(读论班)化学试题2020届二轮复习 氧化还原反应 专题卷(全国通用)云南省西双版纳傣族自治州勐海县第三中学2019-2020学年高一上学期期末考试化学试题江苏省扬州市江都区大桥高级中学2020届高三上学期第三次学情调研化学试题新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题第八章 化学与可持续发展 模拟高考——C挑战区 夯实基础(人教版(2019)第二册)第四章 化学与自然资源的开发利用 模拟高考——C挑战区 夯实基础(人教版必修2)(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训模拟卷02——2020年秋高二化学开学摸底考试卷(全国通用)(已下线)小题必刷07 氧化还原反应概念及应用——2021年高考化学一轮复习小题必刷(通用版)必修第二册RJ第八章 C挑战区 模拟高考高一必修第一册(苏教2019)专题3 第三单元 海洋化学资源的综合利用3重庆市凤鸣山中学校2021届高三10月月考化学试题北京市丰台区2021届高三上学期期末考试化学试题(人教版2019)必修第二册 第八章 化学与可持续发展 第一节 自然资源的开发利用天津市杨村第一中学2020-2021学年高三下学期开学开学考试化学试题上海市静安区2021届高三下学期质量监控(4月二模)化学试题(已下线)专题14 海水资源的综合利用 环境保护与绿色化学 (限时精炼)-2022年高三毕业班化学常考点归纳与变式演练天津市南开区2022届高三模拟考试(二模)化学试题福建省平潭翰英中学2022-2023学年高三上学期第一次月考化学试题四川省南充高级中学2022-2023学年高二上学期1月期末考试化学试题
单选题
|
较易(0.85)
3. 生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
| A.将盐卤或石膏加入豆浆,制成豆腐。 |
| B.一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞。 |
| C.泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用。 |
| D.清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象。 |
您最近一年使用:0次
2016-12-09更新
|
435次组卷
|
3卷引用:2012届浙江省杭师大附中高三上学期第一次月考化学试卷
(已下线)2012届浙江省杭师大附中高三上学期第一次月考化学试卷鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题吉林省松原市前郭蒙中2020-2021学年高二下学期期末考试化学试题
单选题
|
容易(0.94)
名校
4. 用石灰水保存鲜蛋是一种化学保鲜法。石灰水能保存鲜蛋的原理是
①石灰具有强碱性,杀菌能力强
②Ca(OH)2能与鲜蛋呼出的CO2反应,生成碳酸钙薄膜,起保护作用
③石灰水是电解质溶液,能使蛋白质凝聚
④石灰水能渗入蛋内中和酸性物质
①石灰具有强碱性,杀菌能力强
②Ca(OH)2能与鲜蛋呼出的CO2反应,生成碳酸钙薄膜,起保护作用
③石灰水是电解质溶液,能使蛋白质凝聚
④石灰水能渗入蛋内中和酸性物质
| A.①② | B.③④ | C.②④ | D.①③ |
您最近一年使用:0次
2016-12-09更新
|
617次组卷
|
7卷引用:2011-2012年浙江省苍南县龙港第二高级中学高二上学期期中联考化学(文)试卷
(已下线)2011-2012年浙江省苍南县龙港第二高级中学高二上学期期中联考化学(文)试卷(已下线)2012年人教版高中化学选修1 1.3生命的基础-蛋白质练习卷(已下线)2013届安徽省太湖二中高三上学期期末前月考化学试卷【全国百强校】江苏省丹阳高级中学苏教版高中化学选修五:专题5 生命活动的物质基础测试题(A)鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题安徽省巢湖市柘皋中学2018-2019学年高二(文)上学期期中考试化学试题2019-2020广东省广州市广州中学高二上学期期中考试化学试卷(文科)
单选题
|
适中(0.65)
名校
6. 下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
| A.盐酸、水煤气、醋酸、干冰 | B.冰醋酸、福尔马林、硫酸钠、乙醇 |
| C.单甘油酯、混甘油酯、苛性钾、石灰石 | D.胆矾、漂白粉、氯化钾、氯气 |
【知识点】 无机物质的分类 非电解质、电解质物质类别判断解读
您最近一年使用:0次
2018-10-05更新
|
394次组卷
|
6卷引用:新课标2010-2011学年度上学期高三一轮复习单元测试1(新人教)
单选题
|
较难(0.4)
名校
7. 在0℃和101kPa的条件下,将2.00g氮气、1.40g氮气和1.60g氧气混合,该混合气体的体积是
| A.6.72L | B.7.84L | C.10.08L | D.13.44L |
您最近一年使用:0次
2017-09-25更新
|
590次组卷
|
3卷引用:河北省冀州市中学2017-2018学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
8. 下列离子方程式表达正确的是
A.用惰性电极电解氯化镁溶液:2Cl-+2H2O Cl2↑+H2↑+OH- Cl2↑+H2↑+OH- |
| B.碳酸氢钠溶液与过量澄清石灰反应:HCO3-+Ca2++OH-= CaCO3↓+ H2O |
| C.NaHS04溶液中滴入Ba(OH)2溶液至S042-完全沉淀:2H++S042-+Ba2++ OH-= BaS04↓+2 H2O |
D.向明矾溶液中滴加过量氨水:Al3++4NH3 H2O=Al02-+4NH4++2H2O H2O=Al02-+4NH4++2H2O |
【知识点】 离子方程式的正误判断解读 碳酸氢钠 铝三角转化解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
9. 下列离子方程式中正确的是( )
| A.在硫酸氢钾溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B.澄清石灰水与少量小苏打溶液混合:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C.少量金属钠加到冷水中:Na+2H2O=Na++2OH-+H2↑ |
| D.明矾水解:Al3++3H2O=Al(OH)3↓+3H+ |
【知识点】 离子反应的发生及书写 离子方程式的正误判断解读
您最近一年使用:0次
单选题
|
适中(0.64)
10. 下列叙述正确的是
| A.明矾、小苏打、醋酸、次氯酸均为电解质 |
| B.碘酒、牛奶、豆浆、漂白精均为胶体 |
| C.根据是否具有丁达尔现象可将分散系分为溶液、胶体和浊液 |
| D.物质可根据在水中或熔化状态下的导电性分为电解质与非电解质 |
【知识点】 物质的分类
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
11. Ⅰ、实验室要配制物质的量浓度为0.1 mol/L的NaOH溶液480 mL
(1)填表:
(2)若要计算该溶液溶质的质量分数,还需要的一个条件是______________ (用文字说明)。
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是_________________ (填字母)
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________ 。
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______ ;C中的现象是:___________ 。
(1)填表:
| 配制时应称量NaOH的质量/g | 已给仪器 | 配制时除已给仪器外还需要的其他仪器 |
| 烧杯、药匙、托盘天平 | |
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是
A.称量NaOH固体时,露置在空气的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
Ⅱ、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。

(1)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:
(2)若A中装有浓盐酸,B中装有固体KMnO4 ,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1 mol KMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:
【知识点】 氯气的制法 含硫化合物之间的转化解读 一定物质的量浓度的溶液的配制
您最近一年使用:0次
2018-10-05更新
|
195次组卷
|
2卷引用:鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题
解答题-实验探究题
|
较易(0.85)
12. 把10mL 淀粉胶体和5mL KCl溶液的混和体加入用半透膜制成的袋内,将此袋浸入蒸馏水中.2分钟后,用两支试管各取5mL 烧杯中的液体,并做如下实验:
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是_____________ ;
(2)向另一支试管里滴加少量碘水,其现象是______________ ;
(3)由上述实验得出的结论是____________________________ .
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是
(2)向另一支试管里滴加少量碘水,其现象是
(3)由上述实验得出的结论是
您最近一年使用:0次
2018-10-05更新
|
228次组卷
|
3卷引用:鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题
鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题2.1.2 胶体练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)衔接点21 分散系 胶体-2021年初升高化学无忧衔接
解答题-无机推断题
|
适中(0.65)
解题方法
13. 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是_____ ,证明Fe3+存在的现象是__________ 。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:_________________ 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
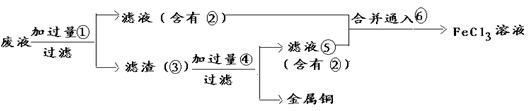
①请写出上述实验中③的化学式:_______
②配制并保存硫酸亚铁溶液时,常在其中加入_______________________
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为______ 。
①加入足量氯水 ②加入足量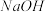 溶液 ③加入少量KSCN溶液
溶液 ③加入少量KSCN溶液
A、①③ B、③② C、③① D、①②③
④写出向②⑤的合并液中通入⑥的离子方程式__________________
(1)检验溶液中Fe3+存在的试剂是
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

①请写出上述实验中③的化学式:
②配制并保存硫酸亚铁溶液时,常在其中加入
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为
①加入足量氯水 ②加入足量
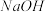 溶液 ③加入少量KSCN溶液
溶液 ③加入少量KSCN溶液A、①③ B、③② C、③① D、①②③
④写出向②⑤的合并液中通入⑥的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
解题方法
14. FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁

请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________ .
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________ ,C为________ .为防止污染空气,实验时应在F处连接盛________ 的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________ ,②________ .
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________ 。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明:______________________________ ;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:_____ 。
Ⅰ.实验室制备FeBr2
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁

请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为
(3)反应过程中要不断通入CO2,其主要作用是①
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
设计实验证明假设2是正确的
(3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明:
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:
您最近一年使用:0次
2016-12-09更新
|
806次组卷
|
3卷引用:2017届江西省师大附中高三上学期10月月考化学试卷
解答题-原理综合题
|
适中(0.65)
解题方法
15. 人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
(1)用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为________________________________ 。
(2)如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为__________________________ 。
(3)有人用土法治疗胃酸过多,方法是:将鸡蛋壳洗净、烧焦、磨细服用。据说这种疗法效果还不错。请用学过的知识分析其中的道理。__________________________________ 。
(4)氢氧化钠也能中和胃酸,为什么不用氢氧化钠来治疗胃酸过多?
________________________________________________________________________ 。
(1)用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为
(2)如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为
(3)有人用土法治疗胃酸过多,方法是:将鸡蛋壳洗净、烧焦、磨细服用。据说这种疗法效果还不错。请用学过的知识分析其中的道理。
(4)氢氧化钠也能中和胃酸,为什么不用氢氧化钠来治疗胃酸过多?
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
适中(0.65)
16. 现有下列物质①NaCl晶体 ②液态醋酸③干冰④铜 ⑤蔗糖⑥熔融的KNO3
⑦硫酸溶液⑧酒精⑨液氧 ⑩BaSO4固体
(1)以上物质能导电的是________________
(2)以上物质属于电解质的是________________
(3)以上物质属于非电解质的是_________________
⑦硫酸溶液⑧酒精⑨液氧 ⑩BaSO4固体
(1)以上物质能导电的是
(2)以上物质属于电解质的是
(3)以上物质属于非电解质的是
【知识点】 电解质、非电解质概念解读 非电解质、电解质物质类别判断解读
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-无机推断题
|
容易(0.94)
名校
解题方法
17. 某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
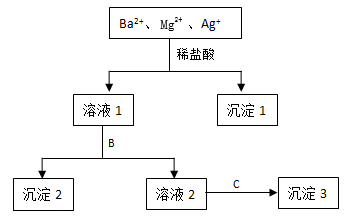
(1)沉淀1的化学式为_________ ,生成该沉淀的离子方程式为______________ 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为______________ 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为______________ 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为_______ mol·L-1。

(1)沉淀1的化学式为
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为
您最近一年使用:0次
2017-02-17更新
|
895次组卷
|
6卷引用:2016-2017学年河南省南阳市高一上学期期中化学试卷
解答题-无机推断题
|
适中(0.65)
18. A、B、C三种无色可溶性盐分别是由Na+、Ag+、Ba2+、Cl-、NO3-、CO32-中不同的阴、阳离子所组成.经实验A溶液、B溶液均可与盐酸反应,其中A产生白色沉淀,B产生气泡.则A为_________ 、B为______ 、C为__________ .
写出A与盐酸反应的离子方程式____________________________________________ .
写出B与盐酸反应的离子方程式_____________________________________________ .
写出A与盐酸反应的离子方程式
写出B与盐酸反应的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中(0.65)
名校
解题方法
19. A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。

试确定A、B、C、D、X各代表何种溶液。
A:________ ,B:__________ ,C:_________ ,D:_________ ,X:_________ 。

试确定A、B、C、D、X各代表何种溶液。
A:
【知识点】 离子反应在化合物组成的分析、鉴定的应用解读 离子的检验
您最近一年使用:0次
2017-08-24更新
|
305次组卷
|
11卷引用:2010年辽宁省本溪县高一上学期10月月考化学试题
(已下线)2010年辽宁省本溪县高一上学期10月月考化学试题(已下线)2010年四川省乐山一中高一上学期10月月考化学卷(已下线)2011-2012年辽宁省抚顺高级中学高一10月月考化学试卷(已下线)2012年苏教版高中化学必修1 1.2研究物质的实验方法练习卷2014-2015湖北省武汉华中师大一附高一上学期期中化学试卷2015-2016学年吉林省扶余市第一中学高一上学期第一次月考化学试卷2015-2016学年广西武鸣高级中学高二上段考理化学试卷山西省忻州市第一中学2016-2017学年高一必修一:1.1.2化学实验基本方法同步练习化学试题鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题(已下线)2019年8月25日《每日一题》 必修1 ——每周一测作业(二十四) 离子反应的应用
解答题-工业流程题
|
较难(0.4)
名校
解题方法
20. 工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
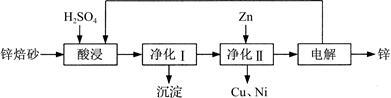
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为____ 。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:____ 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________ mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________ 。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是____ 。
(4)本流程中可以循环利用的物质除锌外还有________ 。

(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:
②25 ℃时,pH=3的溶液中,c(Fe3+)=
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是
(4)本流程中可以循环利用的物质除锌外还有
您最近一年使用:0次
2015-12-16更新
|
403次组卷
|
8卷引用:2014届江苏省扬州市扬州中学高三上学期10月月考化学试卷
(已下线)2014届江苏省扬州市扬州中学高三上学期10月月考化学试卷(已下线)2014届四川省凉山州高三第二次诊断性测试理综化学试卷2015届江苏省扬州中学高三3月期初考试化学试卷2016届广西钦州港经济技术开发区中学高三上学期期中测试化学试卷2015-2016学年江苏省淮阴中学高二下期末化学试卷鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题黑龙江省大庆铁人中学2020届高三上学期期中考试化学试题云南省楚雄彝族自治州民族中学2021-2022学年高三下学期3月月考化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、化学与STSE、有机化学基础、化学实验基础、化学反应原理
试卷题型(共 20题)
题型
数量
单选题
10
解答题
9
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 树状分类法 无机物质的分类 | |
| 2 | 0.65 | 氧化还原反应基本概念 氯气的工业制法 海水提取溴 海带中碘的提取及检验 | |
| 3 | 0.85 | 胶体 胶体的性质和应用 | |
| 4 | 0.94 | 胶体的性质和应用 离子反应的发生及书写 蛋白质的变性 化学科学对人类文明发展的意义 | |
| 5 | 0.85 | 电解质 | |
| 6 | 0.65 | 无机物质的分类 非电解质、电解质物质类别判断 | |
| 7 | 0.4 | 气体摩尔体积概念 22.4L/mol适用条件 结合气体物质与NA相关推算 根据n=m/M进行相关计算 | |
| 8 | 0.65 | 离子方程式的正误判断 碳酸氢钠 铝三角转化 | |
| 9 | 0.65 | 离子反应的发生及书写 离子方程式的正误判断 | |
| 10 | 0.64 | 物质的分类 | |
| 二、解答题 | |||
| 11 | 0.65 | 氯气的制法 含硫化合物之间的转化 一定物质的量浓度的溶液的配制 | 实验探究题 |
| 12 | 0.85 | 胶体 胶体的性质和应用 氯离子的检验 | 实验探究题 |
| 13 | 0.65 | 铁盐 铁盐的检验 依据Fe3+与其他物质氧化性强弱关系的相关计算 铁盐与亚铁盐鉴别试剂的选择 | 无机推断题 |
| 14 | 0.4 | 亚铁盐 化学实验基础操作 化学实验探究 物质性质的探究 | 实验探究题 |
| 15 | 0.65 | 离子方程式的书写 碳酸氢钠与酸反应 药物的合理使用 | 原理综合题 |
| 17 | 0.94 | 离子反应的发生及书写 离子反应的实际应用 离子反应在化合物组成的分析、鉴定的应用 | 无机推断题 |
| 18 | 0.65 | 离子方程式的书写 离子反应在化合物组成的分析、鉴定的应用 离子的检验 | 无机推断题 |
| 19 | 0.65 | 离子反应在化合物组成的分析、鉴定的应用 离子的检验 | 无机推断题 |
| 20 | 0.4 | 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 三、填空题 | |||
| 16 | 0.65 | 电解质、非电解质概念 非电解质、电解质物质类别判断 | |



