江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
江苏
高三
开学考试
2017-09-12
334次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、常见无机物及其应用、化学反应原理、化学实验基础、有机化学基础、物质结构与性质
江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
江苏
高三
开学考试
2017-09-12
334次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、常见无机物及其应用、化学反应原理、化学实验基础、有机化学基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
您最近一年使用:0次
2017-09-09更新
|
110次组卷
|
2卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
2. 下列化工生产过程中,未涉及氧化还原反应的是( )
| A.海带提碘 | B.氯碱工业 |
| C.氨碱法制碱 | D.海水提溴 |
您最近一年使用:0次
2016-06-13更新
|
2542次组卷
|
49卷引用:2016年全国普通高等学校招生统一考试化学(上海卷精编版)
2016年全国普通高等学校招生统一考试化学(上海卷精编版)2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届内蒙古临河区巴彦淖尔一中高三上9月月考化学卷2017届湖北省襄阳五中高三上学期9月月考化学试卷2017届河南省郑州一中高三上期中化学试卷2016-2017学年江苏省扬州中学高一上期中化学卷河南省安阳市第三十五中学2016-2017学年高二下学期期末考试化学试题江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题内蒙古包头市2018届高三第一次模拟考试理综化学试题上海市虹口区2018届高三下学期教学质量监控(二模)化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2017-2018学年高二下学期期末考试化学试题(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)学科网2019年高考化学一轮复习讲练测2.3 氧化还原反应的基本概念 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】福建省厦门市湖滨中学2019届高三上学期第一次阶段检测化学试题江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题鲁科版2018-2019学年高一化学必修一第二单元元素与物质世界练习题四川省成都市七中实验学校2019届高三上学期10月月考化学试题【市级联考】四川省攀枝花市2019届高三上学期第一次统一考试化学试题河北省衡水市安平县安平中学2019届高三上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)安徽省阜阳市临泉县第一中学2019届高三上学期第三次模拟(12月)化学试题河北省盐山中学2018-2019学年高一上学期12月月考化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)江苏省扬州市扬州中学2019届高三上学期12月月考化学试题2016年全国普通高等学校招生统一考试化学(上海卷参考版)(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点福建省平和县第一中学2018-2019学年高二下学期期末考试化学试题湖南省邵阳市邵东县第十中学2020届高三9月月考(读论班)化学试题2020届二轮复习 氧化还原反应 专题卷(全国通用)云南省西双版纳傣族自治州勐海县第三中学2019-2020学年高一上学期期末考试化学试题江苏省扬州市江都区大桥高级中学2020届高三上学期第三次学情调研化学试题新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题第八章 化学与可持续发展 模拟高考——C挑战区 夯实基础(人教版(2019)第二册)第四章 化学与自然资源的开发利用 模拟高考——C挑战区 夯实基础(人教版必修2)(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训模拟卷02——2020年秋高二化学开学摸底考试卷(全国通用)(已下线)小题必刷07 氧化还原反应概念及应用——2021年高考化学一轮复习小题必刷(通用版)必修第二册RJ第八章 C挑战区 模拟高考高一必修第一册(苏教2019)专题3 第三单元 海洋化学资源的综合利用3重庆市凤鸣山中学校2021届高三10月月考化学试题北京市丰台区2021届高三上学期期末考试化学试题(人教版2019)必修第二册 第八章 化学与可持续发展 第一节 自然资源的开发利用天津市杨村第一中学2020-2021学年高三下学期开学开学考试化学试题上海市静安区2021届高三下学期质量监控(4月二模)化学试题(已下线)专题14 海水资源的综合利用 环境保护与绿色化学 (限时精炼)-2022年高三毕业班化学常考点归纳与变式演练天津市南开区2022届高三模拟考试(二模)化学试题福建省平潭翰英中学2022-2023学年高三上学期第一次月考化学试题四川省南充高级中学2022-2023学年高二上学期1月期末考试化学试题
单选题
|
适中(0.65)
名校
3. 下列有关物质的性质与用途具有对应关系的是
| A.SO2具有氧化性,可用于漂白纸浆 | B.NaHCO3能与碱反应,可用作焙制糕点的膨松剂 |
| C.Fe2(SO4)3易溶于水,可用作净水剂 | D.液氨汽化时吸收大量的热,可用作制冷剂 |
您最近一年使用:0次
2017-09-09更新
|
311次组卷
|
5卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
单选题
|
较易(0.85)
名校
4. 目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2 (g)+4H2(g)  CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,下列选项中各物理量的变化判断正确的是
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,下列选项中各物理量的变化判断正确的是
 CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,下列选项中各物理量的变化判断正确的是
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,下列选项中各物理量的变化判断正确的是| A.正反应速率减小 | B.逆反应速率增大 | C.平均相对分子质量不变 | D.转化率增大 |
【知识点】 影响化学反应速率的因素 化学平衡的移动及其影响因素
您最近一年使用:0次
2017-09-09更新
|
215次组卷
|
2卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
单选题
|
适中(0.65)
名校
5. 下列指定反应的离子方程式正确的是
| A.向FeCl3溶液中滴加HI溶液:Fe3++2I-=Fe2++I2 |
B.用铜电极电解氯化钠溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ |
您最近一年使用:0次
2017-09-09更新
|
248次组卷
|
3卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
单选题
|
适中(0.65)
名校
6. 下列有关电化学的说法正确的是
| A.铜的金属活泼性比铁弱,可在海轮外壳上镶入若干铜块以减缓铁腐蚀 |
| B.原电池中,一定由活泼性强的金属作负极,发生氧化反应 |
| C.原电池放电时的负极和电解池充电时的阴极均发生氧化反应 |
| D.可充电电池充电时,负极与电源负极相连,正极与电源正极相连 |
您最近一年使用:0次
2017-09-09更新
|
174次组卷
|
4卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.9 电化学基础江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题江苏省泰州市海陵区2021届高三上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
7. 下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ |
| C.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a>b |
| D.已知CH4(g)+H2O(g) = CO(g)+3 H2(g) ΔH=+206.1 kJ·mol–1,反应过程中使用催化剂,ΔH减小 |
您最近一年使用:0次
2017-09-09更新
|
284次组卷
|
4卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题13 化学反应与能量类选择题解题方法和策略陕西省西安中学2019-2020学年高二12月月考化学试题2020届高三化学二轮复习—— 化学能与热能【精编选择25题】
单选题
|
适中(0.64)
名校
8. 实验室制取下列气体的实验正确的是( )
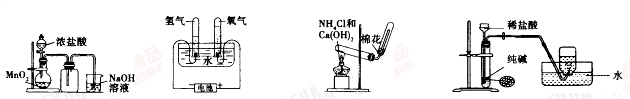

| A.实验室制氯气 | B.实验室制氧气 | C.实验室制氨气 | D.实验室制二氧化碳 |
【知识点】 化学实验基础
您最近一年使用:0次
2014-05-30更新
|
504次组卷
|
5卷引用:2014高考名师推荐化学--预测8
(已下线)2014高考名师推荐化学--预测8江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题山西省怀仁县第一中学2018届高三上学期第二次月考化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.15 物质的制备及实验方案设计与评价江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题
单选题
|
适中(0.65)
名校
9. 在给定的条件下,下列选项所示的物质间转化均能实现的是
A.S SO3 SO3 H2SO4 H2SO4 | B.NH3 N2 N2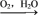 HNO3 HNO3 |
C.SiO2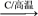 Si Si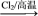 SiCl4 SiCl4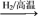 Si Si | D.海水 Mg(OH)2 Mg(OH)2  Mg Mg |
您最近一年使用:0次
2017-09-09更新
|
274次组卷
|
3卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
单选题
|
适中(0.65)
名校
10. 下列图示与对应的叙述不相符合 的是
A.图 表示燃料燃烧反应的能量变化 表示燃料燃烧反应的能量变化 |
B.图 表示酶催化反应的反应速率随反应温度的变化 表示酶催化反应的反应速率随反应温度的变化 |
C.图 表示可逆反应从加入反应物开始建立化学平衡的过程 表示可逆反应从加入反应物开始建立化学平衡的过程 |
D.图 表示可逆反应的平衡常数随反应物浓度的变化 表示可逆反应的平衡常数随反应物浓度的变化 |
您最近一年使用:0次
2017-09-09更新
|
367次组卷
|
3卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
单选题
|
适中(0.65)
名校
11. 阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,不正确 的是
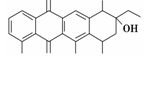

| A.阿克拉酮的分子式为C22H22O8 |
| B.分子中含有3个手性碳原子 |
| C.该分子一定条件下能发生取代、氧化、消去反应 |
| D.1 mol该物质最多可与3 mol NaOH反应 |
【知识点】 有机官能团的性质及结构
您最近一年使用:0次
2017-09-09更新
|
163次组卷
|
3卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
单选题
|
较难(0.4)
12. 常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 KSCN溶液中:Fe3+、NH4+、Br-、SO42- |
| B.c(OH-)/c(H+) =106的溶液中:NH4+ 、K+、AlO2-、NO3- |
| C.能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- |
| D.0.1 mol·L-1 Ca(NO3)2溶液中:Na+、NH4+、CO32-、CH3COO- |
【知识点】 限定条件下的离子共存解读 溶液的酸碱性与pH 酸碱中和滴定
您最近一年使用:0次
2017-09-09更新
|
774次组卷
|
2卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
单选题
|
适中(0.65)
真题
名校
13. 下列气体的制备和性质实验中,由现象得出的结论错误的是
| 选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-30更新
|
2730次组卷
|
30卷引用:2016年全国普通高等学校招生统一考试化学(上海卷精编版)
2016年全国普通高等学校招生统一考试化学(上海卷精编版)2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷2017届四川省龙泉中学、温江中学等五校高三上第一次联考化学卷2017届内蒙古临河区巴彦淖尔一中高三上9月月考化学卷2017届河南省开封市高三上学期10月定位考试化学试卷2017届河南省郑州一中高三上期中化学试卷2017届辽宁省六校协作体高三上学期期中化学试卷2016-2017学年天津市第一中学高一上期末化学卷内蒙古集宁一中(东校区)2016-2017学年高二下学期期末考试化学试题江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题广东省汕头市潮南实验学校2018届高三上学期入学摸底考试化学试题湖南省长郡中学2017-2018学年高二上学期第一次模块检测化学试题1贵州省遵义航天高级中学2018届高三第二次模拟(10月)理科综合化学试题天津市静海县第一中学2017-2018学年高一上学期期末终结性检测化学试题云南省腾冲市第八中学2017-2018学年高一下学期第一次月考化学试题江苏省常州市田家炳高级中学2019届高三上学期10月月考化学试题四川省成都市七中实验学校2019届高三上学期10月月考化学试题(已下线)解密17 物质的检验分离与提纯(教师版)——备战2018年高考化学之高频考点解密2016年全国普通高等学校招生统一考试化学(上海卷参考版)2019年秋高三化学复习强化练习—— 硫及其化合物人教版(2019)必修第二册第五章 模拟高考高一必修第一册(鲁科2019)考试帮 3 核心素养解读必修第二册RJ第5章挑战区 模拟高考(已下线)易错20 表格类化学实验选择题-备战2021年高考化学一轮复习易错题四川省峨眉第二中学校2021-2022学年高一下学期3月月考化学试题上海市川沙中学2021-2022学年高三下学期5月月考化学试题陕西省黄陵中学2021-2022学年高一上学期期末考试化学试题上海市嘉定区2023届高三一模化学试题北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(B)试题陕西省安康中学2023-2024学年高一下学期3月月考化学试卷
二、多选题 添加题型下试题
多选题
|
较难(0.4)
名校
解题方法
14. 25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c( )>c( )>c( )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
C.在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
| D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+) |
您最近一年使用:0次
2020-02-21更新
|
301次组卷
|
8卷引用:2017届江苏省苏州市高三上学期期初调研化学试卷
三、单选题 添加题型下试题
单选题
|
较难(0.4)
名校
15. 在温度T1和T2时,分别将0.50molCH4和1.20molNO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
下列说法正确的是
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
| A.T1时0~10minNO2的平均反应速率为0.15mol·L-1·min-1 |
| B.T2时CH4的平衡转化率为30.0% |
| C.保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动 |
| D.保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大 |
您最近一年使用:0次
2017-09-09更新
|
281次组卷
|
4卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
四、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
16. NaClO2的漂白能力是漂白粉的4~5倍,NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为________________________ (用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________ 。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________________________ 。
(4)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:
①盛放浓H2SO4仪器名称为____________ 。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为_________________ 、Na2O2+SO2===Na2SO4。

(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:
(3)吸收器中生成NaClO2的离子反应方程式为
(4)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:

①盛放浓H2SO4仪器名称为
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为
您最近一年使用:0次
2017-09-09更新
|
331次组卷
|
2卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
解答题-有机推断题
|
较难(0.4)
名校
解题方法
17. 酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:

(1)酮洛芬中含氧官能团的名称为_________ 和_______ 。
(2)化合物E的结构简式为________ ;由C→D的反应类型是_______ 。
(3)写出B→C的反应方程式_______________________________ 。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式___________________ 。
①能发生银镜反应;②与FeCl3发生显色反应;③分子中含有5种不同化学环境的氢。
(5)请写出以甲苯和乙醇为原料制备化合物 的合成路线流程图(无机试剂可任选)。合成路线流程图示例如图:
的合成路线流程图(无机试剂可任选)。合成路线流程图示例如图:

__________________________

(1)酮洛芬中含氧官能团的名称为
(2)化合物E的结构简式为
(3)写出B→C的反应方程式
(4)写出同时满足下列条件的A的一种同分异构体的结构简式
①能发生银镜反应;②与FeCl3发生显色反应;③分子中含有5种不同化学环境的氢。
(5)请写出以甲苯和乙醇为原料制备化合物
 的合成路线流程图(无机试剂可任选)。合成路线流程图示例如图:
的合成路线流程图(无机试剂可任选)。合成路线流程图示例如图:
您最近一年使用:0次
2016-12-09更新
|
440次组卷
|
7卷引用:2016届江苏省淮安、宿迁、连云港、徐州苏北四市高三上学期期末化学试卷
解答题-原理综合题
|
适中(0.65)
18. 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________ 。
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃; ③____________________________ 。
(3) 若pH过高,则对产品的影响是_________________________ 。
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。______________
(1) 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为
(2) 碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃; ③
(3) 若pH过高,则对产品的影响是
(4) 为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO2 0.448 L(已换算成标准状况下)。在所得溶液中加过量氨水,得到白色沉淀,经过滤、洗涤沉淀、充分灼烧得到1.02g固体。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程)。
您最近一年使用:0次
2017-09-09更新
|
293次组卷
|
4卷引用:2017届江苏省通州高级中学高三上第一次测试化学试卷
解答题-原理综合题
|
适中(0.65)
19. 甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g) ===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g) ===2H2O(g) ΔH=-484 kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:__________________________ 。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:
请回答下列问题:
①该反应的ΔS____ (填“>”或“<”)0。右图中曲线a到曲线b的措施是_____________________________ 。

②已知CO中的C与O之间为三键,其键能为x kJ·mol-1,则x=____ 。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________ 。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____ 。

(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2−,O2−穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由上图可知A为直流电源的____ (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_______ 。
(1)已知:CH3OH(g) ===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g) ===2H2O(g) ΔH=-484 kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)
 CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:| 化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
| 键能/ kJ·mol-1 | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题:
①该反应的ΔS

②已知CO中的C与O之间为三键,其键能为x kJ·mol-1,则x=
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl− | SO42 - |
| c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为

(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000 ℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2−,O2−穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由上图可知A为直流电源的
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
名校
解题方法
20. CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________ 。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________ 。

(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
①在图示2的转化中,化合价不变的元素是_________ (填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________ (填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________ 。
③加入NaClO时发生的反应为:Cu(NH3)42++2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O。该反应需在80℃以上进行,其目的除了加快反应速率外,还有________ 、________ 。
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________ 。

(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为

(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
①在图示2的转化中,化合价不变的元素是
②在转化过程中通入氧气发生反应后,溶液的pH将
③加入NaClO时发生的反应为:Cu(NH3)42++2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O。该反应需在80℃以上进行,其目的除了加快反应速率外,还有
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:

【知识点】 化学反应原理综合考查解读 化学反应条件的控制及优化 燃料电池
您最近一年使用:0次
2016-12-09更新
|
251次组卷
|
7卷引用:2015届江苏省徐州、连云港、宿迁三市高三第三次检测化学试卷
五、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
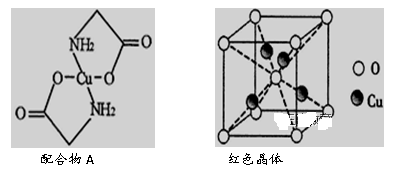
21. 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图所示:
(1)Cu元素基态原子的外围电子排布式为______________ 。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________ 。
(3)配合物A中碳原子的轨道杂化类型为_______________________ 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有 键的数目为
键的数目为____________ mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________ (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图所示,则该化合物的化学式是_________ 。

(1)Cu元素基态原子的外围电子排布式为
(2)元素C、N、O的第一电离能由大到小排列顺序为
(3)配合物A中碳原子的轨道杂化类型为
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有
 键的数目为
键的数目为(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图所示,则该化合物的化学式是
您最近一年使用:0次
2017-09-10更新
|
255次组卷
|
3卷引用:江苏省溧水高级中学2018届高三上学期期初模拟考试化学试题
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、常见无机物及其应用、化学反应原理、化学实验基础、有机化学基础、物质结构与性质
试卷题型(共 21题)
题型
数量
单选题
14
多选题
1
解答题
5
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 大气污染来源及危害 | |
| 2 | 0.65 | 氧化还原反应基本概念 氯气的工业制法 海水提取溴 海带中碘的提取及检验 | |
| 3 | 0.65 | 氨的物理性质 二氧化硫的化学性质 碳酸氢钠的俗称、物理性质及用途 铁盐的净水作用及原理 | |
| 4 | 0.85 | 影响化学反应速率的因素 化学平衡的移动及其影响因素 | |
| 5 | 0.65 | 离子方程式的正误判断 铝三角转化 电解池电极反应式及化学方程式的书写与判断 | |
| 6 | 0.65 | 原电池原理的应用 金属的防护 | |
| 7 | 0.65 | 中和热概念 燃烧热概念 反应热大小比较 | |
| 8 | 0.64 | 化学实验基础 | |
| 9 | 0.65 | 氨的还原性 硫单质的化学性质 硅的制备 海水提取镁 | |
| 10 | 0.65 | 能量的相互转化 影响化学反应速率的因素 化学平衡常数的影响因素及应用 与转化率变化有关图像的分析 | |
| 11 | 0.65 | 有机官能团的性质及结构 | |
| 12 | 0.4 | 限定条件下的离子共存 溶液的酸碱性与pH 酸碱中和滴定 | |
| 13 | 0.65 | 氯气的实验室制法 氨气的制备 二氧化硫的制备 物质性质的探究 | |
| 15 | 0.4 | 化学平衡常数的有关计算 化学平衡题中基于图表数据的相关计算 | |
| 二、多选题 | |||
| 14 | 0.4 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 三、解答题 | |||
| 16 | 0.65 | 其他含卤化合物 二氧化硫的化学性质 二氧化硫的制备 物质制备的探究 | 实验探究题 |
| 17 | 0.4 | 有机物的推断 有机合成综合考查 有机推断综合考查 | 有机推断题 |
| 18 | 0.65 | 其他含铝化合物 常见无机物的制备 探究物质组成或测量物质的含量 | 原理综合题 |
| 19 | 0.65 | 化学键与化学反应中的能量关系 盖斯定律与热化学方程式 盖斯定律的应用 甲醇燃料电池 | 原理综合题 |
| 20 | 0.65 | 化学反应原理综合考查 化学反应条件的控制及优化 燃料电池 | 原理综合题 |
| 四、填空题 | |||
| 21 | 0.65 | 物质结构与性质综合考查 电子排布式 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | |



