江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题
江苏
高三
阶段练习
2018-09-28
513次
整体难度:
适中
考查范围:
化学与STSE、常见无机物及其应用、认识化学科学、化学实验基础、化学反应原理、有机化学基础、物质结构与性质
一、单选题 添加题型下试题
| A.绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的物质 |
| B.回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.根据硅原子核外电子排布可知,硅元素的化学性质稳定,自然界中存在大量硅单质 |
| A.海带提碘 | B.氯碱工业 |
| C.氨碱法制碱 | D.海水提溴 |
| A.难氧化 | B.难溶于水 | C.属于硅酸盐 | D.属于混合物 |
【知识点】 硅酸盐组成的表示方法解读 铜的其他化合物 常见无机物的制备解读
| A.SO2具有氧化性,可用于漂白纸浆 | B.NaHCO3能与碱反应,可用作焙制糕点的膨松剂 |
| C.Fe2(SO4)3易溶于水,可用作净水剂 | D.液氨汽化时吸收大量的热,可用作制冷剂 |
| A.升高 | B.降低 | C.不变 | D.无法确定 |
【知识点】 氧化还原反应的应用
 CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,下列选项中各物理量的变化判断正确的是
CH4(g)+2H2O(g)。已知H2的体积分数随温度的升高而增加。若温度从300℃升至400℃,重新达到平衡,下列选项中各物理量的变化判断正确的是| A.正反应速率减小 | B.逆反应速率增大 | C.平均相对分子质量不变 | D.转化率增大 |
【知识点】 影响化学反应速率的因素 化学平衡的移动及其影响因素
| A.能溶解Al2O3的溶液中:Mg2+、Fe3+、AlO2-、HCO3- |
| B.水电离出c(H+)=10-9mol/L的溶液中:K+、Fe3+、Cl-、SO42- |
| C.滴入KSCN显红色的溶液:Na+、Cu2+、Br-、SO42- |
| D.c(H+)/c(OH-)=1012的溶液中:NH4+、K+、HCO3-、NO3- |
【知识点】 离子共存 限定条件下的离子共存解读
| A.向FeCl3溶液中滴加HI溶液:Fe3++2I-=Fe2++I2 |
B.用铜电极电解氯化钠溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ |
| A.溴苯中的溴(KI溶液) | B.溴乙烷中的乙醇(NaOH溶液) |
| C.苯中的甲苯(溴水) | D.乙酸乙酯中的乙酸(饱和Na2CO3溶液) |
| A.Cl2通入NaOH溶液:Cl2+OH-=Cl-+ClO-+H2O |
| B.NaHCO3溶液中加入稀HCl:CO32-+2H+=CO2↑+H2O |
| C.NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
| D.Cu溶于稀HNO3:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
【知识点】 离子反应的发生及书写 离子方程式的书写解读 离子方程式的正误判断解读
| A.铜的金属活泼性比铁弱,可在海轮外壳上镶入若干铜块以减缓铁腐蚀 |
| B.原电池中,一定由活泼性强的金属作负极,发生氧化反应 |
| C.原电池放电时的负极和电解池充电时的阴极均发生氧化反应 |
| D.可充电电池充电时,负极与电源负极相连,正极与电源正极相连 |
| A.液溴应保存于带磨口玻璃塞的广口试剂瓶中,并加水“水封”以减少其易挥发 |
| B.向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
| C.滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+ |
| D.氨气是一种碱性气体,可用无水CaCl2干燥 |
| A.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a>b |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| D.已知CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.1 kJ·mol–1,反应过程中使用催化剂,ΔH减小 |
| A.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
| B.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA |
| C.NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA |
| D.1 mol Fe在氧气中充分燃烧失去3NA个电子 |
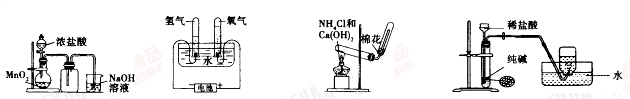
| A.实验室制氯气 | B.实验室制氧气 | C.实验室制氨气 | D.实验室制二氧化碳 |
【知识点】 化学实验基础
 NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是
NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是| A.氧化产物和还原产物的物质的量之比为2:1 |
| B.转移4 mol电子时,只需向装置中通入44.8 L H2(标准状况) |
| C.装药品之前加热装置至100℃并持续一会儿 |
| D.制备硼氢化钠的副产物可能有NaH |
【知识点】 氧化还原反应基本概念 氧化还原反应有关计算 钠 物质制备的探究解读
A.S SO3 SO3 H2SO4 H2SO4 | B.NH3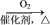 N2 N2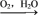 HNO3 HNO3 |
C.SiO2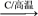 Si Si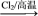 SiCl4 SiCl4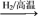 Si Si | D.海水 Mg(OH)2 Mg(OH)2  Mg Mg |

下列说法正确的是
| A.Cl2和SO2均可以漂白有色物质,且漂白的原理相同 |
B.由SiO2+ Na2CO3  Na2SiO3+ CO2↑可知H2CO3的酸性强于H2SiO3 Na2SiO3+ CO2↑可知H2CO3的酸性强于H2SiO3 |
| C.工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3 |
| D.制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应 |
A.图 表示燃料燃烧反应的能量变化 表示燃料燃烧反应的能量变化 |
B.图 表示酶催化反应的反应速率随反应温度的变化 表示酶催化反应的反应速率随反应温度的变化 |
C.图 表示可逆反应从加入反应物开始建立化学平衡的过程 表示可逆反应从加入反应物开始建立化学平衡的过程 |
D.图 表示可逆反应的平衡常数随反应物浓度的变化 表示可逆反应的平衡常数随反应物浓度的变化 |
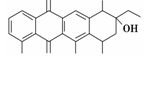
| A.阿克拉酮的分子式为C22H22O8 |
| B.分子中含有3个手性碳原子 |
| C.该分子一定条件下能发生取代、氧化、消去反应 |
| D.1 mol该物质最多可与3 mol NaOH反应 |
【知识点】 有机官能团的性质及结构
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 铜与浓硝酸反应,生成气体用湿润KI-淀粉试纸检验 | 试纸变蓝 | NO2为酸性气体 |
| B | 向某溶液中加入稀盐酸酸化的BaCl2溶液 | 有白色沉淀产生 | 该沉淀可能是BaSO4,该溶液中可能含有SO42- |
| C | 向甲苯中滴入少量溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水褪色 |
| D | 将二氧化硅分别与氢氟酸溶液和氢氧化钠溶液反应 | 二氧化硅与氢氟酸反应生成气体,与氢氧化钠反应溶解 | 二氧化硅为两性氧化物 |
| A.A | B.B | C.C | D.D |
二、多选题 添加题型下试题

| A.图1中:将胶头滴管中的水滴入到金属钠中,能看到U形管右侧红墨水高度不变 |
| B.图2中:观察到湿润的有色布条能褪色,待尾气全部被碱吸收后,将稀硫酸滴入烧杯中,至溶液显酸性,可能看到有黄绿色气体生成 |
| C.图3可用于制备、收集乙酸乙酯 |
| D.图4可以比较KMnO4、Cl2和S氧化性的相对强弱 |
【知识点】 氯气 钠 乙酸乙酯制备实验 化学实验方案的设计与评价
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c( )>c( )>c( )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
C.在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
| D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+) |
三、单选题 添加题型下试题
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
| A.T1时0~10minNO2的平均反应速率为0.15mol·L-1·min-1 |
| B.T2时CH4的平衡转化率为30.0% |
| C.保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动 |
| D.保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大 |
| 实验 | 现象 | 结论 | |
| A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一支试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
 | 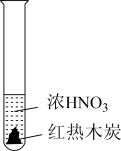 | 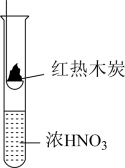 |
| ① | ② | ③ |
| A.由①中的红棕色气体,推断产生的气体一定是混合气体 |
| B.由②中的红棕色气体不能表明木炭与浓硝酸发生了反应 |
| C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 |
| D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
【知识点】 硝酸的不稳定性解读 化学实验方案的设计与评价 物质性质的探究解读
烧渣
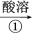
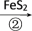 溶液
溶液 绿矾
绿矾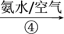 铁黄
铁黄已知:FeS2和铁黄均难溶于水。
下列说法不正确的是( )
| A.步骤①,最好用硫酸来溶解烧渣 |
B.步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O===15Fe2++2SO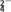 +16H+ +16H+ |
| C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾 |
| D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3 |
【知识点】 常见物质的制备 物质分离、提纯综合应用解读

A.在pH<4.76的溶液中,c(CH3COO-)<c(CH3C OOH) OOH) |
| B.在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0 |
| C.在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+) |
| D.在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变 |
【知识点】 弱电解质的电离平衡 盐溶液中离子浓度大小的比较解读
四、多选题 添加题型下试题
 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是 | 容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
| c(NO2) | c(NO) | c(O2) | c(O2) | |
| I | 0.6 | 0 | 0 | 0.2 |
| II | 0.3 | 0.5 | 0.2 | |
| Ⅲ | 0 | 0.5 | 0.35 | |
| A.达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5 |
| B.达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大 |
| C.达平衡时,容器Ⅲ中NO的体积分数小于50% |
| D.当温度改变为 T2时,若 k正=k逆,则 T2<T1 |
【知识点】 化学平衡状态 化学平衡的移动及其影响因素 化学平衡的有关计算
五、解答题 添加题型下试题

(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:
(3)吸收器中生成NaClO2的离子反应方程式为
(4)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:

①盛放浓H2SO4仪器名称为
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为

(1)铜帽溶解时加入H2O2的目的是
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2;2S2O32-+I2=2I-+S4O62-。
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30%H2O2,使其充分反应;②滴加1.0mol·L-1NaOH,调节溶液pH范围:
六、填空题 添加题型下试题
(1)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl− | SO42- |
| c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为
(2)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2—,O2—穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图可知A为直流电源的

(1)Cu元素基态原子的外围电子排布式为
(2)元素C、N、O的第一电离能由大到小排列顺序为
(3)配合物A中碳原子的轨道杂化类型为
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有
 键的数目为
键的数目为(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:
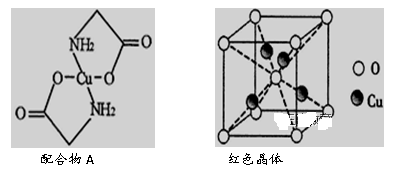
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图所示,则该化合物的化学式是
试卷分析
试卷题型(共 34题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 大气污染来源及危害 | |
| 2 | 0.85 | 自然界中硅元素的存在 焰色试验 化学科学对人类文明发展的意义 “白色污染”危害及防治 | |
| 3 | 0.65 | 氧化还原反应基本概念 氯气的工业制法 海水提取溴 海带中碘的提取及检验 | |
| 4 | 0.65 | 硅酸盐组成的表示方法 铜的其他化合物 常见无机物的制备 | |
| 5 | 0.65 | 氨的物理性质 二氧化硫的化学性质 碳酸氢钠的俗称、物理性质及用途 铁盐的净水作用及原理 | |
| 6 | 0.85 | 氧化还原反应的应用 | |
| 7 | 0.85 | 影响化学反应速率的因素 化学平衡的移动及其影响因素 | |
| 8 | 0.65 | 离子共存 限定条件下的离子共存 | |
| 9 | 0.65 | 离子方程式的正误判断 铝三角转化 电解池电极反应式及化学方程式的书写与判断 | |
| 10 | 0.65 | 有机物分离提纯的几种常见操作 有机物分离提纯操作的综合考查 物质分离、提纯的常见化学方法 | |
| 11 | 0.85 | 离子反应的发生及书写 离子方程式的书写 离子方程式的正误判断 | |
| 12 | 0.65 | 原电池原理的应用 金属的防护 | |
| 13 | 0.85 | 溴、碘的性质 铵根离子的检验 | |
| 14 | 0.85 | 热化学方程式 中和热 燃烧热概念 反应热大小比较 | |
| 15 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 16 | 0.64 | 化学实验基础 | |
| 17 | 0.65 | 氧化还原反应基本概念 氧化还原反应有关计算 钠 物质制备的探究 | |
| 18 | 0.65 | 氨的还原性 硫单质的化学性质 硅的制备 海水提取镁 | |
| 19 | 0.65 | 氯气 硅酸盐 碳酸氢钠 物质制备的探究 | |
| 20 | 0.65 | 能量的相互转化 影响化学反应速率的因素 化学平衡常数的影响因素及应用 与转化率变化有关图像的分析 | |
| 21 | 0.65 | 有机官能团的性质及结构 | |
| 22 | 0.65 | 二氧化氮 苯的同系物的卤代反应 常见阴离子的检验 化学实验方案的设计与评价 | |
| 25 | 0.4 | 化学平衡常数的有关计算 化学平衡题中基于图表数据的相关计算 | |
| 26 | 0.4 | 仪器使用与实验安全 物质的分离、提纯 物质的检验 | |
| 27 | 0.65 | 硝酸的不稳定性 化学实验方案的设计与评价 物质性质的探究 | |
| 28 | 0.4 | 常见物质的制备 物质分离、提纯综合应用 | |
| 29 | 0.4 | 弱电解质的电离平衡 盐溶液中离子浓度大小的比较 | |
| 二、多选题 | |||
| 23 | 0.65 | 氯气 钠 乙酸乙酯制备实验 化学实验方案的设计与评价 | |
| 24 | 0.4 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 30 | 0.4 | 化学平衡状态 化学平衡的移动及其影响因素 化学平衡的有关计算 | |
| 三、解答题 | |||
| 31 | 0.65 | 其他含卤化合物 二氧化硫的化学性质 二氧化硫的制备 物质制备的探究 | 实验探究题 |
| 32 | 0.65 | 化学实验基础操作 物质分离、提纯综合应用 物质含量的测定 物质制备的探究 | 工业流程题 |
| 四、填空题 | |||
| 33 | 0.65 | 电化学计算 甲醇燃料电池 电解池电极反应式及化学方程式的书写与判断 电解池有关计算 | |
| 34 | 0.65 | 物质结构与性质综合考查 电子排布式 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | |



