河北省易县中学2018-2019学年高二下学期期末考试化学试题
河北
高二
期末
2019-07-17
747次
整体难度:
适中
考查范围:
认识化学科学、物质结构与性质、化学与STSE、化学实验基础、常见无机物及其应用、化学反应原理
一、单选题 添加题型下试题
A.次氯酸的电子式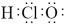 | B.丁烷的球棍模型 |
| C.乙烯的结构简式CH2=CH2 | D.原子核内有8个中子的碳原子146C |
| A.化石燃料燃烧和工业废气中的氮氧化物是导致“雾霾天气”的原因之一 |
| B.铝制餐具不宜长时间存放酸性、碱性和咸的食物 |
| C.用含有铁粉的透气小袋与食品一起密封包装来防止食品氧化 |
| D.化学药品着火,都要立即用水或泡沫灭火器灭火 |
【知识点】 化石能源
| A.CaCO3、Ca(HCO3)2、Cu2(OH)2CO3都属于碳酸盐 |
| B.HCl、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| C.蓝矾(CuSO4·5H2O)和干冰属于化合物,铁矿石属于混合物 |
| D.通过化学反应,可由Ba(OH)2一步转化生成NaOH |
| A.SiO2不能和水反应,所以它不是酸性氧化物 |
| B.只由一种元素组成的物质必然是纯净物 |
| C.烧碱、冰醋酸、石墨均为电解质 |
| D.海水、氯水、氨水均为混合物 |
【知识点】 物质的分类
①工业制O2 ②爆炸 ③缓慢氧化 ④品红褪色 ⑤无水硫酸铜由白变蓝
⑥久置浓硝酸变黄 ⑦O2转化为O3 ⑧海水中提取金属镁
| A.①②③⑧ | B.④⑤⑥⑧ | C.③⑤⑥⑦⑧ | D.③④⑤ |
| A.硅太阳能电池工作时,光能转化成电能 |
| B.锂离子电池放电时,化学能转化成电能 |
| C.电解质溶液导电时,电能转化成化学能 |
| D.葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
【知识点】 氧化还原反应的应用
| A.灰霾是一种分散系 | B.灰霾能发生丁达尔效应 |
| C.灰霾形成的是非常稳定的体系 | D.灰霾属于胶体 |
| A.pH=1的无色溶液中:Na+、Cu2+、Cl-、CO32- |
| B.使酚酞呈红色的溶液中:K+、Na+、NO3-、Cl- |
| C.0.1mol·L-1的FeCl2溶液中:H+、Al3+、SO42-、ClO- |
| D.由水电离出的c(H+)=1×10-10mol·L-1的溶液中:Mg2+、NH4+、SO42-、HCO3- |
【知识点】 离子共存 限定条件下的离子共存解读
| A.肯定不含Cl- | B.肯定不含H+ |
| C.肯定不含NH4+ | D.肯定含有SO32- |
| 选项 | 离子组 | 要求 |
| A | K+、AlO2-、Cl-、Cr2O72- | 溶液无色澄清 |
| B | Fe3+、NO3-、Br-、HCO3- | 逐滴滴加盐酸,立即产生气体 |
| C | Na+、K+、AlO2-、NO3- | 逐滴滴加盐酸,先有沉淀产生,后沉淀消失 |
| D | NH4+、Al3+、SO42-、Cl- | 滴加NaOH溶液并加热,立刻产生气体 |
| A.A | B.B | C.C | D.D |
【知识点】 离子共存 限定条件下的离子共存解读
| A.至少存在5种离子 |
| B.Cl-一定存在,且c(Cl‑)≥0.4mol/L |
| C.SO42-、NH4+、一定存在,Cl-可能不存在 |
| D.CO32-、Al3+一定不存在,K+可能存在 |
【知识点】 离子共存 离子反应在化合物组成的分析、鉴定的应用解读
| A.用过量氨水吸收工业尾气中的SO2: 2NH3·H2O+SO2===2NH4++SO32-+H2O |
| B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-===CaCO3↓+CO32-+2H2O |
| C.磁性氧化铁溶于足量稀硝酸: Fe3O4+8H+===Fe2++2Fe3++4H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-===2BaSO4↓+Al(OH)3↓ |
【知识点】 离子方程式的正误判断解读
| 选项 | 离子方程式 | 评价 |
| A | 将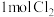 通入含 通入含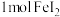 溶液中: 溶液中: | 正确; 过量,可将 过量,可将 、 、 均氧化 均氧化 |
| B | 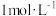 的 的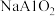 溶液和 溶液和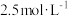 的 的 溶液等体积均匀混合: 溶液等体积均匀混合: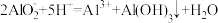 | 正确; 与 与 消耗的 消耗的 的物质的量之比为 的物质的量之比为 |
| C | 过量 通入 通入 溶液中: 溶液中: | 正确;说明酸性: 强于 强于 |
| D | 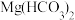 溶液与足量的 溶液与足量的 溶液反应: 溶液反应: | 正确;酸式盐与碱反应生成正盐和水 |
| A.A | B.B | C.C | D.D |

A.a反应: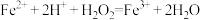 |
B.b反应: |
C.c反应: |
D.d反应: |
【知识点】 离子方程式的正误判断解读
| A.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
| B.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA |
| C.NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA |
| D.1 mol Fe在氧气中充分燃烧失去3NA个电子 |
| A.27g铝加入1mol·L-1的NaOH溶液中,转移电子数是3NA |
| B.56gN2与CO的混合物中原子总数是4NA |
| C.常温常压下,124 g P4中所含P—P键数目为4NA |
| D.常温下,1LpH=1的H2SO4溶液中的H+数为0.2NA |
| A | B | C | D | |
| 实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
| 现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
| A.A | B.B | C.C | D.D |
| A.14 g乙烯和丙烯的混合物完全燃烧时,产生的CO2分子数目为0.5NA |
| B.1 L 0.1 mol/L的CH3COONa溶液中含有的CH3COO-数目为0.1NA |
| C.6 g石英晶体中含有的Si—O键数目为0.4NA |
| D.标准状况下,5.6 L O2和O3混合物中含有的氧原子数目为0.5NA |
| 物质(括号内为杂质) | 除杂试剂 | |
| A | FeCl2溶液(FeCl3) | Fe粉 |
| B | NaCl溶液(MgCl2) | NaOH溶液、稀HCl |
| C | Cl2(HCl) | H2O、浓H2SO4 |
| D | NO(NO2) | H2O、无水CaCl2 |
| A.A | B.B | C.C | D.D |
【知识点】 氧化还原反应的规律解读 物质分离、提纯的常见化学方法解读
| A.0.1molN2H4中所含质子数为1.8NA |
| B.0.1mol·L-1的NaClO溶液中,ClO-的数量为0.1NA |
| C.消耗4.48LNH3时,转移电子数为0.2NA |
| D.1.6gN2H4中存在共价键总数为0.2NA |
【知识点】 阿伏加德罗常数的求算解读
| A.0.75mol·L-1 | B.1.5mol·L-1 | C.2mol·L-1 | D.3mol·L-1 |
【知识点】 氧化还原反应有关计算
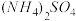 在强热时分解的产物是
在强热时分解的产物是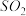 、
、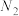 、
、 和
和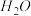 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
【知识点】 氧化还原反应有关计算 氧化还原反应方程式的配平解读
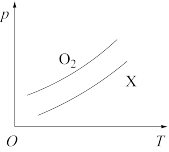
| A.C2H4 | B.CH4 | C.CO2 | D.NO |
【知识点】 阿伏加德罗定律及其推论解读
| A.在50 mL量筒中配制0.100 0 mol/L碳酸钠溶液 |
| B.仅用烧杯、量筒、玻璃棒就可配制100 mL0.100 0 mol/L K2Cr2O7溶液 |
| C.用100 mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100 mL pH=2的盐酸 |
| D.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余液体吸出 |
【知识点】 一定物质的量浓度的溶液的配制
| A.配制过程只需要三种仪器即可完成 |
| B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 |
| C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 |
| D.需要称量NaClO固体的质量为140 g |
【知识点】 一定物质的量浓度的溶液的配制
二、填空题 添加题型下试题
(1)上述物质中属于电解质的物质序号为
(2)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为
(4)能导电的物质序号为
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)
(6)实验室用⑤制备胶体的化学方程式为
三、 添加题型下试题
回答下列问题:
(1)所需浓硫酸的体积是
(从下列规格中选用:A 10 mL B 25 mL C 50 mL D 100 mL)
(2)第③步实验的操作是
(3)第⑤步实验的操作是
(4)下列情况对所配制的稀硫酸浓度有何影响(用“偏大”“偏小”或“无影响”填写)?
A 所用的浓硫酸长时间放置在密封不好的容器中
B 容量瓶用蒸馏水洗涤后残留有少量的水
C 所用过的烧杯、玻璃棒未洗涤
D 定容时俯视溶液的凹液面
【知识点】 一定物质的量浓度的溶液的配制
四、解答题 添加题型下试题
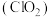 是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:(1)在处理废水时,
 可将废水中的
可将废水中的 氧化成
氧化成 和
和 ,该反应的离子方程式是
,该反应的离子方程式是(2)某小组按照文献中制备
 的方法设计了如图所示的实验装置用于制备
的方法设计了如图所示的实验装置用于制备 。
。
①装置A用于生成
 气体,该反应的化学方程式是
气体,该反应的化学方程式是②通入氮气的作用有两个,一个是起到搅拌作用,二是
(3)测定装置C中
 溶液的浓度:取
溶液的浓度:取 中溶液于锥形瓶中,加入足量的
中溶液于锥形瓶中,加入足量的 溶液和
溶液和 酸化,然后加入
酸化,然后加入 的
的 标准液滴定锥形瓶中的溶液(
标准液滴定锥形瓶中的溶液( ),消耗标准溶液的体积为
),消耗标准溶液的体积为 ,滴定终点的现象是
,滴定终点的现象是(4)计算C中
 溶液的物质的量浓度,写出计算过程
溶液的物质的量浓度,写出计算过程 等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
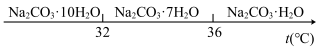
(1)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释
(2)“趁热过滤”时的温度应控制在
(3)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ· mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63kJ· mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:
(4)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用,请你分析实际生产中是否可行:
试卷分析
试卷题型(共 29题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 化学用语综合判断 有机物的结构式、结构简式、比例模型、球棍模型、最简式 共价型分子结构式、电子式 原子的基本构成 | |
| 2 | 0.64 | 化石能源 | |
| 3 | 0.65 | 物质的转化 分类方法的应用 单质和化合物 酸、碱、盐、氧化物的概念及其相互联系 | |
| 4 | 0.64 | 物质的分类 | |
| 5 | 0.85 | 化学用语 氧化还原反应 | |
| 6 | 0.65 | 氧化还原反应的应用 | |
| 7 | 0.85 | 胶体的性质和应用 | |
| 8 | 0.85 | 离子共存 限定条件下的离子共存 | |
| 9 | 0.65 | 离子反应的实际应用 离子的检验 | |
| 10 | 0.65 | 离子共存 限定条件下的离子共存 | |
| 11 | 0.65 | 离子共存 离子反应在化合物组成的分析、鉴定的应用 | |
| 12 | 0.65 | 离子方程式的正误判断 | |
| 13 | 0.65 | 离子方程式的正误判断 次氯酸及其性质 氯气与还原性化合物的反应 偏铝酸钠与盐酸的反应 | |
| 14 | 0.85 | 离子方程式的正误判断 | |
| 15 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 16 | 0.65 | 阿伏加德罗常数的应用 结合物质结构基础知识与NA相关推算 | |
| 17 | 0.65 | 氧化还原反应定义、本质及特征 氯水的性质 硝酸的强氧化性 氢氧化亚铁 | |
| 18 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 19 | 0.65 | 氧化还原反应的规律 物质分离、提纯的常见化学方法 | |
| 20 | 0.65 | 阿伏加德罗常数的求算 | |
| 21 | 0.65 | 氧化还原反应有关计算 | |
| 22 | 0.65 | 氧化还原反应有关计算 氧化还原反应方程式的配平 | |
| 23 | 0.65 | 阿伏加德罗定律及其推论 | |
| 24 | 0.65 | 一定物质的量浓度的溶液的配制 | |
| 25 | 0.65 | 一定物质的量浓度的溶液的配制 | |
| 二、填空题 | |||
| 26 | 0.65 | 胶体的制备 电解质与非电解质 离子方程式的书写 碳酸钠与碳酸氢钠的相互转化 | |
| 三、 | |||
| 27 | 0.85 | 一定物质的量浓度的溶液的配制 | |
| 四、解答题 | |||
| 28 | 0.65 | 氧化还原反应方程式的配平 碘与淀粉的显色反应 物质含量的测定 物质制备的探究 | 实验探究题 |
| 29 | 0.65 | 盖斯定律与热化学方程式 盐类水解在生活、生产中的应用 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |



