黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
黑龙江
高三
阶段练习
2020-12-12
540次
整体难度:
适中
考查范围:
认识化学科学、化学反应原理、化学与STSE、常见无机物及其应用、物质结构与性质、化学实验基础
黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
黑龙江
高三
阶段练习
2020-12-12
540次
整体难度:
适中
考查范围:
认识化学科学、化学反应原理、化学与STSE、常见无机物及其应用、物质结构与性质、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 下列有关叙述不正确的是( )
| A.纯铁比生铁更易熔化 |
| B.工厂中常用的静电除尘利用了胶体电泳的性质 |
| C.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法 |
| D.马口铁(镀锡铁)比白铁(镀锌铁)铁板更易腐蚀 |
【知识点】 胶体的性质和应用解读 金属的电化学腐蚀与防护 金属与合金性能比较解读
您最近一年使用:0次
2020-12-02更新
|
128次组卷
|
2卷引用:黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
单选题
|
适中(0.65)
真题
名校
2. 下列能量转化过程与氧化还原反应无关的是
| A.硅太阳能电池工作时,光能转化成电能 |
| B.锂离子电池放电时,化学能转化成电能 |
| C.电解质溶液导电时,电能转化成化学能 |
| D.葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
【知识点】 氧化还原反应的应用
您最近一年使用:0次
2017-11-25更新
|
2372次组卷
|
56卷引用:河北省安平中学2016-2017学年高二下学期期末考试化学试题
河北省安平中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(天津卷精编版)浙江省嘉兴市第一中学2017-2018学年高二上学期期中考试化学试题河南省洛阳市2018届高三上学期第一次质量预测(1月)化学试题河南省郑州市2018届高三高中毕业班第一次质量检测(模拟)化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.4 氧化还原反应安徽省池州一中(贵池中学)2017-2018学年高一下学期期中质量检测化学试题(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密(已下线)学科网2019年高考化学一轮复习讲练测2.3 氧化还原反应的基本概念 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】山西省临猗县临晋中学2019届高三9月月考化学试题【全国百强校】福建省上杭县第一中学2018-2019学年高二上学期10月月考化学试题【校级联考】福建省晋江市(安溪一中、养正中学、惠安一中、泉州实验中学四校)2018-2019学年高二上学期期中考试化学试题【全国百强校】福建省莆田市第一中学2018-2019学年高二上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)河南省郑州市实验中学2019届高三上学期期中考试化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点河北省易县中学2018-2019学年高二下学期期末考试化学试题(已下线)专题2.3 氧化还原反应(练)-《2020年高考一轮复习讲练测》黑龙江省龙东南联合体2018-2019学年高二下学期期末考试化学试题福建省莆田九中2019-2020学年高二上学期期中考试化学试题福建省莆田第七中学2020届高三上学期期中复习检测化学试题2福建省厦门市思明区厦门外国语学校2019-2020学年高三上学期周末练习12——化学试题新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题天津市海河中学2020届高三第二学期化学测试(二)试卷河北省保定市2019-2020学年高二上学期期末调研考试化学试题江苏省宿迁市沭阳县修远中学2019-2020学年高二下学期4月月考化学试题(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)广东省深圳中学2020届高三2月份网络教学质量监测理综化学试题2020届湖南省长沙市礼雅中学高中毕业班四月份网络教学质量监测卷理科综合化学部分天津市南开中学2020届高三教学质量监测理科综合化学部分河北省衡水中学2020届高三下学期二月份网络教学质量监测理科综合化学试题湖南省衡阳市2020年高中毕业班教学质量监测卷理科综合化学(已下线)【南昌新东方】2019-2020 雷氏中学 高一下 周练(已下线)2.3.1 认识氧化还原反应 氧化剂和还原剂练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)高一必修第二册(人教2019版)第六章 化学反应与能量 素养检测黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题(已下线)高中化学苏教2019版必修第二册-专题6 第三单元综合拔高练青海省西宁市普通高中五校2020-2021学年高三上学期期末联考化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练四川省绵阳市南山中学2021届高三下学期3月月考试题化学试题天津市河北区2021届高三一模考试化学试题(已下线)押山东卷第02题 氧化还原反应在生产生活中的应用-备战2021年高考化学临考题号押题(山东卷)甘肃省武威市民勤县第四中学2020-2021学年高二下学期期中考试化学(普通班)试题江西省景德镇一中2020-2021学年高一下学期期末考试化学试题(已下线)课时28 焓变与热化学方程式-2022年高考化学一轮复习小题多维练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)江苏省宿迁市泗阳县实验高级中学2021-2022学年高一下学期第一次月考化学试题福建省莆田第一中学2021-2022学年高二上学期期末考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题山东省滨州市沾化区实验高级中学2022-2023学年高三10月月考化学试题河北保定市唐县田家炳中学2021-2022学年高三上学期11月化学试题(已下线)江苏省南通市如皋市2022-2023学年高三上学期期末考试化学试题
单选题
|
较难(0.4)
3. 阿伏加德罗常数用NA表示,下列叙述正确的是( )
| A.标准状况下,11.2LCl2溶于水生成Cl-的数目为0.5NA |
| B.1 mol Na与O2完全反应生成Na2O和Na2O2的混合物,生成物中离子总数为1.5NA |
| C.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA |
D.1 mol雄黄(As4S4,结构式为 )所含S-S键数目为2 NA )所含S-S键数目为2 NA |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
4. 下列反应的离子方程式正确的是( )
A.向Ba(AlO2)2溶液中加入过量NaHSO4溶液:Ba2++SO =BaSO4↓ =BaSO4↓ |
| B.含0.1 mol FeI2的溶液中滴加含0.15 mol Cl2的氯水:2Fe2++2I-+2Cl2=2Fe3++I2+4C1- |
C.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合2HCO +Ba2++2OH-=BaCO3↓+2H2O+CO +Ba2++2OH-=BaCO3↓+2H2O+CO |
| D.NaHS溶液中滴入少量CuSO4溶液:HS-+Cu2+=CuS↓+H+ |
【知识点】 离子反应的发生及书写 离子方程式的正误判断解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
5. 用NA表示阿伏加德罗常数值,下列叙述中正确的( )
| A.0.4 mol NH3与0.6 mol O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA |
| B.1.2 g石墨含碳碳键数目为0.3NA |
| C.18 g 氨基(-ND2)中含有的电子数为 10NA |
| D.用惰性电极电解 100 mL 0.1 mol/L 的 CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时, 电路中转移电子数为 0.04NA |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
6. 下列微粒能大量共存且加入少量试剂发生的离子反应方程式正确的是( )
| 选项 | 离子组 | 试剂 | 离子方程式 |
| A | 无色溶液中:Na+、NH 、S2-、SO 、S2-、SO | 盐酸 | S2-+SO +6H+═2S↓+3H2O +6H+═2S↓+3H2O |
| B | 新制氯水中:Mg2+、Fe3+、Cl-、SO | KI | Cl2+2I-═I2+2Cl- |
| C | 天然气中:CH4、N2、CO2除去H2S | FeCl3溶液 | 2Fe3++S2-=2Fe2++S↓ |
| D | NaHCO3溶液中:Al3+、Mg2+、SO 、Cl- 、Cl- | BaCl2 | Ba2++SO ═BaSO4↓ ═BaSO4↓ |
| A.A | B.B | C.C | D.D |
【知识点】 离子方程式的正误判断解读 离子共存
您最近一年使用:0次
单选题
|
较易(0.85)
名校
解题方法
7. 下列热化学方程式,正确 的是( )
| A.甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 |
| B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 |
| C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
D.500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1 2NH3(g) ΔH=-38.6 kJ·mol-1 |
您最近一年使用:0次
2020-12-02更新
|
306次组卷
|
7卷引用:黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
单选题
|
适中(0.65)
名校
8. 下列是部分矿物资源的利用及产品流程(如图),有关说法不正确的是( )


| A.粗铜电解精炼时,粗铜作阳极 |
| B.生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应 |
| C.冶炼铝加冰晶石有利于氧化铝的熔化 |
| D.工业制粗硅反应中的氧化产物是一氧化碳 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
9. 如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )


| A.X的氢化物比Z的氢化物具有更强的还原性 |
| B.YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同 |
| C.Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4 > H2YO4 |
| D.元素W、T的简单气态氢化物的沸点比同主族中相邻的氢化物高,是因为分子间存在氢键 |
您最近一年使用:0次
2020-12-02更新
|
139次组卷
|
2卷引用:黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
10. 下列有关实验现象和解释或结论都正确的选项是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 分别在20℃、30℃下,取0.1 mol·L-1KI溶液,向其中先加入0.1 mol·L-1的硫酸,再加入淀粉溶液,发生反应4H++O2+4I- =2I2+2H2O | 30℃下出现蓝色的时间短 | 探究反应速率与温度的关系 |
| B | 把NaClO溶液滴到pH试纸上 | pH=10 | NaClO溶液水解显碱性 |
| C | 两支试管各盛0.1mol/L4mL酸性高锰酸钾溶液,分别加入0.1mol/L2mL草酸溶液和0.2mol/L2mL草酸溶液 | 加入0.2mol/L草酸溶液试管中,高锰酸钾溶液褪色更快 | 反应物浓度越大,反应速率越快 |
| D | 把SO2通入紫色石蕊试液中 | 紫色溶液变红 | SO2溶于水显酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
11. 1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( )
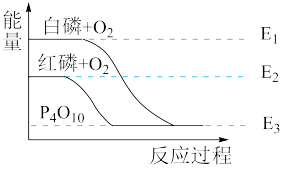

| A.P4(s,白磷)=4P(s,红磷) ΔH>0 |
| B.1mol白磷的键能大于4mol红磷的键能 |
| C.白磷比红磷稳定 |
| D.红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol |
您最近一年使用:0次
2020-12-02更新
|
171次组卷
|
2卷引用:黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
单选题
|
适中(0.65)
名校
12. 一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是( )
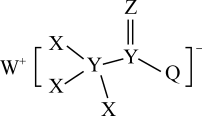

| A.WZX与W2Q化学键类型完全相同 |
| B.此物质中各微粒都满足最外层8电子稳定结构 |
| C.简单气态氢化物的稳定性:Z<Y |
| D.W2Q2Z3溶液在酸性条件下有黄色浑浊和无色气体产生 |
您最近一年使用:0次
2020-12-02更新
|
272次组卷
|
2卷引用:黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
单选题
|
适中(0.65)
名校
解题方法
13. 已知工业合成氨的方程式: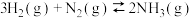 ,该反应在一定条件下进行时的热效应如图1所示,图2中L、X表示的物理量分别是温度或压强,下列说法正确的是( )
,该反应在一定条件下进行时的热效应如图1所示,图2中L、X表示的物理量分别是温度或压强,下列说法正确的是( )
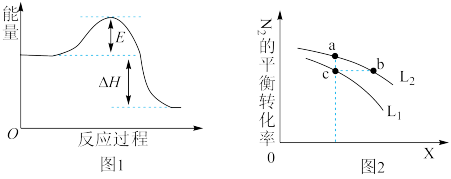
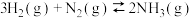 ,该反应在一定条件下进行时的热效应如图1所示,图2中L、X表示的物理量分别是温度或压强,下列说法正确的是( )
,该反应在一定条件下进行时的热效应如图1所示,图2中L、X表示的物理量分别是温度或压强,下列说法正确的是( )
| A.由图1可知,该反应的活化能为(E+∆H)kJ/mol |
| B.图2中,依据信息可判断L1>L2 |
| C.图2中a、b、c三点中v正最大的点是b |
| D.图2中a、b、c点平衡常数的关系为:Ka=Kc<Kb |
您最近一年使用:0次
2020-12-02更新
|
168次组卷
|
2卷引用:黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
单选题
|
适中(0.65)
名校
解题方法
14. 亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:

| A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1 |
| B.若反应①通过原电池来实现,则ClO2是正极产物 |
| C.反应②中的H2O2可用NaClO4代替 |
| D.反应②条件下,ClO2的氧化性大于H2O2 |
【知识点】 氧化还原反应有关计算 氧化还原反应在生活、生产中的应用解读
您最近一年使用:0次
2020-02-11更新
|
2045次组卷
|
29卷引用:【省级联考】山东省2020届新高考模拟统考化学试题
【省级联考】山东省2020届新高考模拟统考化学试题江苏省镇江市2020届高三上学期期末考试化学试题山东省菏泽市菏泽第一中学2020届高三下学期在线考试化学试题河南省洛阳市2020届高三上学期期末模拟考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题01-2020年北京新高考化学模拟试题黑龙江省哈尔滨市第三中学2020届高三下学期5月第一次模拟考试(全国II卷)理综化学试题北京市清华附中2019-2020学年高一下学期居家自主学习在线检测化学试题(已下线)第08讲 氧化还原反应的基本概念和规律(精练)——2021年高考化学一轮复习讲练测湖北省宜昌市2019-2020学年高二下学期期末考试化学试题(已下线)第14讲 富集在海水中的元素——卤素(精讲)——2021年高考化学一轮复习讲练测山东省青岛市青岛二中分校2021届高三上学期期中考试化学试题黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题北京市第五中学2021届高三上学期第二次阶段性考试化学试题(已下线)第12讲 富集在海水中的元素——卤素(精讲)-2022年一轮复习讲练测重庆市第七中学校2020-2021学年高三下学期第一次学情检测化学试题重庆市江津中学2021届高三高考全真模拟考试化学试题四川省南充市白塔中学2022届高三第一次月考(9月)化学试题河南省焦作市县级重点中学2021-2022学年高三上学期期中考试化学试题(已下线)第12讲 富集在海水中的元素——卤素(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第10讲 氯及其化合物(练)-2023年高考化学一轮复习讲练测(新教材新高考)江苏南京鼓楼区2021-2022学年高三下学期模拟考试化学试题广东省深圳市新安中学2021-2022学年高三下学期开学测试化学试题河北省石家庄市第四十三中学2022-2023学年高三上学期10月月考化学试题第四章 非金属及其化合物 第18讲 氯及其化合物福建省泉州市第七中学2022-2023学年高一下学期期中考试化学试题(已下线)第1讲 氯及其化合物重庆市第一中学校2023-2024学年高三上学期开学考试化学试题江苏省苏南八校2023-2024学年高二上学期12月联考化学(创新班)试卷(已下线)江苏省南京市、盐城市2024届高三下学期第二次模拟化学试题
单选题
|
适中(0.65)
名校
15. 石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1-xCoO2 C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )

 C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
A.充电时,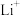 嵌入 嵌入 中 中 |
B.放电时, 极发生的电极反应为 极发生的电极反应为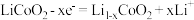 |
C.放电时负极反应为: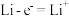 |
D.充电时,若转移 ,石墨烯电极增重7g ,石墨烯电极增重7g |
【知识点】 原电池电极反应式书写解读 二次电池 电解原理的应用 原电池、电解池综合考查解读
您最近一年使用:0次
2019-03-14更新
|
952次组卷
|
10卷引用:【市级联考】山东省潍坊市2019届高三下学期高考模拟考试理科综合化学试题
【市级联考】山东省潍坊市2019届高三下学期高考模拟考试理科综合化学试题2019年山东省潍坊市高考化学一模试卷重庆市云阳江口中学校2020届高三上学期第三次月考化学试题山东省济钢高级中学2021届高三10月质量检测化学试题山东省日照一中2021届高三11月份第二次调研考试化学试题福建省福州第一中学2020-2021学年高二上学期期中考试化学试题黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题河南省焦作市县级重点中学2021-2022学年高三上学期期中考试化学试题福建省福州格致中学2021-2022学年高二上学期期中考试化学试题福建省晋江市第一中学2021-2022学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
16. 实验室用O2氧化NH3制备硝酸的装置如图所示(夹持装置略),下列说法不正确的是
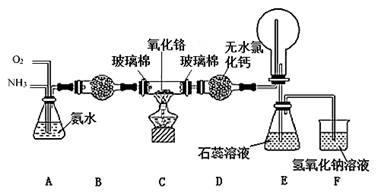
| A.球形干燥管B中可以填充碱石灰或五氧化二磷 |
| B.实验过程中,若熄灭酒精灯,装置C中的氧化铬继续保持红热,说明装置C中的反应放热 |
| C.球形干燥管D中的无水氯化钙可吸收尾气中的氨气和水蒸气 |
| D.装置E中的石蕊试液最终变红,说明锥形瓶中有硝酸产生 |
您最近一年使用:0次
2020-04-29更新
|
317次组卷
|
8卷引用:山西省联盟校2020届高三4月理科综合化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
17. 2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是
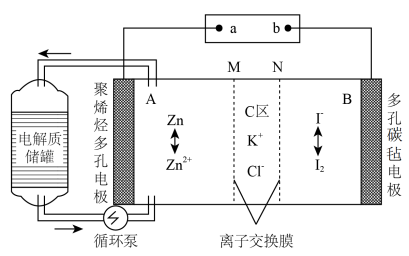

| A.放电时B电极反应式为:I2+2e-=2I- |
| B.放电时电解质储罐中离子总浓度增大 |
| C.M为阳离子交换膜,N为阴离子交换膜 |
| D.充电时,A极增重65g时,C区增加离子数为4NA |
您最近一年使用:0次
2019-05-10更新
|
3316次组卷
|
23卷引用:【市级联考】山东省青岛市2019届高三下学期5月第二次模考理科综合化学试题
【市级联考】山东省青岛市2019届高三下学期5月第二次模考理科综合化学试题四川省棠湖中学2020届高三一诊模拟考试理综化学试题河北省衡水中学2020届高三上学期第四次调研考试化学试题2020届人教版高三化学二轮复习选择题专攻练——电化学2020届高三《新题速递·化学》1月第01期(考点07-10)2020届高三化学化学二轮复习——新型电池基础练习【精编24题】专题2.4 电化学(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升江西名师联盟2020届高三第一次模拟测试化学试题(已下线)考点07 化学能与电能-2020年高考化学命题预测与模拟试题分类精编东北三省四市教研联合体2020届高三第二次模拟考试理综化学试题(已下线)专题08 电化学及其应用-2020年高考真题和模拟题化学分项汇编福建省莆田市第二中学2021届高三10月月考化学试题黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题重庆市西南大学附属中学校高2021届高三第二次月考化学试题江西省南昌市第二中学2021届高三上学期第六次考试化学试题(已下线)专题05 化学反应与能量——备战2021年高考化学纠错笔记吉林省松原市实验高级中学2021届高三5月月考化学试题(已下线)课时32 可充电电池装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点21 原电池 化学电源-备战2022年高考化学一轮复习考点帮(浙江专用)湖南省永州市第一中学中2022届高三下学期第二次模拟考试化学试题(已下线)第六章 化学反应与能量 第38练 电解原理的综合应用(已下线)专题四 电解池的工作原理及其应用(练习)
三、单选题 添加题型下试题
单选题
|
较难(0.4)
名校
解题方法
18. K2 FeO4在水中不稳定,发生反应: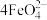 +l0H2O
+l0H2O 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是
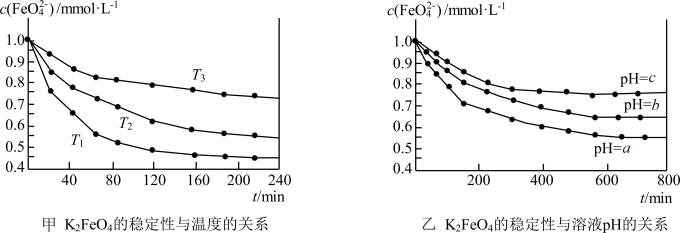
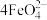 +l0H2O
+l0H2O 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如下图所示。下列说法不正确的是 
| A.由图甲可知上述反应 △H < 0 |
| B.由图甲可知温度:T1 > T2 > T3 |
| C.由图甲可知K2 FeO4的稳定性随温度的升高而减弱 |
| D.由图乙可知图中a < c |
您最近一年使用:0次
2019-12-29更新
|
656次组卷
|
5卷引用:2017届北京市密云区高三3月一模考试理综化学试卷
单选题
|
适中(0.65)
名校
解题方法
19. 向1 L的密闭容器中加入1 mol X、0.3 mol Z和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是( )


| A.Y的起始物质的量为0.5 mol |
| B.反应体系的压强,t4-t5阶段等于t5-t6阶段 |
C.该反应的化学方程式为:2X(g)+Y(g)  3Z(g) ∆H>0 3Z(g) ∆H>0 |
| D.反应物X的转化率t6点比t3点高 |
您最近一年使用:0次
2020-12-02更新
|
232次组卷
|
2卷引用:黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
单选题
|
困难(0.15)
名校
解题方法
20. 有一化合物X,其水溶液为浅绿色,有如图所示的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀 ,H和M反应可放出大量的热。(电解装置中用石墨做电极)下列说法正确的是( )
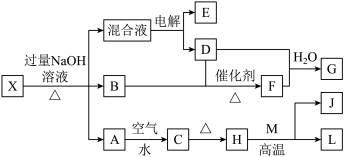

| A.生成G的反应中,生成1molG转移1mol电子 |
| B.此转化关系中只有一个置换反应 |
| C.“混合液”电解一段时间后pH不变 |
| D.检验X中是否存在Cl-,所用试剂为HNO3酸化的AgNO3 |
您最近一年使用:0次
2020-12-02更新
|
1930次组卷
|
3卷引用:黑龙江省大庆市让胡路区大庆铁人中学2021届高三上学期阶段考试化学试题
单选题
|
适中(0.65)
名校
21. 一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是

| A.传感器工作时,工作电极电势高 |
| B.工作时,H+通过交换膜向工作电极附近移动 |
| C.当导线中通过2×l0﹣6 mol电子,进入传感器的甲醛为3×10﹣3 mg |
| D.工作时,对电极区电解质溶液的pH增大 |
您最近一年使用:0次
2019-03-18更新
|
717次组卷
|
3卷引用:【市级联考】河北省张家口市辛集市沧州市2019届高三下学期3月一模考试理科综合化学试题
四、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
名校
解题方法
22. 下表为元素周期表的一部分,请参照元素①-⑪在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的离子半径由大到小的顺序为_______________ (用离子符号表示)。
(2)已知由④⑧两元素组成的两种物质之间的相互转化叫做催化氧化,是工业制硫酸中的一步重要反应,写出此反应的化学反应方程式:___________ 。
(3)由④、⑤、⑨三种元素组成的某物质是漂白液的有效成份,写出此物质的电子式:____________ 。用电子式表示由①、③两种元素组成的18e-分子的形成过程:______________ 。
(4)下列说法正确的是___________ 。
A.H2O与D2O互为同位素,H2与D2互为同素异形体
B.上表所给11种元素组成的所有物质中都存在化学键
C.由①④⑤⑧组成的强酸酸式盐溶于水,由④⑦组成的物质熔化,两个过程都存在共价键被破坏
D.由①⑩组成物质因为分子间存在氢键,所以比①⑨组成物质更稳定,比①⑨组成物质沸点高
(5)聚四氟化烯常用于炊具的“不粘涂层”。制备四氟化烯的反应原理为:2CHClF2(g) C2F4(g)+2HCl(g) △H1(反应I),副反应为:3CHClF2(g)
C2F4(g)+2HCl(g) △H1(反应I),副反应为:3CHClF2(g)  C3F6(g)+3HCl(g) △H2(反应II),① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:
C3F6(g)+3HCl(g) △H2(反应II),① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:_________ (填标号)。
A.混合气体密度不再改变
B.混合气体平均相对分子质量不再改变
C. 正(C2F4)=2
正(C2F4)=2 逆(HCl)
逆(HCl)
D.c(C2F4)与c(HCl)比值保持不变
②已知△H1>0,则反应I_________ (填“高温可自发”“低温可自发”“任意温度下可自发”“任意温度不可自发”)。
| IA | IIA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 1 | ① | ⑪ | ||||||
| 2 | ② | ③ | ④ | ⑩ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)已知由④⑧两元素组成的两种物质之间的相互转化叫做催化氧化,是工业制硫酸中的一步重要反应,写出此反应的化学反应方程式:
(3)由④、⑤、⑨三种元素组成的某物质是漂白液的有效成份,写出此物质的电子式:
(4)下列说法正确的是
A.H2O与D2O互为同位素,H2与D2互为同素异形体
B.上表所给11种元素组成的所有物质中都存在化学键
C.由①④⑤⑧组成的强酸酸式盐溶于水,由④⑦组成的物质熔化,两个过程都存在共价键被破坏
D.由①⑩组成物质因为分子间存在氢键,所以比①⑨组成物质更稳定,比①⑨组成物质沸点高
(5)聚四氟化烯常用于炊具的“不粘涂层”。制备四氟化烯的反应原理为:2CHClF2(g)
 C2F4(g)+2HCl(g) △H1(反应I),副反应为:3CHClF2(g)
C2F4(g)+2HCl(g) △H1(反应I),副反应为:3CHClF2(g)  C3F6(g)+3HCl(g) △H2(反应II),① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:
C3F6(g)+3HCl(g) △H2(反应II),① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:A.混合气体密度不再改变
B.混合气体平均相对分子质量不再改变
C.
 正(C2F4)=2
正(C2F4)=2 逆(HCl)
逆(HCl)D.c(C2F4)与c(HCl)比值保持不变
②已知△H1>0,则反应I
您最近一年使用:0次
23. 氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。请回答下列问题:
(1)已知:H2的燃烧热ΔH=-285.8 kJ·mol-1
N2(g)+2O2(g)= 2NO2(g) ΔH=+133 kJ·mol-1
H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则H2和NO2反应生成两种无污染的气体的热化学反应方程式为___________ 。
(2)一定温度下,向2 L恒容密闭容器中充入0.40 mol N2O4,发生反应N2O4(g) 2NO2(g)ΔH=+Q kJ·mol-1,一段时间后达到平衡,测得数据如下:
2NO2(g)ΔH=+Q kJ·mol-1,一段时间后达到平衡,测得数据如下:
①0~40 s内,υ(NO2)=_______ 。
②达平衡时,反应体系吸收的热量为________ kJ(用Q表示)。
③该温度下反应2NO2(g) N2O4(g)的化学平衡常数K=
N2O4(g)的化学平衡常数K=_________ 。
④相同温度下,若开始时向该容器中充入0.80 mol N2O4,则达到平衡后c(NO2)____ (填“>”“=”或“<”)0.60 mol·L-1。
(3)已知2NO(g)+O2(g) 2NO2(g) ΔH的反应历程分两步:
2NO2(g) ΔH的反应历程分两步:
①2NO(g) N2O2(g)(快) ΔH1<0,υ1正=k1正c2(NO),υ1逆=k1逆c(N2O2)
N2O2(g)(快) ΔH1<0,υ1正=k1正c2(NO),υ1逆=k1逆c(N2O2)
②N2O2(g)+O2(g) 2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)·c(O2),υ2逆=k2逆c2(NO2)
2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)·c(O2),υ2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1__ (填“>”“<”或“=”)E2,其判断理由是_______ ,2NO(g)+O2(g)  2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为____________ 。
(4)工业上电解MnSO4溶液制备Mn、MnO2和硫酸溶液,工作原理如图所示,离子交换膜允许阴离子通过,右侧的电极反应式为______ ,当电路中有2 mol e-转移时,左侧溶液质量________ (增重或减轻)__________ g。

(1)已知:H2的燃烧热ΔH=-285.8 kJ·mol-1
N2(g)+2O2(g)= 2NO2(g) ΔH=+133 kJ·mol-1
H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则H2和NO2反应生成两种无污染的气体的热化学反应方程式为
(2)一定温度下,向2 L恒容密闭容器中充入0.40 mol N2O4,发生反应N2O4(g)
 2NO2(g)ΔH=+Q kJ·mol-1,一段时间后达到平衡,测得数据如下:
2NO2(g)ΔH=+Q kJ·mol-1,一段时间后达到平衡,测得数据如下:| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/(mol·L-1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
②达平衡时,反应体系吸收的热量为
③该温度下反应2NO2(g)
 N2O4(g)的化学平衡常数K=
N2O4(g)的化学平衡常数K=④相同温度下,若开始时向该容器中充入0.80 mol N2O4,则达到平衡后c(NO2)
(3)已知2NO(g)+O2(g)
 2NO2(g) ΔH的反应历程分两步:
2NO2(g) ΔH的反应历程分两步:①2NO(g)
 N2O2(g)(快) ΔH1<0,υ1正=k1正c2(NO),υ1逆=k1逆c(N2O2)
N2O2(g)(快) ΔH1<0,υ1正=k1正c2(NO),υ1逆=k1逆c(N2O2)②N2O2(g)+O2(g)
 2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)·c(O2),υ2逆=k2逆c2(NO2)
2NO2(g)(慢) ΔH2<0,υ2正=k2正c(N2O2)·c(O2),υ2逆=k2逆c2(NO2)比较反应①的活化能E1与反应②的活化能E2的大小:E1
 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为(4)工业上电解MnSO4溶液制备Mn、MnO2和硫酸溶液,工作原理如图所示,离子交换膜允许阴离子通过,右侧的电极反应式为

您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
24. 二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
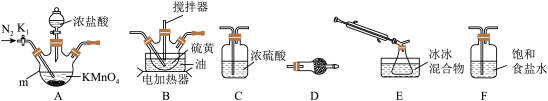
①仪器m的名称为___ ,装置F中试剂的作用是___ 。
②装置连接顺序:A→___ →E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___ 。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___ 。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___ 。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___ (填“可行”或“不可行”),原因是___ 。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
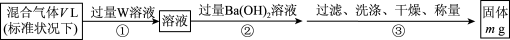
①W溶液可以是___ (填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____ (用含V、m的式子表示)。
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2  2SCl2; 2SCl2;③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。

①仪器m的名称为
②装置连接顺序:A→
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是
④为了提高S2Cl2的纯度,实验的关键是控制好温度和
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
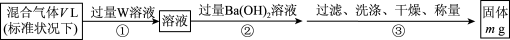
①W溶液可以是
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为
您最近一年使用:0次
2019-12-10更新
|
578次组卷
|
7卷引用:陕西省宝鸡中学、西安三中等五校2020届高三上学期第一次联考化学试题
解答题-工业流程题
|
适中(0.65)
名校
解题方法
25. 某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时,Cr2O3发生反应的化学方程式为_________ 。
(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有____ (填化学式)。
(3)用平衡移动原理解释酸化过程中可以得到Na2Cr2O7溶液________________ ,写出还原过程中的化学反应方程式_______________ ,此工艺流程中可以循环利用的物质___________ 。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定。(已知Cr2O 被还原为Cr3+)
被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为___________ 。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00 mL,则所得产品中K2Cr2O7的纯度为__________ 。[已知M(K2Cr2O7)=294 g·mol-1]

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2
 2CuO+TeO2。
2CuO+TeO2。(1)煅烧时,Cr2O3发生反应的化学方程式为
(2)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有
(3)用平衡移动原理解释酸化过程中可以得到Na2Cr2O7溶液
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定。(已知Cr2O
 被还原为Cr3+)
被还原为Cr3+)①氧化还原滴定过程中的离子方程式为
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00 mL,则所得产品中K2Cr2O7的纯度为
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:认识化学科学、化学反应原理、化学与STSE、常见无机物及其应用、物质结构与性质、化学实验基础
试卷题型(共 25题)
题型
数量
单选题
20
多选题
1
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 胶体的性质和应用 金属的电化学腐蚀与防护 金属与合金性能比较 | |
| 2 | 0.65 | 氧化还原反应的应用 | |
| 3 | 0.4 | 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 4 | 0.65 | 离子反应的发生及书写 离子方程式的正误判断 | |
| 5 | 0.65 | 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 电解原理的理解及判断 | |
| 6 | 0.85 | 离子方程式的正误判断 离子共存 | |
| 7 | 0.85 | 中和热 热化学方程式书写及正误判断 表示燃烧热的热化学方程式书写 | |
| 8 | 0.65 | 硅的制备 电解法制取铝 铁矿石与高炉炼铁 铜的电解精炼 | |
| 9 | 0.65 | 元素周期律、元素周期表的推断 金属与非金属在周期表中位置及其性质递变的规律 元素金属性与非金属性递变规律的理解及应用 “位构性”关系理解及应用 | |
| 10 | 0.65 | 次氯酸及其性质 酸性氧化物的通性 影响化学反应速率的外因 化学实验方案的设计与评价 | |
| 11 | 0.85 | 焓变 化学能与物质稳定性之间的关系 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |
| 12 | 0.65 | 元素周期律、元素周期表的推断 金属与非金属在周期表中位置及其性质递变的规律 根据原子结构进行元素种类推断 化学键基本概念 | |
| 13 | 0.65 | 化学平衡的移动及其影响因素 化学平衡常数的影响因素及应用 产物的物质的量与温度、压强的图像关系分析 结合反应热图像与化学平衡的综合考查 | |
| 14 | 0.65 | 氧化还原反应有关计算 氧化还原反应在生活、生产中的应用 | |
| 15 | 0.65 | 原电池电极反应式书写 二次电池 电解原理的应用 原电池、电解池综合考查 | |
| 16 | 0.65 | 氨气 氨的还原性 | |
| 18 | 0.4 | 化学反应原理综合考查 外界条件对化学平衡影响的图像 与转化率变化有关图像的分析 | |
| 19 | 0.65 | 化学平衡图像分析 外界条件对化学平衡影响的图像 化学反应速率与化学平衡的综合应用 | |
| 20 | 0.15 | 无机综合推断 氨的还原性 铁的其他化合物 电解过程中溶液pH的变化 | |
| 21 | 0.65 | 原电池原理的应用 原电池正负极判断 原电池有关计算 | |
| 二、多选题 | |||
| 17 | 0.65 | 二次电池 其他二次电池 | |
| 三、解答题 | |||
| 22 | 0.65 | 原子、离子、原子团及其电子式的书写与判断 化学平衡状态的判断方法 复合判据 “位构性”关系理解及应用 | 结构与性质 |
| 23 | 0.65 | 化学反应原理综合考查 盖斯定律与热化学方程式 化学平衡题中基于图表数据的相关计算 电解原理 | 原理综合题 |
| 24 | 0.65 | 氯气的实验室制法 常见无机物的制备 物质含量的测定 物质制备的探究 | 实验探究题 |
| 25 | 0.65 | 氧化还原反应方程式的配平 浓度对化学平衡移动的影响 酸碱中和滴定原理的应用 铜的电解精炼 | 工业流程题 |



