浙江省东阳中学2019-2020学年高二10月月考化学试题
浙江
高二
阶段练习
2019-10-22
383次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、物质结构与性质、常见无机物及其应用、化学反应原理、化学实验基础
一、单选题 添加题型下试题
A | B | C | D | |
| 垃圾 | 废易拉罐 | 废塑料瓶 | 废荧光灯管 | 不可再生废纸 |
| 垃圾分类 |  可回收物 |  其他垃圾 |  有害垃圾 |  可燃垃圾 |
| A.A | B.B | C.C | D.D |
A.中子数为18的氯原子: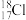 |
| B.N2的结构式:N=N |
C.Na+的结构示意图: |
D.H2O的电子式: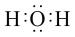 |
【知识点】 化学用语综合判断 原子核外电子的排布 核素 共价键与离子键的比较解读
 。下列说法正确的是
。下列说法正确的是A.1L0.1mol· NH4Cl溶液中, NH4Cl溶液中, 的数量为0.1 的数量为0.1 |
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1 |
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2 |
D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 |
【知识点】 阿伏加德罗常数 阿伏加德罗定律 氧化还原反应有关计算
| A.0.1mol·L−1NaOH溶液:Na+、K+、CO32-、AlO2- |
| B.0.1mol·L−1FeCl2溶液:K+、Mg2+、SO42-、MnO4- |
| C.0.1mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH− |
| D.0.1mol·L−1H2SO4溶液:K+、NH4+、NO3-、I- |
【知识点】 离子共存 限定条件下的离子共存解读
| A.NH4HCO3受热易分解,可用作化肥 |
| B.稀硫酸具有酸性,可用于除去铁锈 |
| C.SO2具有氧化性,可用于纸浆漂白 |
| D.Al2O3具有两性,可用于电解冶炼铝 |
| A.水在反应中可能起催化作用 | B.该反应中NH4NO3只作氧化剂 |
| C.常温下每消耗1.3 g Zn粉,即可产生336 ml N2 | D.每生成1 mol N2共转移2 mol电子 |
【知识点】 氧化还原反应的应用 氧化还原反应有关计算
 N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是| A.容器内压强保持不变 | B.v正(N2)=2v逆(NO) |
| C.N2与CO2的物质的量之比为1∶1 | D.容器内混合气体的密度保持不变 |
【知识点】 化学平衡状态的判断方法解读
| A.反应物的总能量低于生成物的总能量时,该反应必须加热才能发生 |
| B.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-akJ·mol-1,则中和热为0.5akJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l);△H1=-akJ·mol-1,则氢气燃烧热为akJ·mol-1 |
| D.N2(g)+3H2(g)=2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量 |
| A.改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 |
| B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确 |
| C.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失 |
| D.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 |
【知识点】 中和热的测定与误差分析解读
| 物质(括号内为杂质) | 除杂试剂 | |
| A | FeCl2溶液(FeCl3) | Fe粉 |
| B | NaCl溶液(MgCl2) | NaOH溶液、稀HCl |
| C | Cl2(HCl) | H2O、浓H2SO4 |
| D | NO(NO2) | H2O、无水CaCl2 |
| A.A | B.B | C.C | D.D |
【知识点】 氧化还原反应的规律解读 物质分离、提纯的常见化学方法解读
 N2+6NH4Cl,被氧化的NH3与被还原的Cl2的物质的量之比为
N2+6NH4Cl,被氧化的NH3与被还原的Cl2的物质的量之比为| A.2∶3 | B.8∶3 | C.6∶3 | D.3∶2 |
【知识点】 与氧化剂、还原剂有关的计算解读
A.NaCl(aq) Cl2(g) Cl2(g)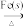 FeCl2(s) FeCl2(s) |
B.AlCl3(aq)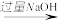 Al(OH)3(s) Al(OH)3(s)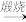 Al2O3(s) Al2O3(s) |
C.S(s) SO3(g) SO3(g) H2SO4(aq) H2SO4(aq) |
D.N2(g)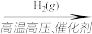 NH3(g) NH3(g) NaHCO3(s) NaHCO3(s) |

| A.Pd电极b为阴极 |
B.阴极的反应式为:N2+6H++6e− 2NH3 2NH3 |
| C.H+由阳极向阴极迁移 |
| D.陶瓷可以隔离N2和H2 |
【知识点】 电解原理的应用
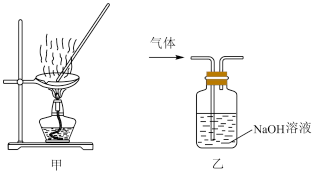
| A.用经水湿润的pH试纸测量溶液的pH |
| B.将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 mol·L−1NaOH溶液 |
| C.用装置甲蒸干AlCl3溶液制无水AlCl3固体 |
| D.用装置乙除去实验室所制乙烯中的少量SO2 |

| A.经过阳离子交换树脂后,水中阳离子的总数不变 |
B.水中的 、 、 、Cl−通过阴离子树脂后被除去 、Cl−通过阴离子树脂后被除去 |
| C.通过净化处理后,水的导电性降低 |
D.阴离子树脂填充段存在反应H++OH− H2O H2O |
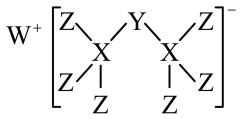
| A.WZ的水溶液呈碱性 |
| B.元素非金属性的顺序为X>Y>Z |
| C.Y的最高价氧化物的水化物是中强酸 |
| D.该新化合物中Y不满足8电子稳定结构 |
二、多选题 添加题型下试题
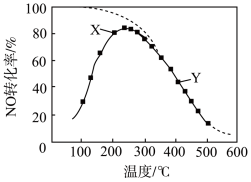
A.反应2NO(g)+O2(g) 2NO2(g)的ΔH>0 2NO2(g)的ΔH>0 |
| B.图中X点所示条件下,延长反应时间能提高NO转化率 |
| C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率 |
| D.380℃下,c起始(O2)=5.0×10−4 mol·L−1,NO平衡转化率为50%,则平衡常数K>2000 |
三、单选题 添加题型下试题
| A.1: 2 | B.3: 2 | C.2: 1 | D.1: 4 |
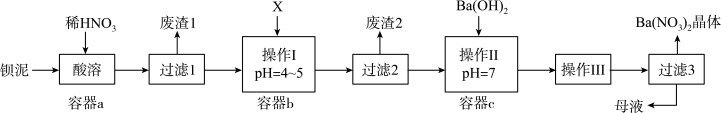
已知:①Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小
下列有关说法不正确的是( )
| A.过滤2后滤液中含有硝酸,操作Ⅱ加入氢氧化钡中和得到硝酸钡溶液 |
| B.X试剂应选过量的H2O2,目的是为了使溶液中的Fe2+转化为Fe3+,最终转化为Fe(OH)3沉淀 |
| C.操作Ⅲ蒸发结晶、冷却结晶 |
| D.此工艺流程生产流程会有氮的氧化物造成造成大气污染 |
【知识点】 溶度积 物质分离、提纯综合应用解读
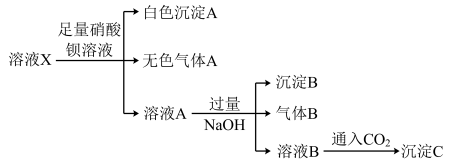
下列说法中正确的是( )
| A.无法确定沉淀C的成分 |
| B.无法确定原溶液中是否含有Cl-、A13+ |
| C.溶液A中存在的阳离子有Ba2+、Fe2+、NH4+、H+ |
| D.原溶液中存在Fe2+、NH4+、Cl-、SO42- |
四、解答题 添加题型下试题
(1)经测定晶体甲的摩尔质量为482g·mol- 1,其中阳离子与阴离子物质的量之比为1: 1,则甲晶体的化学式为
(2)向甲溶液中加入淀粉-碘化钾混合液,溶液变蓝,写出有关离子方程
(3)写出检验晶体中10电子的阳离子的操作及现象:

回答下列问题:
(1)A中发生反应的化学方程式是
(2)B中加入的物质是
(3)实验时在C中观察到的现象是
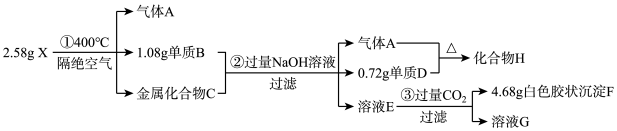
(1)写出单质D对应的阳离子结构示意图:
(2)X在400℃下分解的化学方程式:
(3)写出单质B与NaOH溶液反应的离子方程式:
(4)化合物H
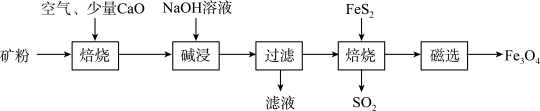
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为
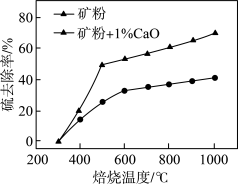
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题图所示。
已知:多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1−
 )×100%
)×100%①不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与Al混合在高温下发生的反应方程式
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂,可由Cl2和NO在通常反应条件下制得,反应方程式为2NO(g)+Cl2(g) ⇌ 2ClNO(g)。已知几种化学键的键能数据如表所示:
| 化学键 | Cl-Cl | Cl-N | N=O | N≡O(NO) |
| 键能(kJ·mol-1) | 243 | a | 607 | 630 |
(2)温度一定时,在一个体积为1L的密闭容器中通入2moNO和1molCl2,10min时ClNO体积占气体总体积40%,反应开始到10min内NO的平均V(NO)=
(3)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,装置如图所示:
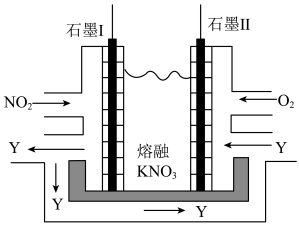
电池工作时,NO2转变成绿色硝化剂Y(N2O5),可循环使用,则石墨Ⅱ为电源
五、计算题 添加题型下试题
(1)固体中Cu2O的质量;
(2)产生的NO在标况下体积;
(3)固体物质与硝酸反应后,剩余的硝酸的物质的量浓度(忽略溶液体积变化)。
试卷分析
试卷题型(共 26题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 固体废弃物的处理 “白色污染”危害及防治 工业固体废弃物的处理 金属废弃物的回收及利用 | |
| 2 | 0.85 | 化学用语综合判断 原子核外电子的排布 核素 共价键与离子键的比较 | |
| 3 | 0.4 | 阿伏加德罗常数 阿伏加德罗定律 氧化还原反应有关计算 | |
| 4 | 0.65 | 离子共存 限定条件下的离子共存 | |
| 5 | 0.85 | 二氧化硫 金属物理通性 | |
| 6 | 0.65 | 氧化还原反应的应用 氧化还原反应有关计算 | |
| 7 | 0.65 | 化学平衡状态的判断方法 | |
| 8 | 0.65 | 化学反应热的计算 中和热 | |
| 9 | 0.65 | 中和热的测定与误差分析 | |
| 10 | 0.65 | 氧化还原反应的规律 物质分离、提纯的常见化学方法 | |
| 11 | 0.65 | 与氧化剂、还原剂有关的计算 | |
| 12 | 0.65 | 物质的转化 含硫化合物之间的转化 碳酸钠与碳酸氢钠的相互转化 铝三角转化 | |
| 13 | 0.4 | 电解原理的应用 | |
| 14 | 0.85 | 测定溶液pH的方法 盐类水解在解题方面的应用 配制一定物质的量浓度的溶液的步骤、操作 物质分离、提纯的常见化学方法 | |
| 15 | 0.65 | 物质水溶液的导电性 硬水软化 | |
| 16 | 0.65 | 元素周期律、元素周期表的推断 元素周期表提供的元素信息 “定位法”在推断中的应用 | |
| 18 | 0.4 | 物质的量浓度计算-溶液混合的有关计算 硝酸的强氧化性 | |
| 19 | 0.65 | 溶度积 物质分离、提纯综合应用 | |
| 20 | 0.4 | 离子反应的实际应用 离子反应在化合物组成的分析、鉴定的应用 | |
| 二、多选题 | |||
| 17 | 0.65 | 化学平衡图像分析 温度对化学平衡移动的影响 化学平衡常数的有关计算 | |
| 三、解答题 | |||
| 21 | 0.65 | 离子反应在化合物组成的分析、鉴定的应用 铵根离子的检验 常见阳离子的检验 | 无机推断题 |
| 22 | 0.65 | 氨的还原性 氨气的实验室制法 物质性质的探究 | 实验探究题 |
| 23 | 0.65 | 原子结构示意图、离子结构示意图 离子方程式的书写 无机综合推断 铝与强碱溶液反应 | 无机推断题 |
| 24 | 0.65 | 含氧化铝的混合物的提纯 有关铁及其化合物转化的流程题型 物质分离、提纯综合应用 | 工业流程题 |
| 25 | 0.65 | 根据△H=反应物的键能之和-生成物的键能之和进行计算 化学反应速率计算 原电池原理 新型电池 | 原理综合题 |
| 四、计算题 | |||
| 26 | 0.65 | 硝酸的强氧化性 铜与强氧化性酸的反应 氧化亚铜 探究物质组成或测量物质的含量 | |



