江苏省苏州新草桥中学2020届高三上学期10月月考化学试题
江苏
高三
阶段练习
2020-04-19
330次
整体难度:
容易
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学反应原理、物质结构与性质、化学实验基础、初中衔接知识点
一、单选题 添加题型下试题
| A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 |
| B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 |
| C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 |
| D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点 |
| A.强电解质溶液的导电性一定比弱电解质溶液的导电性强 |
| B.食盐溶液能导电,所以它是电解质 |
| C.SO3的水溶液可以导电,但它不是电解质 |
| D.NaHSO4无论是在水溶液里还是在熔融状态都可以电离去出Na+、H+和so42- |
【知识点】 非电解质、电解质物质类别判断解读 强电解质与弱电解质解读
A.中子数为8的氮原子: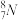 | B.HCl 的电子式: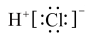 |
C.NH3的结构式: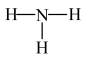 | D.Cl−的结构示意图: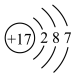 |
【知识点】 有关粒子结构的化学用语 核素 核外电子排布规律解读 共价键与离子键的比较解读
| A.Al3+、CH3COO-、Cl- | B.Mg2+、Ba2+、Br- |
| C.Mg2+、Cl-、I- | D.Na+、NH4+、Cl- |
【知识点】 离子共存 限定条件下的离子共存解读
| A.Cl2+2Br-=2Cl-+Br2,Zn+Cu2+=Zn2++Cu均为单质被还原的置换反应 |
| B.2Na2O2+2H2O=4NaOH+O2↑,Cl2+H2O=HCl+HClO,均为水作还原剂的氧化还原反应 |
| C.Na2SO3与H2O2的反应为氧化还原反应 |
| D.生石灰用作食品抗氧化剂 |
| A.生石灰能与水反应,可用于实验室干燥氯气 |
| B.二氧化氯具有强氧化性,可用于自来水的杀菌消毒 |
| C.常温下,铝与浓硫酸发生钝化,可用铝槽车贮运浓硫酸 |
| D.钠是一种具有强还原性的金属,可用于冶炼钛、锆、铌等金属 |
| A.明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
| C.SO2具有氧化性,可用于漂白纸浆 |
| D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
| A.向硝酸银溶液中加盐酸Ag++C1-=AgCl↓ |
| B.酸化NaIO3和NaI的混合溶液:I-+IO3-+6H+=I2+3H2O |
| C.盐酸跟氢氧化镁反应:H++OH-=H2O |
D.电解饱和食盐水:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
A.NaCl(aq) Cl2(g) Cl2(g)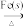 FeCl2(s) FeCl2(s) |
B.MgCl2(aq) Mg(OH)2(s) Mg(OH)2(s)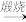 MgO (s) MgO (s) |
C.S(s) SO3(g) SO3(g) H2SO4(aq) H2SO4(aq) |
D.N2(g)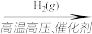 NH3(g) NH3(g) Na2CO3(s) Na2CO3(s) |
【知识点】 物质的转化 氯气与金属单质的反应解读 含硫化合物之间的转化解读 纯碱的生产解读
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使酸性高锰酸钾溶液褪色 |
| B | NH3极易溶于水 | 充满NH3的试管倒置于水槽中,水面迅速上升 |
| C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| D | 常温下,铁与浓硝酸发生钝化 | 常温下,铁与浓硝酸不反应 |
| A.A | B.B | C.C | D.D |
【知识点】 化学实验方案的设计与评价 物质性质实验方案的设计解读
| A.1 mol Cl2参加反应转移电子数一定为2NA |
| B.在反应KIO3 + 6HI = KI + 3I2 +3H2O中,每生成3 mol I2转移的电子数为6NA |
C.根据反应中HNO3(稀)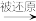 NO,而HNO3(浓) NO,而HNO3(浓)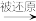 NO2可知,氧化性:HNO3(稀) > HNO3(浓) NO2可知,氧化性:HNO3(稀) > HNO3(浓) |
| D.含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl- |
| A.原子半径:r(W) > r(Z) > r(Y) |
| B.由X、Y 组成的化合物中均不含共价键 |
| C.Y 的最高价氧化物的水化物的碱性比Z的弱 |
| D.X 的简单气态氢化物的热稳定性比W的强 |
【知识点】 元素周期律、元素周期表的推断
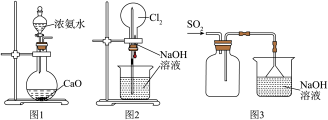
| A.用图1所示装置制取少量的氨气 |
| B.用图2装置可以完成“喷泉”实验 |
| C.用图3所示装置收集SO2 |
| D.同浓度的碳酸钠、碳酸氢钠溶液,可滴加酚酞进行鉴别 |
二、多选题 添加题型下试题
A.用惰性电极电解氯化铝溶液:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| B.NaHSO3溶液在空气中变质:2HSO3-+O2=2SO42-+2H+ |
| C.酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++3H2O2=2Cr3++3O2↑+7H2O |
| D.向Ag(NH3)2OH溶液中加入盐酸:Ag++Cl-=AgCl↓ |
三、单选题 添加题型下试题
| A.能使酚酞变红的溶液中: Na+、K+、SiO32-、CO32- |
| B.c(ClO-)= 1mol·L-1的溶液中: H+、NH4+、Cl-、I- |
| C.c(H+)/c(OH-)=1×1012mol·L-1的溶液中: NH4+、Cu2+、SO42-、CH3COO- |
| D.由水电离产生的c(H+)=1×10-13 mol·L-1的溶液中: Na+、Fe2+、 SCN-、NO3- |
【知识点】 离子共存 限定条件下的离子共存解读
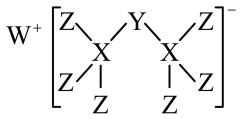
| A.WZ的水溶液呈碱性 |
| B.元素非金属性的顺序为X>Y>Z |
| C.Y的最高价氧化物的水化物是中强酸 |
| D.该新化合物中Y不满足8电子稳定结构 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
| B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
| C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
| D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
| A.A | B.B | C.C | D.D |
【知识点】 溶度积常数与溶解度的关系解读 化学实验方案的设计与评价
 还原
还原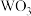 制备金属W的装置如图所示(
制备金属W的装置如图所示( 粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是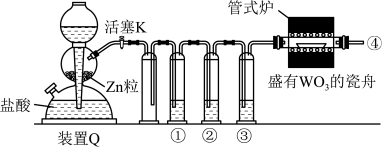
A.①、②、③中依次盛装 溶液、浓 溶液、浓 、焦性没食子酸溶液 、焦性没食子酸溶液 |
| B.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 |
| C.结束反应时,先关闭活塞K,再停止加热 |
| D.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 |
四、解答题 添加题型下试题

已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为
(2)A与B生成D的反应在工业上是生产
(3)E与G的稀溶液反应的离子方程式为
(4)B和C反应的化学方程式为
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:
五、填空题 添加题型下试题
(2)用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2。写出该反应的离子方程式:
(3)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:
(4)Cl2与热的NaOH溶液反应生成NaClO3,该反应的离子方程式为
(5)在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,写出该反应的离子方程式:
六、解答题 添加题型下试题
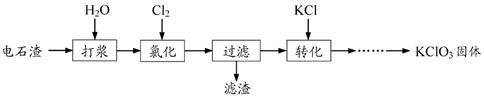
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O。氯化完成后过滤。
①滤渣的主要成分为
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2]
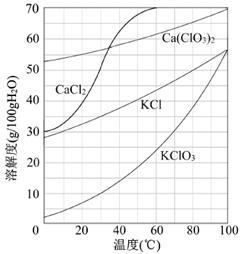
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g▪L-1,从该溶液中尽可能多地析出KClO3固体的方法是
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH−
 2
2 +H2O
+H2O2NO2+2OH−

 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。①在酸性NaClO溶液中,HClO氧化NO生成Cl−和
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是


(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
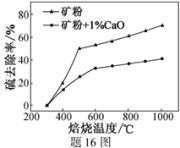
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—
 )×100%
)×100%①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由
(4)“过滤”得到的滤渣中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=
试卷分析
试卷题型(共 23题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 含硅的无机非金属材料 化学对材料制造和应用的作用 传统硅酸盐材料 | |
| 2 | 0.85 | 非电解质、电解质物质类别判断 强电解质与弱电解质 | |
| 3 | 0.85 | 有关粒子结构的化学用语 核素 核外电子排布规律 共价键与离子键的比较 | |
| 4 | 0.94 | 离子共存 限定条件下的离子共存 | |
| 5 | 0.65 | 氧化还原反应在生活、生产中的应用 氧化还原反应的规律 | |
| 6 | 0.65 | 氯气的用途 氯气与碱溶液反应 铝的钝化 常见金属的冶炼 | |
| 7 | 0.94 | 二氧化硫的漂白性 明矾的净水作用及原理 Fe、Cu及相关离子的反应 锰锌干电池 | |
| 8 | 0.65 | 离子反应的发生及书写 离子反应的发生条件 离子方程式的书写 离子方程式的正误判断 | |
| 9 | 0.65 | 物质的转化 氯气与金属单质的反应 含硫化合物之间的转化 纯碱的生产 | |
| 10 | 0.85 | 化学实验方案的设计与评价 物质性质实验方案的设计 | |
| 11 | 0.85 | 氯气的化学性质 硝酸的强氧化性 | |
| 12 | 0.85 | 元素周期律、元素周期表的推断 | |
| 13 | 0.65 | 氨气的制备 碳酸钠与碳酸氢钠鉴别的实验 化学实验方案的设计与评价 物质性质实验方案的设计 | |
| 15 | 0.65 | 离子共存 限定条件下的离子共存 | |
| 16 | 0.65 | 元素周期律、元素周期表的推断 元素周期表提供的元素信息 “定位法”在推断中的应用 | |
| 17 | 0.65 | 溶度积常数与溶解度的关系 化学实验方案的设计与评价 | |
| 18 | 0.65 | 氯气的实验室制法 常用仪器及使用 物质性质的探究 化学实验 | |
| 二、多选题 | |||
| 14 | 0.65 | 离子反应的发生及书写 离子反应的发生条件 离子方程式的书写 离子方程式的正误判断 | |
| 三、解答题 | |||
| 19 | 0.65 | 氧化还原反应方程式的配平 无机综合推断 氨的还原性 铜与强氧化性酸的反应 | 无机推断题 |
| 21 | 0.65 | 化学反应条件的控制及优化 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 22 | 0.85 | 氧化还原反应方程式的书写与配平 次氯酸及其性质 二氧化氮与碱液的反应 化学反应条件的控制及优化 | 原理综合题 |
| 23 | 0.4 | 二氧化硫的化学性质 偏铝酸钠与二氧化碳的反应 铁的氧化物 常见无机物的制备 | 工业流程题 |
| 四、填空题 | |||
| 20 | 0.65 | 离子方程式的书写 氧化还原反应方程式的配平 氧化还原反应的规律 二氧化硫的弱氧化性 | |



