贵州省安顺市普定县第一中学2018-2019学年高一上学期12月份考试化学试题
贵州
高一
阶段练习
2018-12-18
442次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学实验基础、化学与STSE、物质结构与性质
一、单选题 添加题型下试题
| A.1∶0.45 | B.1∶1 | C.1∶0.29 | D.4.5∶2.9 |
二、未知 添加题型下试题
三、单选题 添加题型下试题

| A.蒸馏、蒸发、萃取、过滤 | B.萃取、过滤、蒸馏、蒸发 |
| C.蒸馏、过滤、萃取、蒸发 | D.过滤、蒸发、萃取、蒸馏 |
四、多选题 添加题型下试题
| A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸 |
B.浓硫酸具有强氧化性, 、 、 、 、 具有还原性,故浓硫酸不能干燥 具有还原性,故浓硫酸不能干燥 、 、 、 、 |
| C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性 |
D.浓硫酸与亚硫酸钠反应制取 时,浓硫酸表现出酸性 时,浓硫酸表现出酸性 |
五、单选题 添加题型下试题
| A.排除碳酸根离子的干扰 | B.排除硫酸根离子的干扰 |
| C.生成白色沉淀 | D.排除硝酸根离子的干扰 |
| A.可用加热法分离氯化钠和碳酸钙 |
| B.蒸馏和蒸发都用来分离液体混合物 |
| C.工业上制无水酒精通常是将生石灰与95%酒精混合后蒸馏 |
| D.碘水中加四氯化碳振荡静置后,上层为紫色,下层几乎为无色 |
【知识点】 物质分离、提纯的常见物理方法 蒸馏与分馏解读
| A.熔成小球并在液面上游动 | B.有气体生成 |
| C.溶液变为红色 | D.溶液变浑浊 |
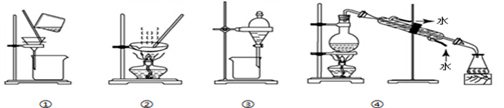
| A.分离水和泥沙选① | B.从盐水中获得食盐选② |
| C.分离酒精和水选③ | D.由自来水制取纯净水选④ |
【知识点】 化学实验基础
| A.青铜是我国使用最早的合金,也是目前使用最广泛的合金 |
| B.不管哪种铜合金都含有铜元素,所以它们的性质也和金属铜一样 |
| C.我们日常生活中用到的铜合金制品主要是黄铜制的 |
| D.各种铜合金都有良好的导电、导热性 |
【知识点】 金属材料的性质及利用
| A.先滴加氯水,再滴加KSCN溶液后显红色 |
| B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 |
| C.滴加酸性KMnO4溶液 |
| D.只需滴加KSCN溶液 |
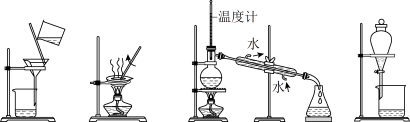
| A.蒸发、蒸馏、过滤、分液 | B.过滤、蒸发、蒸馏、分液 |
| C.过滤、蒸馏、蒸发、分液 | D.分液、蒸馏、蒸发、过滤 |
| A.2 g | B.1 g | C.8 g | D.10 g |
【知识点】 化学方程式计算中物质的量的运用解读 铝与酸溶液反应解读
| A.3 mol | B.2 mol | C.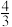 mol mol | D.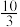 mol mol |
| A.7.5 | B.8.0 | C.9.5 | D.11.0 |
【知识点】 漂白粉和漂粉精
①0.6 mol NH3 ②0.2 mol H3PO4③9 g H2O ④标准状况下22.4 L He
| A.①②③④ | B.②③①④ | C.②①③④ | D.①②④③ |
六、多选题 添加题型下试题
| A.二氧化碳与水蒸气的物质的量之比为4∶1 |
| B.二氧化碳与水蒸气的质量之比为11∶18 |
| C.反应中有0.25 mol氧气放出 |
| D.参加反应过氧化钠的的质量为19.5 g |
七、单选题 添加题型下试题
| A.分离氯化钠和氯化银的混合物,可用蒸馏法 |
| B.从碳酸钠溶液中得到碳酸钠,可用过滤法 |
| C.分离酒精与四氯化碳的混合物,可用蒸馏法 |
| D.从碘的四氯化碳溶液中得到四氯化碳,可用萃取法 |
| A.强酸制取弱酸的原理 |
| B.可溶性酸制取难溶性酸的原理 |
| C.溶液中离子结合生成沉淀的原理 |
| D.氧化还原反应的原理 |
| A.11.2 L | B.5.6 L | C.4.48 L | D.2.24 L |
| A.铝原子最外层有3个电子 |
| B.铝是地壳中含量最多的金属元素 |
| C.在常温下,铝不能与氧气反应 |
| D.铝易被氧化,而Al3+则很难被还原 |
 Na2CO3+H2O+x,则x的化学式是( )
Na2CO3+H2O+x,则x的化学式是( )| A.CO | B.CO2 | C.H2 | D.CH4 |
A. | B. |
C.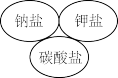 | D. |
| A.0.3 mol硝酸 | B.1.5 mol氧气 | C.1 mol氮 | D.0.5 mol氦原子 |
【知识点】 物质的量及单位——摩尔
八、未知 添加题型下试题
九、单选题 添加题型下试题
| A.天然二氧化硅俗称硅石 | B.石英的主要成分是二氧化硅 |
| C.水晶是无色透明的石英晶体 | D.自然界中存在大量的单质硅 |
【知识点】 二氧化硅
途径①:S
 H2SO4
H2SO4途径②:S
 SO2
SO2 SO3
SO3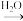 H2SO4
H2SO4途径③:FeS2
 SO2
SO2 SO3
SO3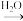 H2SO4
H2SO4| A.途径①的反应中体现了浓硝酸的强氧化性 |
| B.途径②、③的第二步反应在实际生产中可以通过增大氧气的浓度来降低成本 |
| C.由途径①、②、③分别制取1 mol 硫酸,理论上各消耗1 mol 硫,各转移6 mol 电子 |
| D.途径②、③比途径①污染相对小且原子利用率高 |
【知识点】 硝酸的强氧化性解读 含硫化合物之间的转化解读 电子转移计算
十、解答题 添加题型下试题

(1)铝在氧气中燃烧的化学方程式为
(2)实验时要在铝箔上系上一根火柴,其作用是
(3)集气瓶底部铺上一层细沙,其作用是
(4)实验中应观察到的现象是
(5)用正确方法引燃铝箔,伸入装有氧气的集气瓶中后,未观察到铝箔剧烈燃烧的现象,可能的原因是
 4NO2↑+O2↑+2H2O)。
4NO2↑+O2↑+2H2O)。
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,生成的气体的颜色为
(2)装置C中盛有足量Ba(OH)2溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为
(3)装置B的作用是
(4)装置D中收集到了无色气体,有同学认为是NO,还有同学认为是O2。
①下列对该气体的检验方法合适的是
A.敞口观察装置D中集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果D中集气瓶内收集到的无色气体是氧气,则氧气的来源是
【知识点】 硝酸 一氧化氮 二氧化氮 物质性质实验方案的设计解读
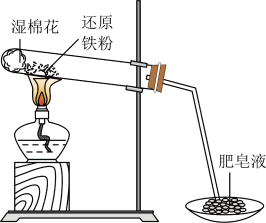
(1)硬质试管中发生反应的化学方程式为
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:
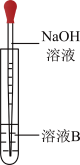
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明
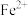 具有
具有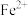 的盐溶液需现用现配制的原因是
的盐溶液需现用现配制的原因是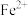 的盐溶液时应加入少量
的盐溶液时应加入少量【知识点】 铁盐与亚铁盐鉴别试剂的选择解读 化学实验探究
十一、填空题 添加题型下试题
①分别测定了0.1 mol·L-1的HCl、NaHSO4、NaHCO3溶液中H+的物质的量浓度,HCl溶液中c(H+)=0.1 mol·L-1,NaHSO4溶液中c(H+)=0.1 mol·L-1,而NaHCO3溶液中H+的物质的量浓度远远小于0.1 mol·L-1。
②取少量NaHSO4溶液于试管中,滴入BaCl2溶液有不溶于稀硝酸的白色沉淀生成。
③取少量NaHCO3溶液于试管中,滴入几滴BaCl2溶液无明显现象。
请根据实验结果回答下列问题:
(1)分别写出HCl、NaHSO4、NaHCO3在水溶液中的电离方程式:
HCl:
NaHSO4:
NaHCO3:
(2)NaHSO4属于“酸”“碱”“盐”中的
(3)写出②中反应的化学方程式:
(4)若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1∶1混合,化学方程式为
【知识点】 酸、碱、盐、氧化物的概念及其相互联系解读 电离方程式解读
试卷分析
试卷题型(共 33题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 物质的量浓度的计算 依据物质的量浓度公式的基础计算 氨的喷泉实验 | |
| 3 | 0.94 | 常用仪器及使用 蒸发与结晶 蒸馏与分馏 萃取和分液 | |
| 5 | 0.65 | 离子反应在混合物分离、除杂中的应用 常见阴离子的检验 | |
| 6 | 0.65 | 物质分离、提纯的常见物理方法 蒸馏与分馏 | |
| 7 | 0.65 | 钠的化学性质 钠与水反应原理 | |
| 8 | 0.64 | 化学实验基础 | |
| 9 | 0.85 | 金属材料的性质及利用 | |
| 10 | 0.65 | Fe2+的鉴别及其应用 Fe2+的还原性 铁盐的检验 | |
| 11 | 0.94 | 常用仪器及使用 物质分离、提纯的常见物理方法 蒸馏与分馏 萃取和分液 | |
| 12 | 0.65 | 化学方程式计算中物质的量的运用 铝与酸溶液反应 | |
| 13 | 0.65 | 氧化还原反应的定义及实质 氧化还原反应有关计算 与氧化剂、还原剂有关的计算 | |
| 14 | 0.65 | 漂白粉和漂粉精 | |
| 15 | 0.85 | 22.4L/mol适用条件 物质的量有关计算 根据n=N/NA进行相关计算 以N=m·NA/M为中心的有关基本粒子的推算 | |
| 16 | 0.85 | 硝酸的不稳定性 常用仪器及使用 | |
| 18 | 0.65 | 物质分离、提纯的常见物理方法 蒸馏与分馏 萃取和分液 过滤 | |
| 19 | 0.65 | 硅酸的制备 常见无机物的制备 物质制备的探究 | |
| 20 | 0.65 | 物质的量有关计算 硫单质的化学性质 | |
| 21 | 0.65 | 铝的物理性质及用途 铝与氧气的反应 “位构性”关系理解及应用 | |
| 22 | 0.65 | 碳酸钠的俗称、物理性质及用途 常见无机物的制备 纯碱的生产 | |
| 23 | 0.85 | 酸、碱、盐、氧化物的概念及其相互联系 胶体的定义及分类 电解质、非电解质概念 氧化还原反应定义、本质及特征 | |
| 24 | 0.65 | 物质的量及单位——摩尔 | |
| 25 | 0.94 | 分散系概念及其分类 胶体的定义及分类 胶体的性质和应用 | |
| 27 | 0.65 | 二氧化硅 | |
| 28 | 0.65 | 硝酸的强氧化性 含硫化合物之间的转化 电子转移计算 | |
| 二、未知 | |||
| 2 | 0.85 | 氧化性、还原性强弱的比较 氧化还原反应的规律 | 未知 |
| 26 | 0.65 | 胶体 分散系概念及其分类 胶体的定义及分类 | 未知 |
| 三、多选题 | |||
| 4 | 0.65 | 浓硫酸的吸水性 浓硫酸的脱水性 浓硫酸的强氧化性 | |
| 17 | 0.65 | 过氧化钠与水的反应 过氧化钠和二氧化碳反应 过氧化钠的相关计算 | |
| 四、解答题 | |||
| 29 | 0.65 | 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |
| 30 | 0.65 | 铝 化学实验探究 综合实验设计与评价 | 实验探究题 |
| 31 | 0.65 | 硝酸 一氧化氮 二氧化氮 物质性质实验方案的设计 | 实验探究题 |
| 32 | 0.65 | 铁盐与亚铁盐鉴别试剂的选择 化学实验探究 | 实验探究题 |
| 五、填空题 | |||
| 33 | 0.85 | 酸、碱、盐、氧化物的概念及其相互联系 电离方程式 | |



