西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题
西藏
高一
开学考试
2022-10-07
105次
整体难度:
适中
考查范围:
化学实验基础、有机化学基础、认识化学科学
西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题
西藏
高一
开学考试
2022-10-07
105次
整体难度:
适中
考查范围:
化学实验基础、有机化学基础、认识化学科学
一、单选题 添加题型下试题
单选题
|
适中(0.65)
您最近一年使用:0次
2021-09-02更新
|
83次组卷
|
2卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题
单选题
|
较易(0.85)
您最近一年使用:0次
2021-09-02更新
|
123次组卷
|
2卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题
单选题
|
容易(0.94)
名校
解题方法
3. 下列图示的四种实验操作名称从左到右依次是
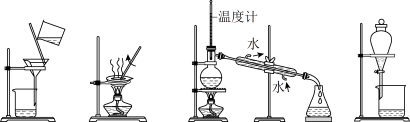

| A.蒸发、蒸馏、过滤、分液 | B.过滤、蒸发、蒸馏、分液 |
| C.过滤、蒸馏、蒸发、分液 | D.分液、蒸馏、蒸发、过滤 |
您最近一年使用:0次
2020-11-10更新
|
350次组卷
|
82卷引用:2010—2011学年江苏省扬州市安宜高中高一上学期期末考试化学试卷
(已下线)2010—2011学年江苏省扬州市安宜高中高一上学期期末考试化学试卷(已下线)2011-2012学年湖南省醴陵二中、醴陵四中高一上学期期中联考化学试卷(已下线)2011-2012学年福建省安溪、惠安、养正中学高一上学期期中联考化学试卷(已下线)2011-2012学年广东省珠海市高一上学期期末考试化学试卷(已下线)2012-2013学年山东济宁鱼台一中高一上学期期中考试化学试卷(已下线)2012-2013年广东省珠海市高一上学期期末质检化学试卷(B)(已下线)2012-2013学年吉林省实验中学高一上学期期末考试化学试卷(已下线)2012-2013学年福建省安溪一中高一上学期期中考试化学试卷(已下线)2012-2013年黑龙江哈尔滨第十二中学高一上学期期末考试化学试卷(已下线)2013-2014学年浙江省瑞安中学高一上学期期中考试化学试卷(已下线)2013-2014学年北京市西城区高一上学期期末考试化学试卷(已下线)2014届广东阳东广雅中学阳春实验中学上学期期末高一化学试卷2014-2015甘肃省天水市秦安县二中高一上学期月考化学试卷2014-2015学年北京市66中高一上学期期中考试化学试卷2014-2015江苏省涟水中学高二12月月考化学(必修)试卷2014-2015甘肃省肃南县一中高一上学期期末考试化学试卷2014-2015河北省邯郸市高一上学期期末考试化学试卷2014-2015山西省原平市一中高一上学期期末考试化学试卷2015-2016学年吉林省白城市通榆县一中高一上第一次月考化学试卷2015-2016学年贵州省乌当区新天学校高二上学期期中测试化学试卷2015-2016学年山西忻州第一中学高一上期中考试化学试卷2015-2016学年江苏省海安实验中学高一上学期期中测试化学试卷2015-2016学年湖北省宜昌市葛洲坝中学高一上学期期末化学试卷2015-2016学年江苏省淮安市钦工中学高一上学期期末化学试卷2016-2017学年吉林省汪清六中高一上第一次月考化学试卷2016-2017学年广东省湛江一中高一上第一次大考化学卷2016-2017学年江苏省无锡江阴市四校高一上期中化学试卷2016-2017学年福建省安溪一中、养正中学、惠安一中、泉州实验中学高一上学期期末联考化学试卷(已下线)1.1.2 蒸馏和萃取甘肃省武威第十八中学2017-2018学年高一上学期第一次月考化学试题甘肃省临洮县第二中学2017-2018学年高一上学期第一次月考化学试题广东省阳东广雅学校2017-2018学年高一10月月考化学试题高中化学人教版 必修1 第一章 从实验学化学 1.化学实验基本方法 混合物的分离和提纯(一)云南省中央民大附中芒市国际学校2017-2018学年高一上学期末考试化学试卷河南省济源市第四中学2018-2019学年高一上学期第一次质量检查化学试题福建省龙海市程溪中学2018-2019学年高一上学期期中考试化学试题贵州省安顺市普定县第一中学2018-2019学年高一上学期12月份考试化学试题云南省彝良县一中2018-2019学年高一上学期12月考试化学试题新疆维吾尔自治区且末县第二中学2018-2019学年高一上学期期末考试化学试题吉林蛟河一中2019-2020学年高一上学期第一次月考化学试题山东省临沂市罗庄区第十八中学2019-2020学年高一第一学期第一次月考化学试题安徽芜湖三中2019-2020学年高一上第一次月考化学山西省忻州市静乐县静乐一中2019-2020学年高一上学期第一次月考化学试卷广东省北京师范大学东莞石竹附属学校2019-2020学年高一10月月考化学试题河南省周口中英文学校2019-2020学年高一上学期第一次月考化学试题江西省宜春市宜丰县二中2019-2020学年高一上学期第一次月考化学试题江西省宜春市上高二中2019-2020学年高一上学期第一次月考化学试题黑龙江省大庆市东风中学2019-2020学年高一10月月考化学试题浙江省台州市五校2019-2020学年高一10月月考化学试题吉林省白城市第十四中学2019—2020学年高一上学期期中考试化学试题江西省上饶市上饶中学2019-2020学年高一上学期期中考试化学(实验、重点、特长班)试题安徽省黄山市黟县中学2019-2020学年高一上学期期中考试化学试题江西省宜春市宜丰县第二中学2019-2020学年高一上学期期中考试化学试题内蒙古锡林浩特市第六中学2019-2020学年高一上学期第一次月考化学试题湖北省宜昌市第二中学(人文艺术高级中学)2019-2020学年高一上学期10月月考化学试题山西省运城市景胜中学2019-2020学年高一上学期期中考试化学试题(已下线)【新东方】2019新中心五地129高中化学2020届高三化学实验复习——常用化学仪器的识别和使用【选择突破】(已下线)【南昌新东方】2019 南大附中 高一上第一次月考四川省凉山州普格县中学校2019-2020学年高一上学期第一次月考化学试题甘肃省兰州大学附属中学(33中)2019-2020学年高一上学期期中考试化学试题新疆维吾尔自治区阿勒泰地区2019-2020学年高二下学期期末考试化学试题(A卷)山西省晋中市祁县中学校2019-2020学年高一上学期10月月考化学试题内蒙古通辽市开鲁县第一中学2020-2021学年高一上学期第一次月考化学试题内蒙古自治区乌兰察布市集宁区第二中学2020-2021学年高一上学期第一次月考化学试题吉林省梅河口市朝鲜族中学2019-2020学年高一上学期期末考试化学试题吉林省梅河口市三校2019-2020学年高一上学期期末联考化学试题四川省广安市广安中学2020-2021学年高一上学期第一次月考化学试题福建省漳浦达志中学2020-2021学年高一上学期第一次月考化学试题宁夏吴忠市吴忠中学2020-2021学年高一上学期期中考试化学试题江西省赣州市会昌县第五中学2020-2021学年高一上学期第一次月考化学试题江苏省南通市海门实验学校2019-2020学年高一上学期学情调研化学试题云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题江苏省盐城市伍佑中学2021-2022学年高一上学期学情调研(一)化学试题江苏省沭阳县潼阳中学2021-2022学年高二上学期暑期教学质量检测化学试题宁夏银川市第六中学2021-2022学年高一上学期第一次月考化学试题甘肃省天水市秦安县第一中学2021-2022学年高二下学期期中考试化学试题(已下线)2020年海南卷化学高考真题变式题1-8上海市闵行区第三中学2021-2022学年高一上学期期中考试化学试题西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题宁夏银川市景博中学2021-2022学年高一下学期第二次月考化学试题(已下线)【新东方】化学巩固练习56
单选题
|
较易(0.85)
解题方法
4. 粗盐的提纯,常常加入一些化学试剂,使一些可溶性的杂质沉淀下来,过滤而除去,同时采用必要的操作,下列操作顺序正确的是
①加BaCl2 ②加NaOH ③加Na2CO3 ④加稀盐酸 ⑤过滤
①加BaCl2 ②加NaOH ③加Na2CO3 ④加稀盐酸 ⑤过滤
| A.①②③④⑤ | B.⑤④③②① | C.①②③⑤④ | D.③①②⑤④ |
您最近一年使用:0次
2021-09-02更新
|
309次组卷
|
3卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题
云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)3.2.3 离子反应-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题
单选题
|
较易(0.85)
解题方法
您最近一年使用:0次
2021-06-20更新
|
313次组卷
|
3卷引用:湖南省五市十校2020-2021学年高一上学期期末联考化学试题
湖南省五市十校2020-2021学年高一上学期期末联考化学试题(已下线)1.1.1 物质的分类-2021-2022学年高一化学10分钟课前预习练(人教版2019必修第一册)(附参考答案)西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题
单选题
|
适中(0.65)
6. 阿伏加德罗常数的值为NA,下列说法正确的是
| A.标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA |
| B.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA |
| C.在常温常压下,1molHe含有的原子数目为2NA |
| D.标准状况下,2.24LHCl溶于500mL水中所得溶液浓度为2mol/L |
您最近一年使用:0次
2022-09-25更新
|
185次组卷
|
3卷引用:西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题
单选题
|
较易(0.85)
解题方法
7. 500mL的KAl(SO4)2溶液中含有3.9g的K+,则该溶液中c(Al3+)为
| A.1mol/L | B.0.4mol/L | C.0.2mol/L | D.0.1mol/L |
您最近一年使用:0次
2021-09-02更新
|
142次组卷
|
2卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
解题方法
8. 关于相同质量的O2和O3的说法一定正确的是
| A.分子数之比为1:1 | B.原子数之比为1:1 |
| C.体积之比为2:3 | D.物质的量之比为2:3 |
【知识点】 阿伏加德罗定律 阿伏加德罗定律及其推论解读 阿伏加德罗定律的应用解读
您最近一年使用:0次
2021-09-02更新
|
126次组卷
|
2卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题
单选题
|
容易(0.94)
名校
解题方法
9. 按照物质的树状分类和交叉分类,硫酸应属于
①酸 ②能导电的纯净物 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸 ⑦强电解质
①酸 ②能导电的纯净物 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸 ⑦强电解质
| A.①②③④⑦ | B.①③⑤⑥⑦ | C.①②③⑤⑥⑦ | D.②③⑤⑥⑦ |
您最近一年使用:0次
2021-09-02更新
|
736次组卷
|
16卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题
云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题江苏省海安市南莫中学2021-2022学年高一上学期第一次月考备考金卷A卷化学试题贵州省毕节市威宁第四中学2021-2022学年高一上学期第一次月考化学试题湖北省黄冈市浠水县实验高级中学2021-2022学年高一上学期九月月考化学试题江西省金溪县第一中学2021-2022学年高一上学期第一次月考化学试题山东省济宁市兖州区第一中学2021-2022学年高一上学期(10月)月考化学试题黑龙江省牡丹江市第一高级中学2021—2022学年高一上学期10月月考化学试题江西省南城第二中学2021-2022学年高一上学期第一次月考化学试题新疆阿勒泰地区第二高级中学2021-2022学年高一上学期10月月考化学试题广西梧州市藤县第六中学2021-2022学年高一上学期10月月考化学试题山东省济宁市微山县第二中学2021-2022学年高一上学期第一学段考试化学试题安徽省亳州市蒙城一中东校区 2021-2022学年高一上学期第一次月考化学试题西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题黑龙江省齐齐哈尔市第八中学2022-2023学年高一上学期9月月考化学试题安徽省六安中学2021-2022学年高一上学期期中考试化学试题黑龙江省哈尔滨市第十九中学2021-2022学年高一上学期第一次月考化学试题
单选题
|
适中(0.65)
解题方法
10. 下列反应中,离子方程式书写正确的是
| A.Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
B.硫酸与氢氧化钡溶液反应:H++ +Ba2++OH﹣=BaSO4↓+H2O +Ba2++OH﹣=BaSO4↓+H2O |
C.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO +H2↑ +H2↑ |
| D.石灰石和盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
您最近一年使用:0次
2021-09-02更新
|
200次组卷
|
2卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
11. 下列说法正确的是
| A.金属单质在反应中只能作还原剂,非金属单质只能作氧化剂 |
| B.氧化还原反应中一定存在电子的转移 |
| C.某元素从化合态到游离态,该元素一定被还原 |
| D.失电子多的金属还原性强 |
您最近一年使用:0次
2021-09-02更新
|
240次组卷
|
5卷引用:云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
12. 下列各组离子中,在溶液中能大量共存,加入OH-有沉淀析出,加入H+有气体放出的是
A.Na+、Fe2+、Cl-、SO | B.H+、Cu2+、CO 、NO 、NO |
C.Na+、Ca2+、Cl-、HCO | D.Fe3+、K+、SO 、NO 、NO |
【知识点】 离子反应的实际应用 限定条件下的离子共存解读
您最近一年使用:0次
2021-12-04更新
|
72次组卷
|
2卷引用:四川省凉山宁南中学2020-2021学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
名校
13. 下列化学变化中,需加入氧化剂才能实现的是( )
| A.C→CO2 | B.CO2→CO |
| C.CuO→Cu | D.H2SO4→BaSO4 |
【知识点】 氧化还原反应的几组概念解读 常见氧化剂与还原剂解读
您最近一年使用:0次
2019-12-13更新
|
1440次组卷
|
63卷引用:2010年宁夏银川一中高一上学期期中考试化学卷
(已下线)2010年宁夏银川一中高一上学期期中考试化学卷(已下线)2011-2012学年广西北海市合浦县教育局教研室高一上学期期中考试化学试卷(已下线)2012-2013年广东省珠海市高一上学期期末质检化学试卷(B)(已下线)2014秋安徽省宿州市高一第一学期期中化学试卷2014-2015湖南省边城高级中学高一上学期期中考试化学试卷2015-2016学年山东省文登一中高一上学期第二次诊断性测试化学试卷2016-2017学年广东佛山一中高一上第一次段考化学卷2016-2017学年宁夏育才中学高一上月考二化学卷2吉林省汪清县第六中学2016-2017学年高一下学期期末考试化学试题黑龙江省大庆中学2017-2018学年高一上学期期末考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2017-2018学年高一上学期期中考试化学试题【市级联考】江西省赣州市十四县(市)2018-2019学年高一上学期期中联考化学试题山西省忻州市原平市范亭中学2018-2019学年高一上学期期中考试化学试题江苏省姜堰二中2018-2019学年高一上学期期中考试化学试题山东省微山县第二中学2018-2019学年高一上学期第三学段教学质量监测化学试题甘肃省岷县二中2018-2019学年高一上学期第三次月考化学试题河北省定州中学2017届高三(高补班)下学期第一次月考化学试题山东省济宁市北大培文学校2018-2019学年高一上学期期中考试化学试题2019-2020学年高一上学期期中考试模拟化学试题(B)广西柳州市第二中学2019-2020学年高一上学期11月月考化学试题甘肃省兰州市第五十五中学2019-2020学年高一上学期12月月考化学试题云南省施甸县第三中学2019-2020学年高一12月月考化学试题福建省泉州第五中学高中化学必修1【专题练习】氧化还原反应新疆伊犁哈萨克自治州伊宁市第八中学2019-2020学年高一上学期期中考试化学试题贵州省织金县第二中学2019-2020学高一上学期期中考试化学试题(已下线)衔接点06 氧化还原反应概念-2020年【衔接教材·暑假作业】初高中衔接化学黑龙江省大兴安岭漠河县高级中学2019-2020学年高一上学期第二次月考化学试题陕西省榆林市第十二中学2021届高三上学期第一次月考化学试题(已下线)【浙江新东方】2(已下线)【浙江新东方】18广东省东莞市粤华学校2019-2020学年高一上学期期中考试化学试题安徽省定远县育才学校2020-2021学年高一上学期11月质量检测化学试题广东省佛山市第一中学2020-2021学年高一上学期第一次段考化学试题河南省周口市商水县中英文学校2020-2021学年高一上学期期中考试化学试题广西壮族自治区桂林市七星区桂林市第十八中学2020-2021学年高一上学期期中考试化学试题专题3 第一单元 第3课时 氧化还原反应-高中化学苏教2019版必修第一册吉林省长春市第一五一中学2020-2021学年高一上学期期中考试化学试题新疆乌鲁木齐市第二十中学2020-2021学年高一上学期段考(期中)化学试题(已下线)衔接点06 氧化还原反应概念-2021年初升高化学无忧衔接云南省曲靖市罗平县第二中学2019-2020学年高一上学期期末考试化学试题吉林省吉林市第五十五中学2021-2022学年高一上学期九月月考化学试卷吉林市第五十五中学2021-2022学年高一上学期期中考试化学(理)试题吉林市第五十五中学2021-2022学年高一上学期期中考试化学(文)试题海南省文昌中学2021-2022学年高一上学期第一次月考化学试题上海市南洋模范中学2021-2022学年高一上学期期中考试化学试题黑龙江省齐齐哈尔市第八中学2021-2022学年高一上学期期中考试化学试题广东省梅州市大埔县虎山中学2021-2022学年高一上学期第一次段考(11月)化学试题吉林省长春市第二十九中学2021-2022学年高一上学期第二学程考试化学(理)试题云南省玉溪市民族中学2021-2022学年高一下学期期中考试化学(文科)试题(已下线)衔接点11 氧化还原反应概念-2022年初升高化学无忧衔接?海南省儋州市鑫源中学2021-2022学年高一上学期期末考试化学试题贵州省黔西南州兴义市同源中学2021-2022学年高一上学期期中考试化学试题黑龙江省齐齐市拜泉县第一中学2021-2022学年高一上学期期中考试化学试题西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题佛山市顺德区容山中学2022-2023学年高一上学期期中考试化学试题湖南省长沙市明德中学2021-2022学年高一上学期12月第三次月考化学试题辽宁省阜新市第二高级中学2022-2023学年高一上学期10月月考化学试题吉林省白城市第十四中学2021-2022学年高一上学期期中考试化学试题云南省兰坪县第一中学2021-2022学年高一上学期期中考试化学试题海南省儋州市第二中学2022-2023学年高一上学期期中检测化学试题上海市回民中学2022-2023学年高一上学期期末考试化学试题上海市徐汇区徐汇中学2022-2023学年高一上学期11月期中考试化学试题北京市第一五六中学2023-2024学年高一上学期期中考试化学试题
14. 已知: ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A. 发生还原反应 发生还原反应 | B.氯气的氧化性比氮气的氧化性弱 |
| C.氧化剂与还原剂的物质的量之比为3:2 | D.氯气为氧化剂,氮气为还原产物 |
您最近一年使用:0次
2021-06-20更新
|
159次组卷
|
2卷引用:湖南省五市十校2020-2021学年高一上学期期末联考化学试题
单选题
|
较易(0.85)
名校
解题方法
15. 今有x、y、z、w四种元素的微粒,彼此间能发生如下反应:Cl2+2Br-=2Cl-+Br2 ; 2Fe3+ + 2I-=2Fe2+ + I2 ; Br2 + 2Fe2+= 2Fe3++ 2Br-其中氧化剂的氧化能力由强到弱的顺序为
| A.Cl2>Br2>Fe3+>I2 | B.Cl2>Fe3+>I2>Br2 | C.Cl2> I2>Fe3+> Br2 | D.Br2>Fe3+>I2 >Cl2 |
【知识点】 氧化性、还原性强弱的比较解读
您最近一年使用:0次
2020-01-15更新
|
152次组卷
|
5卷引用:湖北省武汉市新洲区部分学校2019~2020 学年高一上学期期末质量检测化学试题
二、解答题 添加题型下试题
解答题-无机推断题
|
较易(0.85)
名校
解题方法
16. 有一包白色粉末,可能含有NaHSO4、KHCO3、Ba(NO3)2、CaCl2、NaNO3、MgSO4中的一种或几种。
实验步骤如下:
①取少量固体投入水中,既有气体生成,又有沉淀产生。
②过滤,取少量滤液加AgNO3溶液,无沉淀产生。
③再取少量滤液,加入足量NaOH溶液,也无沉淀产生。
(1)推断白色粉末中一定有_____________________________ ,一定没有_________________ 。
(2)请写出实验步骤①中产生气体的离子方程式:______________________________________ 。
(3)请写出用实验检验CaCl2中阴离子方程式:__________________________________________ 。
实验步骤如下:
①取少量固体投入水中,既有气体生成,又有沉淀产生。
②过滤,取少量滤液加AgNO3溶液,无沉淀产生。
③再取少量滤液,加入足量NaOH溶液,也无沉淀产生。
(1)推断白色粉末中一定有
(2)请写出实验步骤①中产生气体的离子方程式:
(3)请写出用实验检验CaCl2中阴离子方程式:
【知识点】 离子反应在化合物组成的分析、鉴定的应用解读 离子的检验 无机物的检验
您最近一年使用:0次
2019-12-29更新
|
81次组卷
|
3卷引用:江西省新余市分宜中学2019-2020学年高一上学期第三次段考化学试题
三、填空题 添加题型下试题
填空题
|
较易(0.85)
名校
17. 对于数以千万计的化学物质和为数众多的化学反应分类法的作用几乎是无可代替的。
I.现有以下物质:①H2O②Cu③BaCO3④Fe(OH)3胶体⑤乙醇⑥CO2⑦稀硫酸
(1)以上物质中属于混合物的是____________ (填序号,下同),属于电解质的是______________ 。
(2)向④中逐滴滴加⑦,可观察到的现象是_______________________________ 。
II.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是___________ (填字母)。

(2)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是:4Ag+2H2S+O2=2X+2H2O。则X的化学式为_______________ ,其中H2S是该反应的_____________ (填序号)。
A.氧化剂B.还原剂C.既是氧化剂又是还原剂D.既不是氧化剂又不是还原剂
I.现有以下物质:①H2O②Cu③BaCO3④Fe(OH)3胶体⑤乙醇⑥CO2⑦稀硫酸
(1)以上物质中属于混合物的是
(2)向④中逐滴滴加⑦,可观察到的现象是
II.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(2)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是:4Ag+2H2S+O2=2X+2H2O。则X的化学式为
A.氧化剂B.还原剂C.既是氧化剂又是还原剂D.既不是氧化剂又不是还原剂
您最近一年使用:0次
2020-12-16更新
|
112次组卷
|
4卷引用:【浙江新东方】88.
四、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
18. 下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为________ 。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L的稀盐酸。
①该学生用量筒量取________ mL上述浓盐酸进行配制;
②所需的实验仪器有:
①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有________ 。
③下列操作导致所配制的稀盐酸物质的量浓度偏低的是________ (填字母)。
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________ mol/L。(填选项字母)
a. b.
b.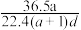 c.
c. 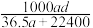 d.
d. 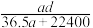

(1)该浓盐酸的物质的量浓度为
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L的稀盐酸。
①该学生用量筒量取
②所需的实验仪器有:
①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有
③下列操作导致所配制的稀盐酸物质的量浓度偏低的是
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为
a.
 b.
b.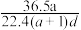 c.
c. 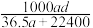 d.
d. 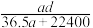
您最近一年使用:0次
2018-11-12更新
|
189次组卷
|
7卷引用:2014-2015四川省资阳市高一上学期学期期末化学试卷
五、填空题 添加题型下试题
填空题
|
适中(0.65)
19. 回答下列问题:
(1)区别溶液和胶体的最简单方法是____ 。
(2)用一种试剂除去下列各物质的杂质(括号内为杂质):
CO2(HCl),试剂:____ ;SO (CO
(CO ),试剂:
),试剂:____ 。
(3)已知:6Fe2++R2O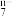 +14H+=6Fe3++2R3++7H2O,则R2O
+14H+=6Fe3++2R3++7H2O,则R2O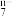 中R的化合价为
中R的化合价为____ 。
(4)熔融的NaHSO4电离方程式____ 。
(1)区别溶液和胶体的最简单方法是
(2)用一种试剂除去下列各物质的杂质(括号内为杂质):
CO2(HCl),试剂:
 (CO
(CO ),试剂:
),试剂:(3)已知:6Fe2++R2O
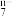 +14H+=6Fe3++2R3++7H2O,则R2O
+14H+=6Fe3++2R3++7H2O,则R2O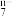 中R的化合价为
中R的化合价为(4)熔融的NaHSO4电离方程式
您最近一年使用:0次
2022-09-25更新
|
134次组卷
|
3卷引用:西藏拉萨那曲高级中学2021-2022学年高一下学期入学检测化学试题
试卷分析
整体难度:适中
考查范围:化学实验基础、有机化学基础、认识化学科学
试卷题型(共 19题)
题型
数量
单选题
15
解答题
2
填空题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 仪器使用与实验安全 常用仪器及使用 化学实验基础操作 配制一定物质的量浓度的溶液实验的仪器 | |
| 2 | 0.85 | 乙醇 仪器使用与实验安全 化学实验基础操作 实验安全 | |
| 3 | 0.94 | 常用仪器及使用 物质分离、提纯的常见物理方法 蒸馏与分馏 萃取和分液 | |
| 4 | 0.85 | 离子反应在混合物分离、除杂中的应用 物质的分离、提纯 物质分离、提纯的常见化学方法 | |
| 5 | 0.85 | 无机物质的分类 分散系概念及其分类 | |
| 6 | 0.65 | 阿伏加德罗常数的应用 22.4L/mol适用条件 根据n=m/M的相关计算 氧化还原反应与NA相关推算 | |
| 7 | 0.85 | 某溶液与物质的量浓度相关的物理量的判断 物质的量浓度的计算 物质的量浓度计算-与溶质成分有关的计算 | |
| 8 | 0.65 | 阿伏加德罗定律 阿伏加德罗定律及其推论 阿伏加德罗定律的应用 | |
| 9 | 0.94 | 无机物质的分类 酸、碱、盐、氧化物的概念及其相互联系 电解质、非电解质概念 | |
| 10 | 0.65 | 离子反应的发生及书写 离子反应的发生条件 离子方程式的正误判断 | |
| 11 | 0.65 | 氧化还原反应定义、本质及特征 常见氧化剂与还原剂 氧化还原反应的应用 氧化还原反应的规律 | |
| 12 | 0.65 | 离子反应的实际应用 限定条件下的离子共存 | |
| 13 | 0.65 | 氧化还原反应的几组概念 常见氧化剂与还原剂 | |
| 14 | 0.65 | 氧化还原反应的应用 氧化还原反应有关计算 氧化还原反应的规律 与氧化剂、还原剂有关的计算 | |
| 15 | 0.85 | 氧化性、还原性强弱的比较 | |
| 二、解答题 | |||
| 16 | 0.85 | 离子反应在化合物组成的分析、鉴定的应用 离子的检验 无机物的检验 | 无机推断题 |
| 18 | 0.65 | 物质的量浓度的计算 配制一定物质的量浓度的溶液的步骤、操作 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度的溶液实验的仪器 | 实验探究题 |
| 三、填空题 | |||
| 17 | 0.85 | 非电解质、电解质物质类别判断 离子反应的发生条件 氧化还原反应的几组概念 | |
| 19 | 0.65 | 胶体的性质和应用 电离方程式 离子反应的发生及书写 离子反应在混合物分离、除杂中的应用 | |







