江苏省姜堰二中2018-2019学年高一上学期期中考试化学试题
江苏
高一
期中
2018-12-20
332次
整体难度:
适中
考查范围:
认识化学科学、化学实验基础、常见无机物及其应用、化学与STSE
一、单选题 添加题型下试题
| A.“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关 |
| B.“落汤螃蟹着红袍”肯定发生了化学变化 |
| C.“滴水石穿”包含化学变化,而“绳锯木断”则不包含化学变化 |
| D.“卤水点豆腐,一物降一物”发生了化学反应 |
| A.常温常压下,48g O3所含的原子数为3NA |
| B.1mol NH3所含有的原子数为NA |
| C.标准状况下,22.4L水中所含原子数为3 NA |
| D.0.1mol/L NaCl溶液中所含Na+数目为0.1 NA |
【知识点】 化学计量
| A.Fe2+、K+、SO42-、NO3- | B.Na+、K+、SO42-、NO3- |
| C.Mg2+、NH4+、SO42-、Cl- | D.Ba2+、Na+、MnO4-、SO42- |
【知识点】 离子共存 限定条件下的离子共存解读
A. 向试管中滴加液体 向试管中滴加液体 |
B. 除去CO气体中的CO2气体 除去CO气体中的CO2气体 |
C. 碳酸氢钠受热分解 碳酸氢钠受热分解 |
D. 过滤 过滤 |
| A.C→CO2 | B.CO2→CO |
| C.CuO→Cu | D.H2SO4→BaSO4 |
【知识点】 氧化还原反应的几组概念解读 常见氧化剂与还原剂解读
| 物质 | 所含杂质 | 除杂试剂 | 除杂操作 | |
| A | CO2 | CO | O2 | 加热 |
| B | KCl | K2CO3 | 稀H2SO4 | — |
| C | Cu(OH)2 | CuSO4 | Ba(OH)2溶液 | 过滤 |
| D | Fe(NO3)2溶液 | AgNO3溶液 | 足量铁粉 | 过滤 |
| A.A | B.B | C.C | D.D |
| A.FeCl3 | B.FeCl2 | C.S | D.HCl |
【知识点】 氧化还原反应定义、本质及特征解读 氧化还原反应的规律解读
| A.0.6mol/L | B.0.7mol/L | C.1.2mol/L | D.1.0mol/L |
【知识点】 物质的量浓度计算-与溶质成分有关的计算解读
| A.金属钠有强还原性,能和硫酸铜溶液反应,析出金属铜 |
| B.用Al(OH)3治疗胃酸过多 |
| C.过氧化钠可用于呼吸面具中作为氧气的来源 |
| D.绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素化合物 |
| A.+1 | B.+3 | C.+4 | D.0 |
【知识点】 基于氧化还原反应守恒规律的计算解读
二、多选题 添加题型下试题
| A.只有Zn是反应的还原剂 |
| B.N2既是氧化产物又是还原产物 |
| C.该氧化还原反应转移了5e- |
| D.若产生N2的体积为2.24 L,则反应中转移的电子数为0.5NA |
| A.Fe跟稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ |
| B.澄清石灰水与过量NaHCO3溶液反应:Ca2++2HCO3—+2OH—= CaCO3↓+CO32—+2H2O |
| C.氢氧化铜与盐酸反应:Cu(OH)2+2H+=Cu2++2H2O |
| D.NaHCO3与稀HCl反应:2H++CO32—=CO2↑+H2O |
【知识点】 离子方程式的正误判断解读
三、单选题 添加题型下试题
| A.1:1 | B.1:2 | C.1:3 | D.1:4 |
【知识点】 碳酸钠、碳酸氢钠混合物的有关求算解读
四、填空题 添加题型下试题

(1)从物质分类标准看,“铜绿”属于
A.酸 B.碱 C.盐 D.氧化物
(2)写出B的化学式:
(3)请写出铜绿与盐酸反应的离子方程式:
(4)上述转化过程中属于氧化还原反应的是
(5)铜绿在受热时可直接分解生成物质B、CO2和水,其分解的化学方程式为
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目
(2)上述反应中氧化剂是
(3)H2SO4 在上述反应中表现出来的性质是
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为
五、解答题 添加题型下试题

Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:a.盐酸;b.BaCl2溶液;c.NaOH溶液;d.Na2CO3溶液。加入试剂的顺序是
II.实验室利用精盐配制480mL 2.0mol·L-1NaCl溶液。
(4)除烧杯和玻璃棒外,还需要的玻璃仪器有
(5)用托盘天平称取固体NaCl
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
【知识点】 一定物质的量浓度的溶液的配制 物质的分离、提纯 海水资源综合利用
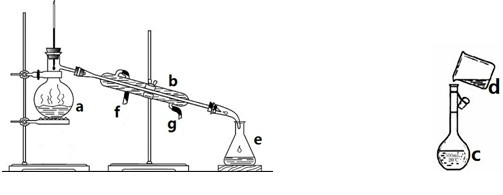
(1)写出下列仪器的名称:a.
(2)仪器a~e中,使用前必须检查是否漏水的有
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是
(4)表示溶液浓度的方法通常有两种;溶液中溶质的质量分数(W)和物质的量浓度 (c),把98%(密度为1.84g/cm3)的浓硫酸稀释成2mol/L的稀硫酸100mL,需要量取浓硫酸
六、填空题 添加题型下试题
I.一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g ,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。
II.另一份固体与过量NaOH浓溶液混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
回答下列问题:
(1)该固体中一定没有的离子是
(2)实验I中沉淀质量减少的离子方程式为
(3)实验II中产生气体是
(4)根据以上实验,无法确定该固体中是否含有的离子是
【知识点】 离子共存 离子反应在化合物组成的分析、鉴定的应用解读 离子的检验
七、计算题 添加题型下试题
(1)混合物与NaOH溶液反应的离子方程式为
(2)求混合物中各成分的质量
试卷分析
试卷题型(共 21题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 胶体的性质和应用 物理变化与化学变化 | |
| 2 | 0.65 | 电解质的电离 电离方程式 | |
| 3 | 0.64 | 化学计量 | |
| 4 | 0.85 | 离子共存 限定条件下的离子共存 | |
| 5 | 0.65 | 常用仪器及使用 化学实验基础操作 实验安全 | |
| 6 | 0.65 | 氧化还原反应的几组概念 常见氧化剂与还原剂 | |
| 7 | 0.65 | 物质分离、提纯的常见化学方法 物质分离、提纯综合应用 | |
| 8 | 0.65 | 离子共存 离子反应的实际应用 离子反应在混合物分离、除杂中的应用 离子反应在化合物组成的分析、鉴定的应用 | |
| 9 | 0.85 | 氧化还原反应定义、本质及特征 氧化还原反应的规律 | |
| 10 | 0.85 | 物质的量浓度计算-与溶质成分有关的计算 | |
| 11 | 0.65 | 焰色试验 过氧化钠的物理性质、组成、结构及用途 氢氧化铝的物理性质及用途 | |
| 12 | 0.65 | 基于氧化还原反应守恒规律的计算 | |
| 15 | 0.94 | 碳酸钠、碳酸氢钠混合物的有关求算 | |
| 二、多选题 | |||
| 13 | 0.65 | 氧化还原反应的几组概念 氧化还原反应有关计算 氧化还原反应的规律 | |
| 14 | 0.65 | 离子方程式的正误判断 | |
| 三、填空题 | |||
| 16 | 0.65 | 化学物质的分类方法 离子反应的发生及书写 氧化还原反应方程式的配平 | |
| 17 | 0.65 | 氧化还原反应的几组概念 单线桥、双线桥分析氧化还原反应 基于氧化还原反应守恒规律的计算 | |
| 20 | 0.65 | 离子共存 离子反应在化合物组成的分析、鉴定的应用 离子的检验 | |
| 四、解答题 | |||
| 18 | 0.65 | 一定物质的量浓度的溶液的配制 物质的分离、提纯 海水资源综合利用 | 工业流程题 |
| 19 | 0.65 | 配制一定物质的量浓度的溶液实验的误差分析 配制一定物质的量浓度溶液的综合考查 蒸馏与分馏 | 实验探究题 |
| 五、计算题 | |||
| 21 | 0.65 | 镁的结构与化学性质 铝与酸溶液反应 铝与强碱溶液反应 | |

 、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中,正确的是
、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中,正确的是

