云南省曲靖市陆良县第十中学2019-2020学年高一上学期期末考试化学试题
云南
高一
期末
2020-03-04
302次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、有机化学基础、化学与STSE、化学实验基础
一、单选题 添加题型下试题
| A.24g·mol-1 | B.47.5g·mol-1 | C.80g·mol-1 | D.95g·mol-1 |
【知识点】 物质的量有关计算 根据n=m/M进行相关计算解读
 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为| A.3.0 mol | B.1.5 mol | C.1.0 mol | D.0.75 mol |
【知识点】 基于氧化还原反应守恒规律的计算解读
| A.用大量SO2漂白馒头 |
B.用小苏打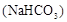 焙制糕点 焙制糕点 |
C.用食醋清洗热水瓶胆内壁附着的水垢 |
D.用消毒液(有效成分 )对餐具进行杀菌消毒 )对餐具进行杀菌消毒 |
①在100份质量溶液中含有10份质量溶质;②在110份质量溶液中含有10份质量溶质;
③在100份质量溶剂中含有10份质量溶质;④在90份质量溶剂中溶有10份质量溶质。
| A.①② | B.③④ | C.②③ | D.①④ |
【知识点】 物质的量浓度计算-与溶质成分有关的计算解读
| A.纯碱、液态氧、碘酒、稀盐酸依次是盐、单质、混合物、电解质 |
| B.干冰、生石灰、硫酸、碳酸氢铵依次是电解质、氧化物、酸、盐 |
| C.氯化氢、氨气、水银、草木灰依次是电解质、非电解质、单质、混合物 |
| D.冰水、空气、泥水依次是溶液、胶体、浊液 |
| A.2 mol·L-1 | B.1.5 mol·L-1 | C.1 mol·L-1 | D.0.75 mol·L-1 |
A.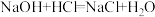 | B.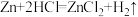 |
C.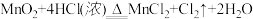 | D.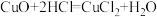 |
【知识点】 氧化还原反应的几组概念解读
| A.单质、单质 | B.盐、酸 | C.碱、氧化物 | D.氧化物、酸 |
| A.金属氧化物都能与水反应生成碱 |
| B.非金属氧化物都能与水反应生成酸 |
| C.氧化铝既能与盐酸反应又能与氨水反应 |
| D.氧化铝是冶炼金属铝的原料 |
| A.Fe、Cu、Al、Ag、Mg | B.Mg、Cu、Al、Ag、Fe |
| C.Mg、Cu、Al、Fe、Ag | D.Al、Cu、Mg、Ag、Fe |
A.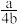 mol-1 mol-1 | B.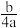 mol-1 mol-1 | C. mol-1 mol-1 | D. mol-1 mol-1 |
| A.铁粉 | B.铜粉 | C.锌粉 | D.Fe2(SO4)3 |
【知识点】 亚铁盐溶液的配制与保存解读
| A.0.500 mol | B.1.00 mol | C.0.250 mol | D.0.125 mol |
【知识点】 阿伏加德罗常数 摩尔质量 物质的量有关计算 根据n=N/NA进行相关计算解读
| A.两者都污染环境,危害健康 |
| B.两者都是形成酸雨的主要物质 |
| C.两者都能使品红溶液褪色 |
| D.两者都易溶于水 |
【知识点】 二氧化硫与二氧化碳的性质区别解读
①0.6 mol NH3 ②0.2 mol H3PO4③9 g H2O ④标准状况下22.4 L He
| A.①②③④ | B.②③①④ | C.②①③④ | D.①②④③ |
| A.二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物 |
| B.二氧化碳通入硅酸钠溶液中可以得到硅酸 |
C.由CaCO3+SiO2 CaSiO3+CO2↑可知硅酸的酸性比碳酸强 CaSiO3+CO2↑可知硅酸的酸性比碳酸强 |
| D.二氧化硅是酸性氧化物,它不溶于任何酸 |
①MnO2+4HCl(浓)
 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑②2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)
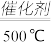 2H2O+2Cl2
2H2O+2Cl2 这三种氧化剂的氧化性由强到弱的顺序是( )
| A.O2>MnO2>KMnO4 |
| B.KMnO4>MnO2>O2 |
| C.MnO2>KMnO4>O2 |
| D.O2>KMnO4>MnO2 |
【知识点】 氧化性、还原性强弱的比较解读
| A.硫酸铝 | B.盐酸 | C.二氧化碳 | D.硫酸 |
| A.焰色试验为黄色,说明该物质中肯定含有钠元素 |
| B.某物质的焰色试验不显紫色(未透过蓝色钴玻璃),说明该物质中肯定没有钾元素 |
| C.焰色试验不能用于物质的鉴别 |
| D.焰色试验是化学变化 |
| A.用氨水溶液鉴别Mg2+和Ag+ |
B.用氯化钡溶液鉴别Cl-、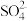 和 和 |
| C.用硝酸银溶液鉴别氯化钠溶液和碳酸钠溶液 |
| D.用碳酸钙固体鉴别盐酸和硝酸 |
| A.等于3.6g | B.等于3.60g | C.大于3.6g | D.等于0.36g |
【知识点】 配制一定物质的量浓度溶液的综合考查解读
二、解答题 添加题型下试题
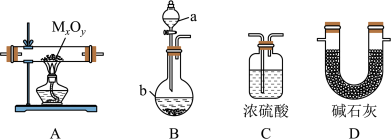
①仪器a的名称为
②按气流方向正确的装置连接顺序为
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
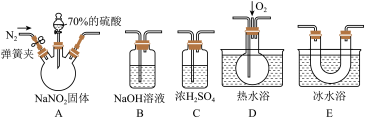
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→
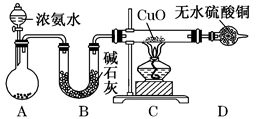
(1)装置A中烧瓶内试剂可选用
a.碱石灰 b.生石灰 c.浓硫酸 d.烧碱溶液
(2)连接好装置并检验装置的气密性后,装入试剂,然后应先
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水
Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为
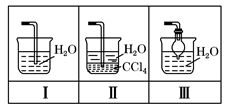
(4)该实验缺少尾气吸收装置,上图中能用来吸收尾气的装置是
(5)氨气极易溶于水,若标准状况下,将2.24 L的氨气溶于水配成1 L溶液,所得溶液的物质的量浓度为
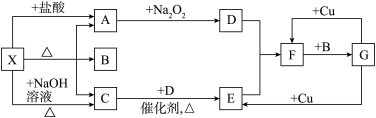
试回答下列问题:
(1)X是
(2)A―→D反应的化学方程式为
(3)G与Cu的反应中,G表现的性质为
(4)X与过量NaOH溶液反应生成C的离子方程式为
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D
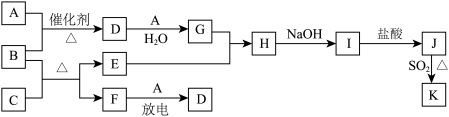
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为
(2)E与G的稀溶液反应的离子方程式为
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是
(5)B和C反应的化学方程式为
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:
【知识点】 无机综合推断 氨的还原性解读 铜与强氧化性酸的反应
三、填空题 添加题型下试题
(1)化石燃料包括煤、石油和
(2)酸雨是指pH
(3)煤的气化是高效、清洁利用煤的重要途径,可将煤炼成焦炭,再将焦炭在高温下与水蒸气反应生成一氧化碳和氢气的化学方程式为
(4)在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的气体和无毒的气体,该反应的化学方程式为
(5)在新能源汽车未普及时,如图所示为一种“节能减排”的有效措施,以下对乙醇汽油作汽车燃料的描述错误的是

A.乙醇可以用粮食作物发酵或有机物合成而来,原料来源丰富
B.乙醇是可再生能源
C.完全燃烧产生的尾气没有污染物
四、计算题 添加题型下试题
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=
【知识点】 化学方程式计算中物质的量的运用解读 氨的还原性解读 二氧化氮
试卷分析
试卷题型(共 32题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 物质的量有关计算 根据n=m/M进行相关计算 | |
| 2 | 0.85 | 基于氧化还原反应守恒规律的计算 | |
| 3 | 0.94 | 二氧化硫 碳酸氢钠的俗称、物理性质及用途 乙酸具有酸的通性 人体健康基本维护 | |
| 4 | 0.85 | 物质的量浓度计算-与溶质成分有关的计算 | |
| 5 | 0.65 | 分类方法的应用 无机物质的分类 | |
| 6 | 0.4 | 氧化还原反应有关计算 氯气与还原性化合物的反应 Fe2+的还原性 | |
| 7 | 0.65 | 氧化还原反应的几组概念 | |
| 8 | 0.85 | 酸、碱、盐、氧化物的概念及其相互联系 四种基本反应类型 | |
| 9 | 0.85 | 酸、碱、盐、氧化物的概念及其相互联系 氧化铝 氧化铝与酸反应 氧化铝与碱溶液反应 | |
| 10 | 0.65 | 氧化性、还原性强弱的比较 氧化还原反应的规律 | |
| 11 | 0.94 | 电解质与非电解质 电解质的电离 | |
| 12 | 0.85 | 常见金属的活动性顺序及其应用 铝与强碱溶液反应 铁的物理性质 | |
| 13 | 0.85 | 分散系概念及其分类 胶体的定义及分类 胶体的性质和应用 | |
| 14 | 0.85 | 镁的结构与化学性质 | |
| 15 | 0.65 | 阿伏加德罗常数的求算 根据n=N/NA的相关计算 根据N=m·NA/M的相关推算 | |
| 16 | 0.85 | 硫酸 物质含量的测定 | |
| 17 | 0.85 | 亚铁盐溶液的配制与保存 | |
| 18 | 0.85 | 阿伏加德罗常数 摩尔质量 物质的量有关计算 根据n=N/NA进行相关计算 | |
| 19 | 0.65 | 二氧化硫与二氧化碳的性质区别 | |
| 20 | 0.85 | 22.4L/mol适用条件 物质的量有关计算 根据n=N/NA进行相关计算 以N=m·NA/M为中心的有关基本粒子的推算 | |
| 21 | 0.65 | 二氧化硅的物理性质 二氧化硅的化学性质 硅酸钠与二氧化碳反应 | |
| 22 | 0.85 | 氧化性、还原性强弱的比较 | |
| 23 | 0.65 | 偏铝酸钠与盐酸的反应 偏铝酸钠与二氧化碳的反应 铝三角转化 | |
| 24 | 0.94 | 焰色试验 | |
| 25 | 0.85 | 硫酸根离子的检验 离子的检验 常见阳离子的检验 常见阴离子的检验 | |
| 26 | 0.65 | 配制一定物质的量浓度溶液的综合考查 | |
| 二、解答题 | |||
| 27 | 0.65 | 氨气的实验室制法 一氧化氮的化学性质 化学实验基础操作 化学实验探究 | 实验探究题 |
| 28 | 0.4 | 氨气 综合实验设计与评价 | 实验探究题 |
| 29 | 0.65 | 无机综合推断 氨的还原性 硝酸的强氧化性 铵盐的不稳定性 | 无机推断题 |
| 30 | 0.65 | 无机综合推断 氨的还原性 铜与强氧化性酸的反应 | 有机推断题 |
| 三、填空题 | |||
| 31 | 0.65 | 汽车尾气消除 硫、氮氧化物对人体、环境的危害 酸雨 化石能源 煤的气化 | |
| 四、计算题 | |||
| 32 | 0.4 | 化学方程式计算中物质的量的运用 氨的还原性 二氧化氮 | |


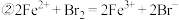

 中的氧化产物分别是
中的氧化产物分别是 、
、 、
、
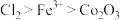
 中当1 mol
中当1 mol  参加反应时,2 mol HCl被氧化
参加反应时,2 mol HCl被氧化
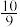 H2O
H2O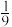 H2O
H2O

