贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高一上学期期末考试化学试题
贵州
高一
期末
2020-02-19
295次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学实验基础、化学与STSE
一、单选题 添加题型下试题
| A.22.4 L·mol-1就是气体摩尔体积 |
| B.1 mol H2的质量只有在标准状况下才约为2 g |
| C.标准状况下,18 g水的体积为22.4 L |
| D.H2和O2的混合气体1 mol在标准状况下的体积约为22.4 L |
【知识点】 气体摩尔体积 气体摩尔体积概念解读 22.4L/mol适用条件解读

| A.该溶液中含有的微粒主要有NaCl、Na+、Cl-、H2O |
| B.若取50毫升溶液,其中的c(Cl-)=0.05 mol·L-1 |
| C.若取该溶液与100 mL 0.1 mol·L-1AgNO3溶液完全反应,需要取该溶液10 mL |
| D.该溶液与1.0 mol·L-1Na2SO4溶液的c(Na+)相等 |
| A.化学科学将继续推动材料科学的发展 |
| B.化学科学将为环境问题的解决提供有力的保障 |
| C.化学科学在了解疾病的病理方面无能为力 |
| D.化学科学使人类能够更好地利用能源和资源 |
| A.①②③ | B.②①③ | C.③②① | D.③①② |
| A.CO2是还原剂,在该反应中被氧化 |
| B.Na2O2是氧化剂,在该反应中发生氧化反应 |
| C.氧化剂和还原剂的物质的量之比为1∶2 |
| D.若有2 mol Na2O2参加反应,则有2 mol电子转移 |
| A.1 L | B.2L | C.3L | D.4L |
【知识点】 依据物质的量浓度公式的基础计算解读
①2Fe2++Br2=2Fe3++2Br- ②2Br-+Cl2=Br2+2Cl- ③2Fe3++2I-=2Fe2++I2;
由此判断下列说法错误的是
| A.铁元素在反应①和③中均被氧化 |
| B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 |
| C.氧化性强弱顺序为:Cl2>Br2>Fe3+>I2 |
| D.还原性强弱顺序为:I->Fe2+>Br->Cl- |
【知识点】 氧化还原反应的几组概念解读 氧化性、还原性强弱的比较解读
二、多选题 添加题型下试题
 2MoO3+4SO2;②MoO3+2NH3·H2O→ (NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl→H2MoO4↓+2NH4Cl;④H2MoO4
2MoO3+4SO2;②MoO3+2NH3·H2O→ (NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl→H2MoO4↓+2NH4Cl;④H2MoO4 MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。下列说法正确的是
MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。下列说法正确的是| A.MoS2煅烧的尾气需经处理后排入空气中 |
| B.MoO3既是金属氧化物,也是碱性氧化物 |
| C.H2MoO4是一种强酸 |
| D.利用H2、CO和Al还原等质量的MoO3,所消耗的还原剂的物质的量之比为3∶3∶2 |
【知识点】 与氧化剂、还原剂有关的计算解读 酸性氧化物的通性解读
三、单选题 添加题型下试题
| A.铁锈与过量稀盐酸 | B.FeCl3溶液与过量铜片 |
| C.FeCl3溶液与过量铁粉 | D.FeCl2溶液与过量Zn粉 |
【知识点】 铁盐 铁盐与亚铁盐鉴别试剂的选择解读
| A.同质量、不同密度的N2和CO | B.同温度、同体积的H2和N2 |
| C.同体积、同密度的C2H4和C2H6 | D.同压强、同体积的N2O和CO2 |
| A.纯碱、烧碱均属于碱 |
| B.CuSO4·5H2O属于纯净物 |
| C.凡能电离出H+的化合物均属于酸 |
| D.盐类物质一定含有金属阳离子 |
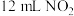 和
和 混合气体的量筒倒立于水槽中,充分反应后,还剩余
混合气体的量筒倒立于水槽中,充分反应后,还剩余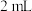 无色气体,则原混合气体中
无色气体,则原混合气体中 的体积和剩余的
的体积和剩余的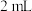 气体可能分别是
气体可能分别是A.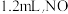 |
B. |
C.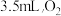 |
D. |
【知识点】 一氧化氮 氮氧化物溶解于水的相关计算解读 二氧化氮与水反应解读
| A.上述过程中,最终被还原的是NO3- |
| B.从上述过程中可以得出氧化性:稀硝酸>稀硫酸>Fe3+ |
| C.上述过程中,会产生一种无色的难溶于水的气体 |
| D.若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为3∶2 |
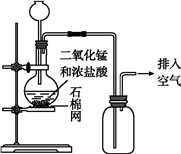
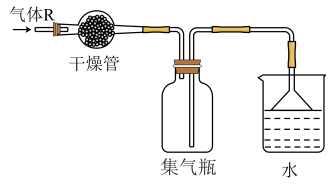
| A.该装置图中至少存在三处明显错误 |
| B.该实验中收集氯气的方法不正确 |
| C.如果需要得到干燥纯净的Cl2,只需在气体发生装置和收集装置之间连接一个装有浓硫酸的洗气瓶即可 |
| D.含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移1 mol电子 |
| A.都是淡黄色的固体 | B.都是碱性氧化物 |
| C.都能与水反应生成碱 | D.都能与二氧化碳反应放出氧气 |
【知识点】 氧化钠 过氧化钠 过氧化钠的物理性质、组成、结构及用途解读
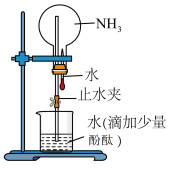
| A.该实验说明氨气是一种极易溶于水的气体 |
| B.进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性 |
| C.氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化 |
| D.形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压 |
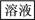
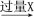

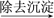
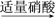

| A.碳酸钠 | B.碳酸钾 | C.硫酸钠 | D.硫酸钾 |
【知识点】 物质分离、提纯综合应用解读
| A.三种气体的分子数目一定相等 | B.三种气体物质的量之比为16:2:1 |
| C.三种气体的密度之比为1:2:16 | D.三种气体的压强一定相等 |
【知识点】 阿伏加德罗定律的应用解读
| A.NaOH溶液[Ba(OH)2溶液] |
| B.FeSO4溶液(KSCN溶液) |
| C.KI(淀粉溶液) |
| D.Na2SO3溶液(BaCl2溶液) |
【知识点】 物质的检验
| A.相同温度压强下,各种气体的体积大小由该气体分子的大小决定 |
| B.相同温度压强下,各种气体的体积大小由该气体的分子数决定 |
| C.不同的气体,若体积不同,则它们所含的分子数一定不同 |
| D.不同的气体,分子数若相同,则气体体积相同 |
【知识点】 决定物质体积大小的微观因素解读
A.K+、 、 、 、Na+ 、Na+ | B.Na+、Ba2+、 、HCO3− 、HCO3− |
C. 、Fe2+、K+、Cl- 、Fe2+、K+、Cl- | D. 、K+、Mg2+、Cl- 、K+、Mg2+、Cl- |
【知识点】 离子反应的发生条件解读 限定条件下的离子共存解读
| A.铜和浓硝酸反应 |
| B.铜和稀硝酸反应 |
| C.氯化铜和硝酸银反应 |
| D.氧化铜和硝酸反应 |
【知识点】 硝酸 铜与强氧化性酸的反应
| A.将氨水滴入到FeCl3溶液中:Fe3++3OH-=Fe(OH)3↓ |
| B.铜片跟氯化铁溶液反应: 2Fe3++3Cu=3Cu2++2Fe |
| C.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O |
| D.向FeCl3溶液中加入铁粉:Fe+2Fe3+=3Fe2+ |
【知识点】 离子反应的发生及书写 离子方程式的书写解读 离子方程式的正误判断解读
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3
 TiO2+H2O
TiO2+H2O④TiO2+2C+2Cl2
 TiCl4↑+2CO↑
TiCl4↑+2CO↑⑤TiCl4+2Mg
 2MgCl2+Ti
2MgCl2+Ti上述反应中,属于氧化还原反应的有( )
| A.①② |
| B.①⑤ |
| C.③④ |
| D.④⑤ |
【知识点】 氧化还原反应定义、本质及特征解读
| A.加氢氧化钠溶液,加热,用湿润的红色石蕊试纸在试管口检验,看试纸是否变蓝 |
| B.将固体加热,产生的气体通入紫色石蕊溶液,看是否变红 |
| C.加水溶解,用pH试纸测溶液的酸碱性 |
| D.加入氢氧化钠溶液,加热,再滴入酚酞溶液 |
四、解答题 添加题型下试题
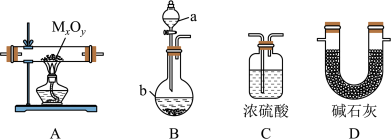
①仪器a的名称为
②按气流方向正确的装置连接顺序为
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
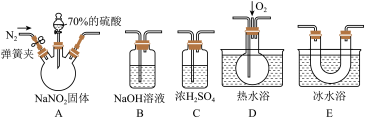
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→
| 实验(20°C) | 现象 |
| Ⅰ.过量铜粉、2mL0.5mol/L HNO3 | 无色气体(遇空气变红棕色),溶液变为蓝色 |
| Ⅱ.过量铁粉、2mL0.5mol/ HNO3 | 6mL无色气体(经检测为H2),溶液几乎无色 |
(2)Ⅱ中生成H2的离子方程式是
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于
 ,所以
,所以 没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是
没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是②乙同学通过分析,推测出
 也能被还原,依据是
也能被还原,依据是 ,其实验操作是
,其实验操作是(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有
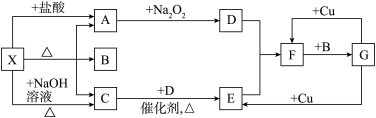
试回答下列问题:
(1)X是
(2)A―→D反应的化学方程式为
(3)G与Cu的反应中,G表现的性质为
(4)X与过量NaOH溶液反应生成C的离子方程式为
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D

试回答下列问题:
(1)写出A、B、C的化学式:A
(2)反应E溶液+A→F溶液+C的离子方程式为:
(3)写出除去D溶液中F杂质的离子方程式:

(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:
五、填空题 添加题型下试题
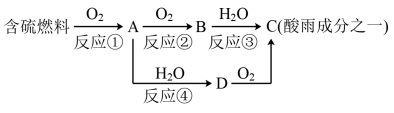
回答下列问题:
(1)A物质的化学式
(2)根据SO2的性质,可让工厂的烟道气通过
(3)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
注 溶液的pH越大,H+的物质的量浓度就越小。
①雨水样品的pH变化的原因是
②如果将刚取样的上述雨水和用氯气消毒的自来水相混合,pH将
(4)你认为减少酸雨产生可采用的措施是
①少用煤做燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源
试卷分析
试卷题型(共 32题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 气体摩尔体积 气体摩尔体积概念 22.4L/mol适用条件 | |
| 2 | 0.65 | 化学方程式计算中物质的量的运用 依据物质的量浓度公式的基础计算 电解质、非电解质概念 | |
| 3 | 0.65 | 化学科学特点 | |
| 4 | 0.85 | 氧化还原反应的几组概念 自然界氮的固定 氨气的实验室制法 硝酸的不稳定性 | |
| 5 | 0.65 | 氧化还原反应基本概念 氧化还原反应有关计算 氧化还原反应的规律 与氧化剂、还原剂有关的计算 | |
| 6 | 0.65 | 依据物质的量浓度公式的基础计算 | |
| 7 | 0.85 | 氧化还原反应的几组概念 氧化性、还原性强弱的比较 | |
| 9 | 0.85 | 铁盐 铁盐与亚铁盐鉴别试剂的选择 | |
| 10 | 0.65 | 阿伏加德罗定律及其推论 阿伏加德罗定律的应用 根据n=N/NA进行相关计算 根据n=m/M进行相关计算 | |
| 11 | 0.85 | 树状分类法 分类方法的应用 无机物质的分类 酸、碱、盐、氧化物 | |
| 12 | 0.65 | 一氧化氮 氮氧化物溶解于水的相关计算 二氧化氮与水反应 | |
| 13 | 0.65 | 氯气的实验室制法 氨气的实验室制法 | |
| 14 | 0.65 | 氧化性、还原性强弱的比较 与氧化剂、还原剂有关的计算 二氧化硫与其他强氧化剂的反应 物质性质的探究 | |
| 15 | 0.65 | 氯气的制法 氯气的实验室制法 | |
| 16 | 0.85 | 氧化钠 过氧化钠 过氧化钠的物理性质、组成、结构及用途 | |
| 17 | 0.85 | 氨气 氨水 氨与水的反应 氨的喷泉实验 | |
| 18 | 0.85 | 物质分离、提纯综合应用 | |
| 19 | 0.65 | 阿伏加德罗定律的应用 | |
| 20 | 0.85 | 物质的检验 | |
| 21 | 0.65 | 决定物质体积大小的微观因素 | |
| 22 | 0.65 | 离子反应的发生条件 限定条件下的离子共存 | |
| 23 | 0.85 | 硝酸 铜与强氧化性酸的反应 | |
| 24 | 0.65 | 离子反应的发生及书写 离子方程式的书写 离子方程式的正误判断 | |
| 25 | 0.65 | 氧化还原反应定义、本质及特征 | |
| 26 | 0.4 | 铵根离子的检验 | |
| 二、多选题 | |||
| 8 | 0.65 | 与氧化剂、还原剂有关的计算 酸性氧化物的通性 | |
| 三、解答题 | |||
| 27 | 0.65 | 氨气的实验室制法 一氧化氮的化学性质 化学实验基础操作 化学实验探究 | 实验探究题 |
| 28 | 0.65 | 离子方程式的书写 硝酸的强氧化性 物质性质的探究 物质性质实验方案的设计 | 实验探究题 |
| 29 | 0.65 | 无机综合推断 氨的还原性 硝酸的强氧化性 铵盐的不稳定性 | 无机推断题 |
| 30 | 0.65 | 无机综合推断 铁 铁盐 氢氧化亚铁的还原性 | 无机推断题 |
| 31 | 0.85 | 胶体的性质和应用 氨气的结构与性质 氨气的制备 | 实验探究题 |
| 四、填空题 | |||
| 32 | 0.65 | 硫、氮氧化物对人体、环境的危害 酸雨 酸性氧化物的通性 二氧化硫与其他强氧化剂的反应 大气污染的治理原理及方法 | |