安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题
安徽
高二
阶段练习
2021-05-08
206次
整体难度:
容易
考查范围:
化学反应原理、化学与STSE、常见无机物及其应用
安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题
安徽
高二
阶段练习
2021-05-08
206次
整体难度:
容易
考查范围:
化学反应原理、化学与STSE、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
容易(0.94)
名校
解题方法
1. 下列反应中,属于水解反应且使溶液显酸性的是
A. |
B. |
C. |
D. |
【知识点】 水解的离子方程式书写解读 盐溶液的酸碱性判断解读
您最近一年使用:0次
2021-10-14更新
|
1241次组卷
|
16卷引用:河南省漯河市临颍县南街高级中学2019-2020学年高二下学期期末考试化学试题
河南省漯河市临颍县南街高级中学2019-2020学年高二下学期期末考试化学试题吉林省四平市实验中学2020-2021学年高二12月月考化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题河北省石家庄市师大附中2020-2021学年高二上学期期中考试化学试题黑龙江省大庆市大庆铁人中学2021-2022学年高二上学期第一次月考化学试题上海行知中学2021-2022学年高二上学期期中考试化学试题黑龙江省双鸭山市第一中学2021-2022学年高二上学期期中考试化学试题河北省邯郸市大名县第一中学2021-2022学年高三上学期11月月考化学试题河南省许昌市2021-2022学年高二上学期期末教学质量检测化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期开学考试化学试题黑龙江省黑河市五校(嫩江市第一中学,嫩江市职业高中,黑河七中,伊拉哈中学,海江中学)2021-2022学年高二上学期期末联考化学试题黑龙江省密山市第四中学2021-2022学年高二上学期期中考试化学(理)试题安徽省滁州市定远县育才学校2021-2022学年高二上学期期末考试(普通班)化学试题(已下线)第19讲 盐类的水解-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)山东省济宁市微山县第二中学2021-2022学年高二12月月考化学试题黑龙江省哈尔滨市宾县第一中学校2021-2022学年高二上学期第二次月考化学试题
单选题
|
较难(0.4)
名校
2. 把1 L 0.1 mol/L的醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
| A.c(CH3COOH)变为原来的1/10 |
B.c(H+)变为原来的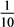 |
| C.c(CH3COO-)/c(CH3COOH)的比值增大 |
| D.溶液的导电性增强 |
【知识点】 浓度对电离平衡的影响解读
您最近一年使用:0次
2017-11-19更新
|
629次组卷
|
16卷引用:2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷
(已下线)2015安徽望江中学同步课时练(人教选修4)3.1弱电解质的电离试卷2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题1山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题22018-2019学年人教版高中化学选修四水溶液中的离子平衡章末综合测评题(三)江西省上高县第二中学2019-2020学年高二上学期第一次月考化学试题陕西省延安市第一中学2019-2020学年高二上学期期中考试化学试题安徽省黄山市屯溪第一中学2019-2020学年高二上学期期中考试化学试题安徽省蚌埠市六校2019-2020学年高二上学期期中考试化学试题山西省运城市景胜中学2019-2020学年高二上学期期中考试化学试题安徽省安庆市第十中学2020-2021学年高二下学期第一次月考化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题福建省莆田第十五中学2019-2020学年高二下学期期末考试化学试题(已下线)3.2.1 弱电解质的电离平衡-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)重庆市为明学校2022-2023学年高二上学期期末检测化学试题作业(十二) 弱电解质的电离平衡
单选题
|
较易(0.85)
解题方法
3. 900mLpH=5的盐酸和100mLpH=1的盐酸混合,该混合溶液的pH约为
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2020-11-04更新
|
456次组卷
|
5卷引用:新疆吾尔自治区沙雅县第一中学2019-2020学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
解题方法
4. 下列几种情况,对中和滴定结果无影响的是
| A.滴定管用水冲洗后即注入标准液 | B.锥形瓶里有少量水 |
| C.滴定前标准液在“0”刻度以上 | D.滴定管尖端未充满液体 |
您最近一年使用:0次
2016-12-09更新
|
538次组卷
|
6卷引用:2012-2013学年四川省雅安市高二下学期期末检测化学试卷
单选题
|
适中(0.65)
5. 室温时,下列混合溶液的pH一定小于7的是( )
| A.pH=3的盐酸和pH=11的氨水等体积混合 |
| B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
| C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
您最近一年使用:0次
2021-03-09更新
|
1427次组卷
|
51卷引用:吉林一中2009—2010学年上学期期末高二(化学)试题
(已下线)吉林一中2009—2010学年上学期期末高二(化学)试题(已下线)2009-2010学年(下)农七师高级中学高二(理)第二阶段化学试卷2007年普通高等学校招生全国统一考试(全国卷Ⅰ)理综化学部分(已下线)2011-2012学年陕西省咸阳市渭城中学高二上学期期中考试化学试卷(已下线)2011-2012学年湖南省望城一中高二上学期期中考试化学试卷(已下线)2011—2012学年福建省漳州市芗城中学高二上学期期末考试化学试卷(已下线)2011-2012年陕西宁强天津中学高二下学期期中考试化学试卷(已下线)2012-2013学年黑龙江省集贤县第一中学高二上学期期末考试化学试卷(已下线)2014届山东省济南一中高二上学期期末考试化学试卷 (已下线)2014~2015学年黑龙江省哈六中高二上学期期中化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2015-2016学年河南洛阳高级中学高二上9月月考化学试卷2015-2016学年宁夏六盘山中学高二上第二次月考化学试卷2015-2016学年河南省扶沟包屯高级中学高二上学期期中考试化学试卷陕西省西安市第一中学2015-2016学年高二上12月月考化学试卷2015-2016学年内蒙古巴彦淖尔一中高二上期中化学试卷2015-2016学年内蒙古巴彦淖尔一中高二普通班上期中化学试卷2016-2017学年湖北省襄阳五中高二上开学考试化学试卷2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷内蒙古包头市铁路第一中学2016-2017学年高二下学期第二次月考化学试题内蒙古北京八中乌兰察布分校2016-2017学年高二下学期期末考试化学试题四川省成都市实验中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第二课时(溶液的酸碱性与pH)宁夏育才中学学益校区2017-2018学年高二下学开学考试化学试题江西省上饶县中学2017-2018学年高二上学期补考化学试题【校级联考】湖南省浏阳市六校联考2018-2019学年高二上学期期中考试化学试题云南省育能高级中学2018-2019学年高二上学期期中考试化学试题重庆市綦江中学2018-2019学年高二上学期第三次月考化学试题吉林省延边第二中学2018届高三上学期第三次月考化学试题陕西省西安中学2019-2020学年高二上学期期中考试化学试题宁夏育才中学勤行学区2019-2020学年高二上学期第二次月考化学试题四川省宜宾市第三中学校2019-2020学年高二10月月考化学试题(已下线)2019年12月26日《每日一题》人教版(选修4)—— pH的计算及应用夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——与pH相关的计算综合(提升练习)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——水的电离及溶液的酸碱性(提升练习)(已下线)2019年12月26日 《每日一题》pH的计算及应用-高二化学人教版(选修4)黑龙江省安达市第七中学2019-2020学年高二3月月考化学试题广东省揭阳市第三中学2019-2020学年高二上学期第二次月考化学试题黑龙江省大兴安岭呼玛县高级中学2020-2021学年高二上学期第三次月考化学试题陕西省宝鸡市渭滨区2020-2021学年高二上学期期末考试化学试题安徽省滁州市2020-2021学年高二上学期期末联考化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期段考(期中)化学试题云南省玉溪市江川区第二中学2020-2021学年高二下学期期中考试化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期末考试化学试题安徽省六安中学2021-2022学年高二上学期期末考试化学试题山东省威海市文登新一中2021-2022学年高二上学期第一次阶段检测化学试题陕西省西安市第八十九中学2022-2023学年高二上学期期末测试化学试题第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 第1课时 水的电离 溶液的酸碱性与pH【精品卷】3.2.2 溶液的酸碱性与pH课堂例题-人教版2023-2024学年选择性必修1
单选题
|
较易(0.85)
6. 下列因素能影响水的电离平衡,且能使水的电离平衡向右移动的是
| A.CH3COOH | B.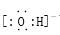 | C.升高温度 | D.bX-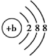 |
您最近一年使用:0次
单选题
|
较易(0.85)
7. 一些食物的近似pH值如下表:
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的是
| 食物 | 苹果 | 葡萄 | 牛奶 | 玉米粥 |
| pH | 2.9-3.3 | 3.5-4.6 | 6.3-6.6 | 6.8-8.0 |
| A.苹果 | B.葡萄 | C.牛奶 | D.玉米粥 |
您最近一年使用:0次
2018-11-27更新
|
76次组卷
|
2卷引用:湖南省怀化市第三中学2017-2018学年高二下学期期中考试化学试题
单选题
|
较易(0.85)
解题方法
8. 下列溶液一定呈酸性的是
| A.pH=6.8的溶液 |
| B.常温下,由水电离的OH﹣离子浓度为1×10﹣13mol/L |
| C.加入酚酞,不显红色的溶液 |
| D.常温下,溶液中的H+离子浓度为5×10﹣7mol/L |
【知识点】 影响水电离的因素解读 溶液的酸碱性与pH的关系解读
您最近一年使用:0次
2017-02-17更新
|
259次组卷
|
3卷引用:2015-2016学年四川省成都市六校高二上学期期中联考化学试卷
单选题
|
较易(0.85)
名校
解题方法
9. 25℃,水的电离达到平衡:H2O H++OH-
H++OH- >0,下列叙述正确的是
>0,下列叙述正确的是
 H++OH-
H++OH- >0,下列叙述正确的是
>0,下列叙述正确的是| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低 |
| D.将水中加热,Kw增大,c(H+)不变 |
您最近一年使用:0次
2021-10-23更新
|
1354次组卷
|
23卷引用:河南省洛阳市第三中学东城校区2020-2021学年高二9月月考化学试题
河南省洛阳市第三中学东城校区2020-2021学年高二9月月考化学试题吉林省汪清县第六中学2020-2021学年高二上学期期中考试化学试题江西省南昌市第二中学2020-2021学年高二上学期期中考试化学试题(已下线)【南昌新东方】3. 2020 高二上 南昌二中 期中考试 吴丹天津市滨海新区大港太平村中学2020-2021学年高二上学期期中化学试题安徽省六安市裕安区新安中学2020-2021学年高二上学期期中考试化学试题宁夏吴忠中学2020-2021学年高二上学期期末考试化学试题黑龙江省鹤岗市绥滨县第一中学2020-2021学年高二上学期期末考试化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题河南省登封市第一高级中学2019-2020学年高二上学期期中考试化学试题吉林省长春市第二中学2021-2022学年高二上学期第一次月考化学试题天津市宝坻区大钟庄高级中学2021-2022学年高二上学期第一次月考化学试题江西省南昌大学附中2021-2022学年高二上学期期中考试化学试题(已下线)周末培优2 水的电离和溶液的酸碱性-2021-2022学年高二化学课后培优练(人教版选修4)天津市两校联考2021-2022学年高二上学期第二次质量检测化学试题江西省遂川中学2021-2022学年高二上学期第二次月考化学(B卷)试题陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题江苏省徐州市沛县树恩高级中学2021-2022学年高二下学期期中测试化学试题河南省商丘名校联盟2022-2023学年高二上学期期中考试化学试题河南省兰考县第一高级中学2022-2023学年高二上学期期中考试化学试题第1课时 水的电离 溶液的酸碱性与 pH四川省南充市嘉陵第一中学2022-2023学年高二下学期5月期中考试化学试题陕西省名校协作体2023-2024学年高三上学期12月月考化学试题
单选题
|
较易(0.85)
10. 温度为T1(T1=25℃)和T2时,水溶液中水的离子积曲线如图所示:下列判断错误的是( )


| A.T2>25℃ | B.x=1.0×10﹣7 |
| C.KW(a)=KW(d) | D.b点溶液呈碱性,c点溶液呈酸性 |
您最近一年使用:0次
2018-01-02更新
|
462次组卷
|
4卷引用:辽宁省抚顺市第十九中学2016-2017学年高二上学期期中考试化学试题
单选题
|
容易(0.94)
名校
解题方法
11. 关于pH的测定下列说法正确的是
| A.pH试纸在使用之前应用蒸馏水润湿 |
| B.用广泛pH试纸测得某盐酸的pH=2.3 |
| C.利用酸碱指示剂可以测溶液的pH |
| D.pH计是精确测定溶液pH的仪器 |
您最近一年使用:0次
2017-07-25更新
|
1682次组卷
|
24卷引用:陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题
陕西省黄陵中学2016-2017学年高一(重点班)下学期期末考试化学试题河南省安阳市第三十六中学2018-2019学年高二上学期期中考试化学试题甘肃省岷县二中2018-2019学年高二上学期第三次月考化学试题安徽省安庆市怀宁县第二中学2019-2020学年高二下学期期中线上检测化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第1节 水与水溶液 课时2 溶液的酸碱性与pH高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第二节 水的电离和溶液的pH 课时1 水的电离 溶液的酸碱性与pH内蒙古通辽市开鲁县第一中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市瓦房店市实验高级中学2020-2021学年高二上学期10月月考化学试题河南省洛阳市豫西名校2020-2021学年高二上学期第一次联考化学试题(已下线)3.2.1 溶液的酸碱性(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)辽宁省渤海大学附属高级中学2020-2021学年高二上学期期中考试化学试题重庆市万州第三中学2020-2021学年高二上学期期中考试化学试题吉林省白山市抚松县第五中学2020-2021学年高二上学期期中考试化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题选择性必修1 专题3 第二单元 课时1 溶液的酸碱性广东省珠海市第二中学2020-2021学年高二上学期10月月考化学试题(已下线)3.2.2 溶液的pH(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)云南省玉溪第三中学2021-2022学年高二上学期期末考试化学试题第二节 水的电离和溶液的pH 第2课时 溶液的酸碱性与pH云南省曲靖市马龙区第一中学2021-2022学年高二下学期3月考试化学试题吉林省长春北师大附属学校2021-2022学年高二上学期期中考试化学试题宁夏贺兰县景博中学2022-2023学年高二上学期第二次月考化学试题3.2.1溶液的酸碱性 课中内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高二上学期第三次考试化学试卷
单选题
|
容易(0.94)
13. 常温下,一定浓度的某溶液,由水电离出c(OH-)=1×10-4 mol·L-1,则该溶液中的溶质可能是
| A.Al2(SO4)3 | B.NaOH | C.KCl | D.CH3COOH |
您最近一年使用:0次
2021-04-28更新
|
1100次组卷
|
6卷引用:安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题
安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题(已下线)作业09 盐类的水解-2021年高二化学暑假作业(人教版2019)课前-3.3.1 盐溶液的酸碱性-课前、课中、课后(人教版2019选择性必修1)(已下线)3.3.1 盐溶液的酸碱性及其原因(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)重庆市巫山县官渡中学2020-2021年高二下学期第二次月考化学试题广东省潮州湘桥区南春中学2021-2022学年高二上学期第二次月考化学试题
单选题
|
较易(0.85)
14. 化学与生活密切相关。下列说法错误的是
| A.碳酸钠可用于去除餐具的油污 | B.漂白粉可用于生活用水的消毒 |
| C.氢氧化铝可用于中和过多胃酸 | D.碳酸钡可用于胃肠X射线造影检查 |
您最近一年使用:0次
2018-06-09更新
|
12904次组卷
|
55卷引用:2018年全国普通高等学校招生统一考试化学(新课标II卷)
2018年全国普通高等学校招生统一考试化学(新课标II卷)(已下线)2018年高考题及模拟题汇编 专题01 STSE 化学用语(已下线)学科网2019年高考化学一轮复习讲练测2.1 物质的组成、性质及分类 练(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第1讲 物质的组成、性质和分类 【教学案】辽宁省沈阳市东北育才学校2019届高三上学期第一次模拟考试化学试题【全国百强校】甘肃省天水市第一中学2019届高三上学期一轮复习第二次质量检测化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第1讲 物质的分类( 教学案)(已下线)2019高考备考二轮复习精品资料-专题1 物质的组成、性质、分类与化学用语(教学案)甘肃省武威市第十八中学2019届高三上学期期末考试化学试题(已下线)专题2.1 物质的组成、性质及分类(练)-《2020年高考一轮复习讲练测》安徽省亳州市第二中学2018-2019学年高二下学期期末考试化学试题吉林省延边市第二中学2020届高三入学考试化学试题云南省马关县二中2020届高三上学期开学考试化学试题云南省玉溪元江民中2020届高三开学考试化学试题陕西省咸阳市三原县南郊中学2020届高三摸底考试化学试题湖北省利川市第三中学2019届高三一模化学试题云南省玉溪市江川二中2019-2020学年高三上学期期中考试化学试题四川省自贡市田家炳中学2020届高三上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——化学与STSE青海省西宁市第十四中学2019-2020学年高二上学期期末考试化学试题云南省玉溪一中2019-2020学年高二上学期期末考试化学试题新疆阿克苏市阿瓦提四中2020届高三上学期第二次月考化学试题重庆市南开中学高一下学期化学人教版第1章《非金属及其化合物》单元测试河北省承德市第一中学2019-2020学年高二下学期3月疫情期间直播课堂检测化学试题辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题(已下线)专题一 化学与STSE(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训西藏自治区拉萨市拉萨中学2019-2020学年高二第五次月考理科综合化学试题甘肃省西北师范大学附属中学2019-2020学年高二上学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期第三次月考化学试题模拟卷05——2020年秋高二化学开学摸底考试卷(全国通用)(已下线)小题必刷01 物质的组成、分类和性质 ——2021年高考化学一轮复习小题必刷(通用版)吉林省松原市油田第十一中学2021届高三第一次阶段考试化学试题河南省郑州市第一〇六高级中学2021届高三上学期9月月考化学试题天津市南开中学2021届高三上学期第二次月考化学试题安徽省临泉第一中学2020-2021学年高二上学期第三次月考化学试题山东济南章丘第四中学2021届高三上学期第一次阶段性检测化学试题四川省成都外国语学校2020-2021学年高二下学期开学考试化学试题(已下线)专题01 物质的组成、性质和分类——备战2021年高考化学纠错笔记安徽省淮北市树人高级中学2020-2021学年高二上学期期末考试化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题吉林省梅河口市第五中学2021-2022学年高二上学期开学考试化学试题(已下线)第1周 晚练题-备战2022年高考化学周测与晚练(新高考专用)山东省济南市平阴县第一中学2021-2022学年高三10月月考化学试题辽宁省抚顺市抚顺县高级中学2021-2022学年高三10月月考化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期期中考试化学试题(已下线)专题01STSE化学用语-五年(2018~2022)高考真题汇编(全国卷)广西北海市普通高中2022届高三第四次模拟考试化学试题陕西省黄陵中学2021-2022学年高三上学期期中考试化学试题新疆叶城县第八中学2021-2022学年高三上学期第二次月考化学试题天津市南开中学2022-2023学年高三上学期统练三化学试题内蒙古巴彦淖尔市临河区第三中学2021~2022学年高三上学期期中考试化学试题广东省 汕头市潮阳区河溪中学2022-2023学年高二下学期期中考试化学试题湖南省永州市第一中学2023-2024学年高二上学期9月月考化学试题海南省海口市琼山华侨中学2023-2024学年高三上学期第二次月考化学试题辽宁省沈阳市东北育才学校科学高中部2024届高三下学期最后一模化学试题
单选题
|
适中(0.65)
名校
15. 在一定条件下, 溶液中存在水解平衡:
溶液中存在水解平衡: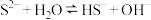 ,下列说法正确的是
,下列说法正确的是
 溶液中存在水解平衡:
溶液中存在水解平衡: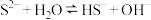 ,下列说法正确的是
,下列说法正确的是| A.稀释溶液,水解平衡常数增大 | B.加入 固体,溶液 固体,溶液 减小 减小 |
C.升高温度, 减小 减小 | D.加入 固体, 固体, 浓度减小 浓度减小 |
【知识点】 影响盐类水解程度的主要因素 盐的水解常数解读
您最近一年使用:0次
2022-11-18更新
|
359次组卷
|
20卷引用:【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(普通班)上学期期末考试化学试题
【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(普通班)上学期期末考试化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高二(实验班)上学期期末考试化学试题四川省射洪县射洪中学2018-2019学年高二下学期期中考试化学试题苏教版选修四化学反应原理专题3第三单元 盐类的水解 同步检测试卷江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题河南省南阳市第一中学2019-2020学年高二上学期第四次月考化学试题湖北省利川市第五中学2019-2020学年高二12月月考化学试题安徽省六安市新安中学2020-2021学年高二下学期入学考试(重点班)化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题四川省成都七中2022届高三上学期入学测化学试题(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)3.3.2 影响盐类水解的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)河北省衡水市第十四中学2021-2022学年高二上学期二调考试化学试题河南省桐柏县第一高级中学2021-2022学年高二上学期期中考试化学试题(已下线)第23讲 盐类水解 (练)-2023年高考化学一轮复习讲练测(新教材新高考)黑龙江省牡丹江市第二中学2022-2023学年高二上学期期中考试化学试题黑龙江省哈尔滨工业大学附属中学校2021-2022学年高二上学期期中考试化学试题吉林省长春市第二中学2023-2024学年高二上学期11月期中考试化学试题黑龙江省海林市朝鲜族中学2023-2024学年高二上学期第三次考试(期末)化学试卷
单选题
|
较易(0.85)
名校
16. 下列溶液在空气中加热蒸干并灼烧后,能得到相应溶质固体的是
| A.FeCl3 | B.KHCO3 | C.Fe2(SO4)3 | D.FeSO4 |
您最近一年使用:0次
2016-10-12更新
|
172次组卷
|
3卷引用:2016-2017学年河北省冀州中学高二上第三次月考化学卷
2016-2017学年河北省冀州中学高二上第三次月考化学卷(已下线)【南昌新东方】江西省九江第一中学2018-2019学年高二上学期第二次月考化学试题安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题
单选题
|
适中(0.65)
17. 已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17,下列叙述中正确的是
| A.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 |
| B.将0.001 mol·L-1 AgNO3溶液滴入KCl和KI的混合溶液中,一定产生AgI沉淀 |
| C.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 |
| D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)>c(Cl-) |
【知识点】 难溶电解质的溶解平衡 沉淀溶解平衡的应用 溶度积规则及其应用解读
您最近一年使用:0次
2018-11-22更新
|
136次组卷
|
4卷引用:2018年11月17日 《每日一题》人教选修4-周末培优
(已下线)2018年11月17日 《每日一题》人教选修4-周末培优安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用广东省汕尾市林伟华中学2023-2024学年高二上学期期中考试化学试卷
单选题
|
适中(0.65)
名校
解题方法
18. 化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
 CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是| A.MnS的Ksp比CuS的Ksp大 |
| B.该反应达到平衡时c(Mn2+)=c(Cu2+) |
| C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K=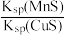 |
【知识点】 溶度积 浓度对难溶电解质溶解平衡的影响解读 沉淀转化解读
您最近一年使用:0次
2020-12-16更新
|
903次组卷
|
38卷引用:2013届湖北省黄冈市高三上学期期末考试理综化学试卷
(已下线)2013届湖北省黄冈市高三上学期期末考试理综化学试卷(已下线)2013-2014学年江西省鹰潭一中高二上学期期中考试化学试卷(已下线)2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(已下线)2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(已下线)2013-2014四川省攀枝花市高三5月模拟考试理综化学试卷2015-2016学年河北邯郸魏县一中、曲周县一中高二上期中化学试卷辽宁省抚顺市第十九中学2016-2017学年高二上学期期中考试化学试题内蒙古集宁一中西校区2017-2018学年高二上学期期中考试化学试题福建省福州市长乐高级中学2020届高三上学期第一次月考化学试题陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题(已下线)2019年11月19日《每日一题》高二化学人教版(选修4)—— 沉淀溶解平衡在物质分离中的应用(已下线)专题8.4 难溶电解质的溶解平衡(练)-《2020年高考一轮复习讲练测》山西省朔州市怀仁一中2019-2020学年高二上学期第四次月考化学试题河北省邯郸市大名县第一中学2019-2020学年高二上学期12月月考化学试题(普通班)四川省广元川师大万达中学2019-2020学年高二上学期期末教学质量检测化学试题云南省丽江市华坪县第一中学2019—2020学年高二上学期期末考试化学试题辽宁省抚顺市六校协作体2019-2020学年高二上学期期末考试化学试题黑龙江省哈尔滨市宾县第一中学2019-2020学年高二上学期期末考试化学试题湖南省长沙市雨花区2019-2020学年高二上学期期末考试化学(选考)试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高二上学期期中考试化学试题重庆市万州纯阳中学2020-2021学年高二上学期期中考试化学试题陕西省宝鸡市宝鸡中学2020-2021学年高二上学期阶段考试(一)化学试题四川省成都市郫都区川科外国语学校2020-2021学年高二11月月考化学试题黑龙江省哈尔滨市延寿县第二中学2020-2021学年高二11月月考化学试题安徽省怀宁中学2020-2021学年高二上学期第二次质量检测(普通班)化学试题陕西省榆林市第十二中学2020-2021学年高二下学期第一次月考化学试题(已下线)押全国卷理综第12题 水溶液中的离子平衡-备战2021年高考化学临考题号押题(课标全国卷)(已下线)小题22 难溶电解质的溶解平衡——备战2021年高考化学经典小题考前必刷(全国通用)安徽省安庆市九一六学校2020—2021学年高二4月月考化学试题云南省永胜县第一中学2020-2021学年高二下学期6月份考试化学试题(已下线)专题27 难溶电解质的溶解平衡(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练安徽省蚌埠第三中学2021-2022学年高二下学期开学测试化学试题第四节 沉淀溶解平衡 第2课时 沉淀溶解平衡的应用(已下线)第24讲 沉淀溶解平衡(练)-2023年高考化学一轮复习讲练测(新教材新高考)陕西省咸阳市秦都区2021-2022学年高二上学期期末考试化学试题上海市行知中学2022-2023学年高二下学期2月月考化学试题(已下线)第5讲 难溶电解质的溶解平衡青海省西宁市海湖中学2023-2024学年高二下学期开学考试化学试卷
二、计算题 添加题型下试题
计算题
|
适中(0.65)
解题方法
19. (1)25 ℃时,0.05mol·L-1H2SO4溶液的pH=_______ ,0.01 mol·L-1NaOH溶液的pH=_______ 。
(2)某温度下纯水中的c(H+)=2×10-7 mol·L-1,则此时溶液中的c(OH-)=_______ ;若温度不变,滴入稀盐酸,使c(H+)=5×10-4 mol·L-1,则此时溶液中由水电离产生的c(H+)=_______ 。
(2)某温度下纯水中的c(H+)=2×10-7 mol·L-1,则此时溶液中的c(OH-)=
您最近一年使用:0次
三、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
20. (1)选用以下主要仪器和试剂,是否可以达到测定NaOH溶液浓度的目的_______ (填“是”或“否”)。
主要仪器:滴定管、锥形瓶、烧杯 试剂:NaOH溶液、0.1000 mol·L-1盐酸
(2)现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______ (填“甲”或“乙”)中。

(3)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
上述B步骤操作的目的是_______ 。判断到达滴定终点的实验现象是_______ 。
(4)图是碱式滴定管中液面在滴定前后的读数,c(HCl)=_______ mol·L-1。

主要仪器:滴定管、锥形瓶、烧杯 试剂:NaOH溶液、0.1000 mol·L-1盐酸
(2)现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
用标准NaOH溶液滴定时,应将标准NaOH溶液注入

(3)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
上述B步骤操作的目的是
(4)图是碱式滴定管中液面在滴定前后的读数,c(HCl)=

您最近一年使用:0次
四、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
21. (1)对于Ag2S(s)⇌2Ag+(aq)+S2-(aq),其Ksp的表达式为_______
(2)下列说法不正确的是_______ (填序号)。
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般来说,物质的溶解度随温度的升高而增加,故物质的溶解过程大多是吸热过程
③对于Al(OH)3(s)⇌Al3+(aq)+3OH-(aq)和Al(OH)3⇌Al3++3OH-,前者为溶解平衡,后者为电离平衡
④除去溶液中的Mg2+,用OH-沉淀比用CO 好,说明Mg(OH)2的溶解度比MgCO3大
好,说明Mg(OH)2的溶解度比MgCO3大
⑤沉淀反应中常加入过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去Mg(OH)2中混有的Ca(OH)2_______
(4)已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为_______ mol·L-1。
(2)下列说法不正确的是
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般来说,物质的溶解度随温度的升高而增加,故物质的溶解过程大多是吸热过程
③对于Al(OH)3(s)⇌Al3+(aq)+3OH-(aq)和Al(OH)3⇌Al3++3OH-,前者为溶解平衡,后者为电离平衡
④除去溶液中的Mg2+,用OH-沉淀比用CO
 好,说明Mg(OH)2的溶解度比MgCO3大
好,说明Mg(OH)2的溶解度比MgCO3大⑤沉淀反应中常加入过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去Mg(OH)2中混有的Ca(OH)2
(4)已知在25 ℃时Ksp[Mg(OH)2]=3.2×10-11,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学反应原理、化学与STSE、常见无机物及其应用
试卷题型(共 21题)
题型
数量
单选题
18
计算题
1
解答题
1
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 水解的离子方程式书写 盐溶液的酸碱性判断 | |
| 2 | 0.4 | 浓度对电离平衡的影响 | |
| 3 | 0.85 | 溶液pH的计算 pH定义式及计算 酸与酸或碱与碱混合后pH的计算 | |
| 4 | 0.65 | 酸碱中和滴定实验基本操作及步骤 酸碱中和滴定实验相关仪器 酸碱中和滴定的误差分析 酸碱中和滴定的综合考查 | |
| 5 | 0.65 | 酸与酸或碱与碱混合后pH的计算 酸碱混合时的定性判断及计算 | |
| 6 | 0.85 | 浓度对电离平衡的影响 同离子效应对电离的影响 温度对电离平衡的影响 | |
| 7 | 0.85 | 溶液的酸碱性与pH的关系 对人体健康具有重要意义的有机物 合理安排饮食 | |
| 8 | 0.85 | 影响水电离的因素 溶液的酸碱性与pH的关系 | |
| 9 | 0.85 | 水的离子积常数 影响水电离的因素 | |
| 10 | 0.85 | 水的离子积常数 影响水电离的因素 | |
| 11 | 0.94 | 测定溶液pH的方法 | |
| 12 | 0.85 | 盐类水解规律 盐溶液的酸碱性判断 | |
| 13 | 0.94 | 影响水电离的因素 盐类水解的原理 盐类水解规律理解及应用 | |
| 14 | 0.85 | 漂白粉和漂粉精 碳酸钠的俗称、物理性质及用途 明矾的净水作用及原理 化学科学对人类文明发展的意义 | |
| 15 | 0.65 | 影响盐类水解程度的主要因素 盐的水解常数 | |
| 16 | 0.85 | 盐类水解的应用 盐类水解在解题方面的应用 制备与水解有关的物质 盐类水解在生活、生产中的应用 | |
| 17 | 0.65 | 难溶电解质的溶解平衡 沉淀溶解平衡的应用 溶度积规则及其应用 | |
| 18 | 0.65 | 溶度积 浓度对难溶电解质溶解平衡的影响 沉淀转化 | |
| 二、计算题 | |||
| 19 | 0.65 | 溶液pH的计算 水的离子积常数 | |
| 三、解答题 | |||
| 20 | 0.65 | 酸碱中和滴定实验基本操作及步骤 酸碱中和滴定实验相关仪器 酸碱中和滴定的综合考查 | 实验探究题 |
| 四、填空题 | |||
| 21 | 0.65 | 同离子效应对难溶电解质溶解平衡的影响 沉淀转化 溶度积定义及表达式 | |



