吉林省松原市油田第十一中学2021届高三第一次阶段考试化学试题
吉林
高三
阶段练习
2020-10-19
272次
整体难度:
容易
考查范围:
常见无机物及其应用、化学与STSE、认识化学科学、化学实验基础、物质结构与性质、有机化学基础、化学反应原理
一、单选题 添加题型下试题
| A.碳酸钠可用于去除餐具的油污 | B.漂白粉可用于生活用水的消毒 |
| C.氢氧化铝可用于中和过多胃酸 | D.碳酸钡可用于胃肠X射线造影检查 |
| A.用丁达尔效应可鉴别NaCl溶液和Fe(OH)3胶体 |
| B.焰色反应实验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 |
| C.检验Na2CO3固体中是否混有NaHCO3,可向固体中直接滴加稀盐酸,如果观察到立刻有气体产生,说明混有NaHCO3 |
| D.向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- |
【知识点】 胶体的性质和应用解读 碳酸钠与碳酸氢钠性质的比较解读 离子的检验
| A.小苏打可作制糕点的发酵剂 | B.晶体硅可用于制光导纤维 |
| C.钠可用于制高压钠灯 | D.镁可用于制造信号弹和焰火 |
| A.水、双氧水、水玻璃都是纯净物 | B.石墨和C60互为同位素 |
| C.磷酸钙中所含的元素都是短周期元素 | D.一定条件下石墨转化为C60是化学变化 |
| A.构成冠状病毒的蛋白质与RNA都是高分子化合物 |
| B.医用酒精含乙醇95% |
| C.医治冠状病毒肺炎药物研发的其中一个方向,是通过化学合成物质抑制病毒在体内复制 |
| D.84消毒液有效成分是NaClO,不可与酒精混合使用 |
| A | B | C | D |
|  |
|  |
| 酸性重铬酸钾用于检测酒精 | 铝粉与强碱溶液反应放热 | 植物油在空气中变质,产生“哈喇”味 | 海水经风吹日晒获得粗盐 |
| A.A | B.B | C.C | D.D |
| A.金属钠与氧气反应的产物与氧气的用量无关 |
| B.NaHCO3的热稳定性大于Na2CO3 |
| C.漂白粉漂白织物利用了物质的氧化性 |
| D.1 mol Na2O2固体中含离子总数为3NA |
①钠在饱和澄清石灰水层反应并四处游动 ②有气体产生 ③澄清石灰水变浑浊 ④钠在石灰水与苯的界面处反应并上下跳动 ⑤钠停留在苯层不反应 ⑥钠块最后消失
| A.①②⑥ | B.②③④⑥ | C.⑤ | D.①②③⑥ |
| 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 | |
| A | CO2 | CuO | H2SO4 | NH3·H2O | Na2S |
| B | CO | Na2O | HCl | NaOH | NaCl |
| C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
| D | NO2 | CaO | HNO3 | Cu2(OH)2CO3 | CaCO3 |
| A.A | B.B | C.C | D.D |
| A.相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强 |
| B.常温时溶解度:Na2CO3>NaHCO3 |
| C.在酒精灯加热的条件下,前者不分解,后者分解 |
| D.都能与烧碱反应,后者反应较慢 |
【知识点】 碳酸钠与碳酸氢钠性质的比较解读
| A.Cl2 | B.HCl | C.MgCl2 | D.Mg(OH)2 |
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++H2O | 碱性氧化物与酸反应生成盐和水,正确 |
| B | 向亚硫酸铵溶液中加少量氢氧化钡溶液Ba2++SO =BaSO3↓ =BaSO3↓ | 复分解反应,有沉淀生成,正确 |
| C | 含n molFeBr2的溶液中通入n molCl2完全反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 |
| D | 氯化铁溶液中滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 | 复分解反应,无气体生成,无沉淀生成,不正确 |
| A.A | B.B | C.C | D.D |
【知识点】 离子方程式的正误判断解读
| A.强电解质在固态或液态时,可能不导电 |
| B.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| C.同一弱电解质溶液,温度不同时,导电能力不同 |
| D.强电解质在溶液中完全电离,不存在电离平衡 |
A.氯化铝溶液与氨水反应:Al3++3OH- Al(OH)3↓ Al(OH)3↓ |
B.氧化镁与稀盐酸反应:MgO+2H+ Mg2++H2O Mg2++H2O |
C.铜与氯化铁溶液反应:2Fe3++3Cu 2Fe+3Cu2+ 2Fe+3Cu2+ |
D.稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+ BaSO4↓ BaSO4↓ |
【知识点】 离子方程式的正误判断解读
A.Na+、Ba2+、 、 、 | B. 、 、 、Cl-、K+ 、Cl-、K+ |
C.Cl-、K+、 、 、 | D.Al3+、Cu2+、Cl-、 |
【知识点】 离子反应的发生条件解读 离子共存 限定条件下的离子共存解读
| A.用小苏打治疗胃酸过多:HCO3﹣+H+=CO2↑+H2O |
| B.往碳酸镁中滴加稀盐酸:CO32﹣+2H+=CO2↑+H2O |
| C.往氨水中滴加氯化镁溶液:Mg2+2OH﹣=M(OH)2↓ |
| D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42﹣+H++OH﹣=BaSO4↓+H2O |
【知识点】 离子反应的发生及书写 离子方程式的书写解读 离子方程式的正误判断解读
A.c(Fe3+)=0.1mol/L的溶液中:NH 、I-、SO 、I-、SO 、Cl- 、Cl- |
B.无色透明溶液中:Ca2+、NH 、Cu2+、SO 、Cu2+、SO |
C.0.1 mol·L-1AgNO3溶液:H+、K+、SO 、Br- 、Br- |
D.pH=12的溶液中:K+、Cl-、CH3COO-、CO |
【知识点】 限定条件下的离子共存解读
| A.Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:4FeO42-+10H2O+4Fe3+=== 20OH-+3O2↑ |
| B.工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4离子方程式为:2Fe3++10OH-+3ClO-===2FeO42-+3Cl-+5H2O |
| C.Na2FeO4消毒杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是:Fe3++3H2O===Fe(OH)3(胶体)+3H+ |
| D.工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为:Fe-6e-+8OH-===FeO42-+4H2O |
21. 下列反应既属于氧化还原反应又属于离子反应的是
| A.盐酸与氢氧化钠溶液的反应 | B.高锰酸钾受热分解 |
| C.碳酸钙与盐酸反应 | D.铁与稀硫酸反应 |
【知识点】 离子反应概念解读 氧化还原反应定义、本质及特征解读
①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+
②加入KSCN显红色的溶液:K+、NH
 、Cl-、S2-
、Cl-、S2-③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO
 、K+
、K+④pH=2的溶液中:NH
 、Na+、Cl-、Cu2+
、Na+、Cl-、Cu2+⑤由水电离出的c(OH-)=1×10-13mol•L-1的溶液中Mg2+、Ba2+、Cl-、Br-
| A.②③ | B.①③ | C.①⑤ | D.③④ |
【知识点】 限定条件下的离子共存解读
①在氧化还原反应中,某元素由化合态变为单质,此元素可能被还原,也可能被氧化
②在氧化还原反应中,非金属单质一定是氧化剂,金属单质一定是还原剂
③化合物分解的产物有单质,则该分解反应必属于氧化还原反应
④化学反应K2MnO4+Cl2=2KCl+MnO2+O2属于氧化还原反应
⑤金属阳离子只有氧化性,HI只有还原性
⑥漂白粉在空气中的变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生
⑦某单质X能从盐的溶液中置换出单质Y,当X、Y都是非金属时,Y一定比X活泼⑧1molNa2O2与足量的水反应,转移的电子数为2NA
⑨5.6g铁粉与硝酸反应失去电子数一定为0.3NA
| A.③④⑦⑧ | B.①②⑤⑧ | C.①③④⑥ | D.④⑤⑥⑦ |
【知识点】 氧化还原反应基本概念 氧化还原反应的规律解读
①Na2O2中阴、阳离子的个数比是1∶1
②K2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3 和O2
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦K2O2与水反应,K2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊溶液中,溶液先变蓝,后褪色
| A.3个 | B.4个 | C.5个 | D.6个 |
二、多选题 添加题型下试题
 是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
是一种环保、高效、多功能饮用水处理剂,制备流程如图所示: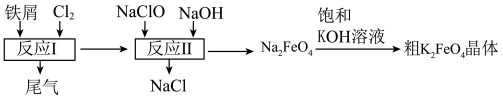
下列叙述不正确的是( )
A.用 作水处理剂时,既能杀菌消毒又能净化水 作水处理剂时,既能杀菌消毒又能净化水 |
B.反应Ⅰ中尾气可用 溶液吸收再利用 溶液吸收再利用 |
C.反应Ⅱ中氧化剂与还原剂的物质的量之比为 |
D.该条件下,物质的溶解性: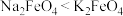 |
三、单选题 添加题型下试题
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
| A.上述①和③中的铁钉只作还原剂 |
| B.上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
| C.实验②中Fe2+既显氧化性又显还原性 |
| D.实验③中反应的离子方程式为Fe+Fe3+=2Fe2+ |
 、
、 、
、 、
、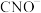 (C+4价,N-3价)、
(C+4价,N-3价)、 等微粒。下列说法不正确的是
等微粒。下列说法不正确的是
| A.该废水呈强酸性 |
| B.废水处理后转化为无害物质 |
C.反应的离子方程式: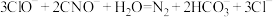 |
D.每处理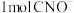 转移 转移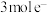 |
 ,下列说法不正确的是
,下列说法不正确的是
A.a装置中反应的离子方程式 +2H+=CO2↑+H2O +2H+=CO2↑+H2O |
| B.装置 b盛装饱和NaHCO3溶液除去挥发出来的HCl气体 |
| C.装置c中含氨的饱和食盐水提高了CO2吸收效率 |
| D.反应后将装置c中的锥形瓶浸入冷水充分冷却,过滤得到NaHCO3晶体 |
A.1 L0.l mol/L的Na2CO3溶液中含 、 、 数目之和是0.1 NA个 数目之和是0.1 NA个 |
| B.0.1 molOH- 和1.7g羟基的电子数均为是NA |
| C.1molN2与4mol H2反应生成的 NH3分子数为2NA |
| D.加热条件下,含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA |
| A.25℃时, pH=12的Ba(OH)2溶液中含有的OH-的数目为0.01NA |
| B.7.9g[B(OH)4]-含有价电子数目为3.2NA个电子 |
| C.过量的Fe与22.4LCl2充分反应转移电子数为2NA |
| D.标准状况下,11.2 L HCl含有的H+ 0.5NA |
四、解答题 添加题型下试题
请回答下列问题:
(1)现需配制250 mL 0.100 mol·L-1标准Na2S2O3溶液,所需要的玻璃仪器除量筒、250 mL容量瓶、玻璃棒外,还需要
(2)需准确称取Na2S2O3固体的质量为
(3)另取废水50.00 mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得到BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时
 全部转化为
全部转化为 ;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL。已知有关反应的离子方程式为①
;再加入过量KI溶液进行反应,然后在反应液中滴加上述标准Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00 mL。已知有关反应的离子方程式为① +6I-+14H+=2Cr3++3I2+7H2O;②2
+6I-+14H+=2Cr3++3I2+7H2O;②2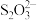 +I2=2I-+
+I2=2I-+ ,则该工厂废水中Ba2+的物质的量浓度为
,则该工厂废水中Ba2+的物质的量浓度为Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu₂O。
(1)Cu2+基态核外电子排布式为
(2)
 的空间构型为
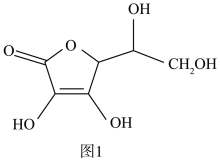
的空间构型为(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为
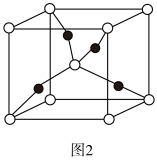
(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为
(1)0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合
(2)向NaHCO3溶液中加入过量澄清石灰水
(3)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄:
(4)FeBr2溶液中通入少量氯气
(5)NaClO可以将MnSO4氧化成MnO2沉淀:
【Ⅱ】NaH和NaAlH4都是重要的还原剂,一定条件下金属钠和H2反应生成NaH。NaH与水反应可生成H2,NaH与AlCl3反应可得到NaAlH4,请推测并回答:
(6)NaH与AlCl3反应得到NaAlH4的化学方程式为
(7)NaAlH4与水发生氧化还原反应的化学方程式为
(8)NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程中生成两种产物,其反应的化学方程式为
五、填空题 添加题型下试题
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为
②该产气药剂中NaN3的质量分数为
【知识点】 氧化还原反应有关计算 化学键概念理解及判断解读
试卷分析
试卷题型(共 34题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 漂白粉和漂粉精 碳酸钠的俗称、物理性质及用途 明矾的净水作用及原理 化学科学对人类文明发展的意义 | |
| 2 | 0.85 | 胶体的性质和应用 碳酸钠与碳酸氢钠性质的比较 离子的检验 | |
| 3 | 0.85 | 二氧化硅的用途 钠单质的保存与用途 碳酸氢钠的俗称、物理性质及用途 镁的用途 | |
| 4 | 0.85 | 几种常见硅酸盐矿物 几组常见同素异形体 | |
| 5 | 0.65 | 乙醇的物理性质 化学科学对人类文明发展的意义 人体健康基本维护 药物的合理使用 | |
| 6 | 0.94 | 物理变化与化学变化 铝 乙醇与强氧化剂的反应 油脂的性质 | |
| 7 | 0.85 | 漂白粉和漂粉精的用途 过氧化钠的物理性质、组成、结构及用途 碳酸钠与碳酸氢钠性质的比较 | |
| 8 | 0.85 | 分类方法的应用 无机物质的分类 | |
| 9 | 0.65 | 钠的物理性质 钠与水反应原理 | |
| 10 | 0.85 | 分类方法的应用 无机物质的分类 酸、碱、盐、氧化物的概念及其相互联系 | |
| 11 | 0.65 | 碳酸钠与碳酸氢钠性质的比较 | |
| 12 | 0.65 | 化学物质的分类方法 酸、碱、盐、氧化物的概念及其相互联系 | |
| 13 | 0.85 | 电解质与非电解质 电解质的电离 | |
| 14 | 0.65 | 离子方程式的正误判断 | |
| 15 | 0.85 | 电解质、非电解质概念 物质水溶液的导电性 强电解质和弱电解质的判断 温度对电离平衡的影响 | |
| 16 | 0.85 | 离子方程式的正误判断 | |
| 17 | 0.85 | 离子反应的发生条件 离子共存 限定条件下的离子共存 | |
| 18 | 0.85 | 离子反应的发生及书写 离子方程式的书写 离子方程式的正误判断 | |
| 19 | 0.65 | 限定条件下的离子共存 | |
| 20 | 0.4 | 氧化还原反应方程式的配平 氧化还原反应在生活、生产中的应用 高铁酸钠 | |
| 21 | 0.85 | 离子反应概念 氧化还原反应定义、本质及特征 | |
| 22 | 0.65 | 限定条件下的离子共存 | |
| 23 | 0.65 | 氧化还原反应基本概念 氧化还原反应的规律 | |
| 24 | 0.65 | 氧化还原反应基本概念 氧化还原反应有关计算 氧化还原反应在生活、生产中的应用 过氧化钠 | |
| 26 | 0.65 | 氧化还原反应基本概念 氧化性、还原性强弱的比较 氧化还原反应的规律 硝酸的强氧化性 | |
| 27 | 0.65 | 氧化还原反应的应用 氧化还原反应的规律 | |
| 28 | 0.65 | 物质分离、提纯的常见化学方法 常见无机物的制备 纯碱的生产 | |
| 29 | 0.65 | 阿伏加德罗常数的应用 结合物质结构基础知识与NA相关推算 浓硫酸的强氧化性 | |
| 30 | 0.65 | 结合气体物质与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 二、多选题 | |||
| 25 | 0.85 | 氧化还原反应的规律 有关铁及其化合物转化的流程题型 高铁酸钠 盐类水解在生活、生产中的应用 | |
| 三、解答题 | |||
| 31 | 0.65 | 氧化还原反应有关计算 一定物质的量浓度的溶液的配制 配制一定物质的量浓度的溶液实验的仪器 探究物质组成或测量物质的含量 | 实验探究题 |
| 32 | 0.85 | 利用杂化轨道理论判断化学键杂化类型 简单配合物的成键 氢键对物质性质的影响 晶胞的有关计算 | 结构与性质 |
| 33 | 0.65 | 离子方程式的书写 | 无机推断题 |
| 四、填空题 | |||
| 34 | 0.4 | 氧化还原反应有关计算 化学键概念理解及判断 | |





