氧化铋( )是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一,以下是一种用铋精矿(
)是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一,以下是一种用铋精矿( ,含有
,含有 及不溶性杂质)制备
及不溶性杂质)制备  的一种方法, 其流程如图:
的一种方法, 其流程如图:

已知:① ;开始沉淀的pH值为 1.9,沉淀完全时的pH值为3.2
;开始沉淀的pH值为 1.9,沉淀完全时的pH值为3.2
②pH≥3 时,BiCl3;极易水解为白色的BiOCl沉淀。
请回答以下问题:
(1)已知磷与铋同主族,铋原子价层电子排布式为:___________ ;处于下列状态的磷原子或离子失去最外层一个电子所需能量最高的是___________ (填标号)。
a. b.
b.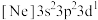 c.
c. d.
d.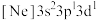
(2)“加压浸取”过程中, 转化为
转化为 ,
, 转化为
转化为
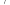 而Cu2S溶解进入浸出液形成深蓝色溶液,且硫元素转化为
而Cu2S溶解进入浸出液形成深蓝色溶液,且硫元素转化为
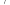 请写出Cu2S在此过程中发生反应的离子方程式:
请写出Cu2S在此过程中发生反应的离子方程式:___________ 。
(3)实验室灼烧[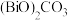 ]时用到的硅酸盐制品有
]时用到的硅酸盐制品有___________ 、___________ 、酒精灯、玻璃棒。
(4)根据流程分析,盐酸羟胺(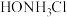 )在流程中的作用是:①
)在流程中的作用是:①___________ ;②___________ 。
(5)流程中在加热条件下生成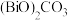 时同时有能使澄清石灰水变浑浊的气体产生,该步骤的化学方程式为:
时同时有能使澄清石灰水变浑浊的气体产生,该步骤的化学方程式为:___________ 。
(6)实际生产过程中温度保持在50℃左右,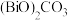 产率较高,请分析原因
产率较高,请分析原因________ 。
 )是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一,以下是一种用铋精矿(
)是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一,以下是一种用铋精矿( ,含有
,含有 及不溶性杂质)制备
及不溶性杂质)制备  的一种方法, 其流程如图:
的一种方法, 其流程如图:
已知:①
 ;开始沉淀的pH值为 1.9,沉淀完全时的pH值为3.2
;开始沉淀的pH值为 1.9,沉淀完全时的pH值为3.2②pH≥3 时,BiCl3;极易水解为白色的BiOCl沉淀。
请回答以下问题:
(1)已知磷与铋同主族,铋原子价层电子排布式为:
a.
 b.
b.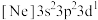 c.
c. d.
d.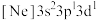
(2)“加压浸取”过程中,
 转化为
转化为 ,
, 转化为
转化为
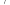 而Cu2S溶解进入浸出液形成深蓝色溶液,且硫元素转化为
而Cu2S溶解进入浸出液形成深蓝色溶液,且硫元素转化为
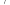 请写出Cu2S在此过程中发生反应的离子方程式:
请写出Cu2S在此过程中发生反应的离子方程式:(3)实验室灼烧[
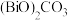 ]时用到的硅酸盐制品有
]时用到的硅酸盐制品有(4)根据流程分析,盐酸羟胺(
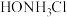 )在流程中的作用是:①
)在流程中的作用是:①(5)流程中在加热条件下生成
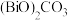 时同时有能使澄清石灰水变浑浊的气体产生,该步骤的化学方程式为:
时同时有能使澄清石灰水变浑浊的气体产生,该步骤的化学方程式为:(6)实际生产过程中温度保持在50℃左右,
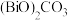 产率较高,请分析原因
产率较高,请分析原因
更新时间:2023-11-11 15:55:47
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】为实现2030年碳达峰、2060年碳中和的战略目标,重庆市沙坪坝区拆除某废弃煤电厂,设备及烟囱中存有大量的粉煤灰(主要成分为 、
、 ,还含少量
,还含少量 )和耐热镁铬砖(主要成分为MgO和
)和耐热镁铬砖(主要成分为MgO和 ),拟进行各种金属的分离并制备镁尖晶石(
),拟进行各种金属的分离并制备镁尖晶石( )。该工艺中,溶液中金属离子开始沉淀和完全沉淀以及开始溶解和完全溶解的pH如下表一所示:
)。该工艺中,溶液中金属离子开始沉淀和完全沉淀以及开始溶解和完全溶解的pH如下表一所示:
表一
已知:①元素铬(Ⅲ)在溶液中存在形式:酸性: ;碱性:
;碱性: 。
。
② 为两性物质,可溶于NaOH溶液,也可溶于氨水形成
为两性物质,可溶于NaOH溶液,也可溶于氨水形成 。
。
Ⅰ.各种金属离子的分离
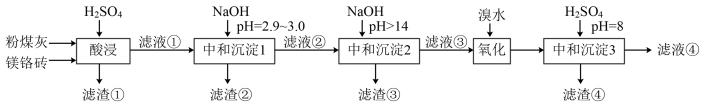
(1)“酸浸”中,滤渣①的成分是___________ 。
(2)滤液②中的金属离子为 、
、 、
、___________ 。
(3)“中和沉淀2”中, 发生转变的总离子方程式为
发生转变的总离子方程式为___________ 。
(4)“氧化”中, 转变为
转变为 的离子方程式为
的离子方程式为___________ 。下图为工厂液溴储存罐示意图,c层的颜色为___________ 。

(5)“中和沉淀3”中, 时,溶液中c(AlO
时,溶液中c(AlO )
)___________ mol/L。已知: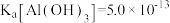 ,
,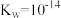 ,
, 。
。
Ⅱ.取滤液②利用“共沉淀法”制备镁尖晶石( )
)

(6)应先向沉淀反应器中加入___________ (填“A”或“B”),再滴加另一反应物。(参考表一中数据作答)
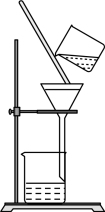
(7)①下图所示过滤操作的错误是___________ (任答一处即可)。
②判断流程中沉淀是否洗净所用的试剂是___________ 。高温焙烧时,用于盛放固体的仪器名称是___________ 。
 、
、 ,还含少量
,还含少量 )和耐热镁铬砖(主要成分为MgO和
)和耐热镁铬砖(主要成分为MgO和 ),拟进行各种金属的分离并制备镁尖晶石(
),拟进行各种金属的分离并制备镁尖晶石( )。该工艺中,溶液中金属离子开始沉淀和完全沉淀以及开始溶解和完全溶解的pH如下表一所示:
)。该工艺中,溶液中金属离子开始沉淀和完全沉淀以及开始溶解和完全溶解的pH如下表一所示:表一
| 金属离子 | 开始沉淀pH | 完全沉淀pH | 沉淀开始溶解 | 沉淀完全溶解 |
 | 1.5 | 2.9 | — | — |
 | 3 | 5 | 8 | 11 |
 | 10 | 12 | — | — |
 | 4 | 7 | 12 | 14 |
 ;碱性:
;碱性: 。
。②
 为两性物质,可溶于NaOH溶液,也可溶于氨水形成
为两性物质,可溶于NaOH溶液,也可溶于氨水形成 。
。Ⅰ.各种金属离子的分离

(1)“酸浸”中,滤渣①的成分是
(2)滤液②中的金属离子为
 、
、 、
、(3)“中和沉淀2”中,
 发生转变的总离子方程式为
发生转变的总离子方程式为(4)“氧化”中,
 转变为
转变为 的离子方程式为
的离子方程式为
(5)“中和沉淀3”中,
 时,溶液中c(AlO
时,溶液中c(AlO )
)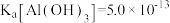 ,
,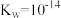 ,
, 。
。Ⅱ.取滤液②利用“共沉淀法”制备镁尖晶石(
 )
)
(6)应先向沉淀反应器中加入
(7)①下图所示过滤操作的错误是
②判断流程中沉淀是否洗净所用的试剂是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】 应用广泛。利用工业废碱渣(主要成分
应用广泛。利用工业废碱渣(主要成分 )吸收硫酸厂尾气中的
)吸收硫酸厂尾气中的 制备无水
制备无水 的成本低、优势明显,其流程如下:
的成本低、优势明显,其流程如下:

已知:① 溶液的pH约为4.7;
溶液的pH约为4.7;
②吸收过程中,当吸收塔中pH约为5时吸收液进入中和器。
(1)举例说明向大气中排放 导致的环境问题
导致的环境问题___________ 。
(2)中和器中发生的主要反应的化学方程式是___________ 。
(3)为了促进 结晶,中和器中加入过量的NaOH.请
结晶,中和器中加入过量的NaOH.请结合 化学用语,从平衡移动的角度解释___________ 。
(4)写出生产过程中吸收塔内发生反应的离子方程式___________ 。
(5)检验成品质量。
①取少量成品溶解,___________ ,说明成品中含 。请
。请补全操作与现象 。
②可用碘量法测定成品中 的含量,过程如下:
的含量,过程如下:
ⅰ.将mg成品溶于水配成100mL溶液,取25mL于碘量瓶中,并调至弱酸性;
ⅱ.加入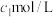 的碘标准液
的碘标准液 ,盖上瓶塞,缓慢振荡使其充分反应;
,盖上瓶塞,缓慢振荡使其充分反应;
ⅲ.用 的
的 标准液滴定至溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点,消耗
标准液滴定至溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点,消耗 标准液
标准液 。(已知:
。(已知: )
)
a.滴定终点的现象是___________ 。
b.成品中 的质量分数是
的质量分数是___________ 。
 应用广泛。利用工业废碱渣(主要成分
应用广泛。利用工业废碱渣(主要成分 )吸收硫酸厂尾气中的
)吸收硫酸厂尾气中的 制备无水
制备无水 的成本低、优势明显,其流程如下:
的成本低、优势明显,其流程如下:
已知:①
 溶液的pH约为4.7;
溶液的pH约为4.7;②吸收过程中,当吸收塔中pH约为5时吸收液进入中和器。
(1)举例说明向大气中排放
 导致的环境问题
导致的环境问题(2)中和器中发生的主要反应的化学方程式是
(3)为了促进
 结晶,中和器中加入过量的NaOH.请
结晶,中和器中加入过量的NaOH.请(4)写出生产过程中吸收塔内发生反应的离子方程式
(5)检验成品质量。
①取少量成品溶解,
 。请
。请②可用碘量法测定成品中
 的含量,过程如下:
的含量,过程如下:ⅰ.将mg成品溶于水配成100mL溶液,取25mL于碘量瓶中,并调至弱酸性;
ⅱ.加入
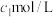 的碘标准液
的碘标准液 ,盖上瓶塞,缓慢振荡使其充分反应;
,盖上瓶塞,缓慢振荡使其充分反应;ⅲ.用
 的
的 标准液滴定至溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点,消耗
标准液滴定至溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点,消耗 标准液
标准液 。(已知:
。(已知: )
)a.滴定终点的现象是
b.成品中
 的质量分数是
的质量分数是
您最近一年使用:0次
【推荐3】硫和碳是生物必须的营养元素,含硫和碳的化合物在自然界中广泛存在。
(1)火山喷发产生
 在大气中发生如下反应:
在大气中发生如下反应:
①
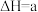 kJ⋅mol
kJ⋅mol
②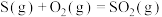
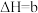 kJ⋅mol
kJ⋅mol
写出 燃烧的热化学方程式
燃烧的热化学方程式___________ 。
(2)工业上可用NaClO碱性溶液吸收
 。为了提高吸收效率,常用
。为了提高吸收效率,常用
 作为催化剂,反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对
作为催化剂,反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对
 的吸收,该催化过程的示意图如图所示,
的吸收,该催化过程的示意图如图所示,
 也可用于脱硫,且脱硫效果比NaClO更好,原因是
也可用于脱硫,且脱硫效果比NaClO更好,原因是
___________ 。

(3)一种从高炉气回收
 制储氢物质HCOOH的综合利用示意图如图所示:
制储氢物质HCOOH的综合利用示意图如图所示:

①写出 的结构式
的结构式___________ 。
②铂电极上 电催化还原为HCOOH,该电极反应方程式为
电催化还原为HCOOH,该电极反应方程式为___________ 。
③铂电极上的副反应除析氢外,没有其它放电过程,若生成HCOOH的电解效率 当电路中转移3 mol
当电路中转移3 mol  时,阴极室溶液的质量增加
时,阴极室溶液的质量增加___________ g。
定义:
(1)火山喷发产生
 在大气中发生如下反应:
在大气中发生如下反应:①

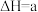 kJ⋅mol
kJ⋅mol
②
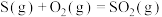
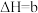 kJ⋅mol
kJ⋅mol
写出
 燃烧的热化学方程式
燃烧的热化学方程式(2)工业上可用NaClO碱性溶液吸收
 。为了提高吸收效率,常用
。为了提高吸收效率,常用 作为催化剂,反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对
作为催化剂,反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 的吸收,该催化过程的示意图如图所示,
的吸收,该催化过程的示意图如图所示, 也可用于脱硫,且脱硫效果比NaClO更好,原因是
也可用于脱硫,且脱硫效果比NaClO更好,原因是
(3)一种从高炉气回收
 制储氢物质HCOOH的综合利用示意图如图所示:
制储氢物质HCOOH的综合利用示意图如图所示:
①写出
 的结构式
的结构式②铂电极上
 电催化还原为HCOOH,该电极反应方程式为
电催化还原为HCOOH,该电极反应方程式为③铂电极上的副反应除析氢外,没有其它放电过程,若生成HCOOH的电解效率
 当电路中转移3 mol
当电路中转移3 mol  时,阴极室溶液的质量增加
时,阴极室溶液的质量增加定义:

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】元素的性质与原子结构、元素在周期表中的位置有着密切的关系。回答下列问题:
(1)如图表示某短周期元素X的前五级电离能(I)的对数值,试推测并写出X的元素符号___ 。

(2)化合物甲与SO2所含元素种类相同,两者互为等电子体,请写出甲的化学式___ ,甲分子中心原子的杂化类型是___ 。
(3)配位化学创始人维尔纳发现,将1molCoC13·5NH3(紫红色)和1molCoC13•4NH3(绿色)溶于水,加入AgNO3溶液,立即沉淀的AgCl分别为2mol、1mol。则紫红色配合物中配离子的化学式为___ ,绿色配合物中Co的配位数为___ 。
(4)某稀土元素M的氧化物晶体为立方晶胞,其结构如图所示,图中小球代表氧离子,大球代表M离子。

①写出该氧化物的化学式___ 。
②已知该晶体密度为ρg·cm-3,晶胞参数为anm,NA为阿伏加 德罗常数的值。则M的相对原子质量Mr=___ (用含ρ、a等的代数式表示);
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1(M原子)的坐标为( ,
, ,
, ),则原子2(M原子)的坐标为
),则原子2(M原子)的坐标为___ 。
(1)如图表示某短周期元素X的前五级电离能(I)的对数值,试推测并写出X的元素符号

(2)化合物甲与SO2所含元素种类相同,两者互为等电子体,请写出甲的化学式
(3)配位化学创始人维尔纳发现,将1molCoC13·5NH3(紫红色)和1molCoC13•4NH3(绿色)溶于水,加入AgNO3溶液,立即沉淀的AgCl分别为2mol、1mol。则紫红色配合物中配离子的化学式为
(4)某稀土元素M的氧化物晶体为立方晶胞,其结构如图所示,图中小球代表氧离子,大球代表M离子。

①写出该氧化物的化学式
②已知该晶体密度为ρg·cm-3,晶胞参数为anm,NA为阿伏加 德罗常数的值。则M的相对原子质量Mr=
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1(M原子)的坐标为(
 ,
, ,
, ),则原子2(M原子)的坐标为
),则原子2(M原子)的坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B的氢化物形成六配位的配合物,有两个氯离子位于外界。
请根据以上情况,回答下列问题:【答题时,A、B、C、D、E用所对应的元素符号表示】
(1)A、B、C的第一电离能由小到大的顺序为____ 。
(2)B的氢化物的分子空间构型是____ 。
(3)写出AC2的电子式____ ;其中心原子采取____ 杂化。
(4)ECl3形成的配合物的化学式为____ ,1mol该配合物中σ键数目为____ mol。
(5)B的氢化物易液化的原因是____ 。
请根据以上情况,回答下列问题:【答题时,A、B、C、D、E用所对应的元素符号表示】
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子空间构型是
(3)写出AC2的电子式
(4)ECl3形成的配合物的化学式为
(5)B的氢化物易液化的原因是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】科学家对多种过渡金属元素进行深入的研究,在新能源、新材料研发,医疗等领域应用广泛。回答下列问题:
(1)铜元素位于周期表中____ 区,画出Fe3+离子能量最高的能级的电子排布图____ 。
(2)CO可以形成Ni(CO)4、Fe(CO)5等多种配合物,在提纯金属方面应用广泛。与CO互为等电子体的一种阴离子和一种单质分子的化学式分别为____ 、____ ;CO分子中σ键和π键的个数比为____ ,试比较C、O与N的第一电离能的大小____ 。
(3)PtCl2(NH3)2有如图两种平行四边形结构:

研究表明,图a分子用于抗癌药物,在图a中用箭头标出配位键____ 。解释分子b不溶于水的原因:____ 。其中配体NH3中心原子的杂化方式为____ 。
(4)铜和氧形成的一种离子化合物(氧的化合价为-2)是良好的半导体材料。晶胞结构如图所示:

铜离子的电荷数为____ ,其配位数为____ ,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中a原子和b原子坐标分别为(0,0,0)、( ,
, ,
, ),则c原子分数坐标为
),则c原子分数坐标为____ ,若晶体密度为dg/cm3,设NA为阿伏加德罗常数的值,则晶胞中阴阳离子最短距离为____ nm(列出计算式即可)。
(1)铜元素位于周期表中
(2)CO可以形成Ni(CO)4、Fe(CO)5等多种配合物,在提纯金属方面应用广泛。与CO互为等电子体的一种阴离子和一种单质分子的化学式分别为
(3)PtCl2(NH3)2有如图两种平行四边形结构:

研究表明,图a分子用于抗癌药物,在图a中用箭头标出配位键
(4)铜和氧形成的一种离子化合物(氧的化合价为-2)是良好的半导体材料。晶胞结构如图所示:

铜离子的电荷数为
 ,
, ,
, ),则c原子分数坐标为
),则c原子分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】在三元组分催化剂Cu/ZnO/ZrO2的催化作用下二氧化碳加氢可得甲醇,减少二氧化碳的排放,有利于实现碳减排从而实现碳中和。回答下列问题:
(1)上述物质所涉元素中位于d区的是___________ ,所涉非金属元素电负性最小的是___________ 。
(2)第一电离能:I1(Cu)___________ I1(Zn)(填“>”或“<”,下同);第二电离能:I2 (Zn)___________ I2(Cu),其理由是___________ 。
(3)CO2分子中心原子与氧原子形成___________ σ键。
(4)ZnO与强碱反应生成[Zn(OH)4]2-,[Zn(OH)4]2-中提供孤电子对的元素是___________ , 中心离子杂化轨道类型是sp3杂化,[Zn(OH)4]2-立体构型为___________ 。
(5)ZnO沸点为2360°C;二氧化碳的沸点为—78.5 °C,甲醇的沸点为64.7°C,三者沸点差异的原因是___________ 。
(6)由Cu和O组成的某晶胞结构如图,该氧化物的化学式为___________ ,若该晶体的密度为dg· cm-3,Cu和O的原子半径分别为bpm和q pm,阿伏加德罗常数值为NA,晶胞中原子的空间利用率为_____ (列出计算式即可)。

(1)上述物质所涉元素中位于d区的是
(2)第一电离能:I1(Cu)
(3)CO2分子中心原子与氧原子形成
(4)ZnO与强碱反应生成[Zn(OH)4]2-,[Zn(OH)4]2-中提供孤电子对的元素是
(5)ZnO沸点为2360°C;二氧化碳的沸点为—78.5 °C,甲醇的沸点为64.7°C,三者沸点差异的原因是
(6)由Cu和O组成的某晶胞结构如图,该氧化物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】硅铁合金广泛应用于冶金工业,可用于铸铁时的脱氧剂、添加剂等,回答下列问题:
(1)基态Fe原子价层电子的电子排布图为________ ,基态Si原子电子占据最高能级的电子云轮廓图为________ 形。
(2)绿帘石的组成为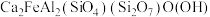 ,将其改写成氧化物的形式为
,将其改写成氧化物的形式为_____________ .
(3) 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为________ ,分子的立体构型为________ ;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________ 。
(4) 可与乙二胺(
可与乙二胺( ,简写为en)发生如下反应:
,简写为en)发生如下反应:
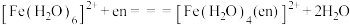 。
。 的中心离子的配位数为
的中心离子的配位数为________ ;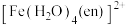 中的配位原子为
中的配位原子为________ 。
(5)在硅酸盐中, 四面体(图a)通过共用顶角氧离子可形成多种结构形式。图b为一种多硅酸根,其中Si原子的杂化形式为
四面体(图a)通过共用顶角氧离子可形成多种结构形式。图b为一种多硅酸根,其中Si原子的杂化形式为________ ,化学式为________________ 。
(1)基态Fe原子价层电子的电子排布图为
(2)绿帘石的组成为
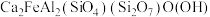 ,将其改写成氧化物的形式为
,将其改写成氧化物的形式为(3)
 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为 |  |  |  | |
| 熔点/K | 182.8 | 202.7 | 278.5 | 393.6 |
| 沸点/K | 177.4 | 330.1 | 408 | 460.6 |
(4)
 可与乙二胺(
可与乙二胺( ,简写为en)发生如下反应:
,简写为en)发生如下反应:
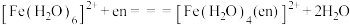 。
。 的中心离子的配位数为
的中心离子的配位数为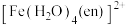 中的配位原子为
中的配位原子为(5)在硅酸盐中,
 四面体(图a)通过共用顶角氧离子可形成多种结构形式。图b为一种多硅酸根,其中Si原子的杂化形式为
四面体(图a)通过共用顶角氧离子可形成多种结构形式。图b为一种多硅酸根,其中Si原子的杂化形式为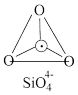  O· Si O· Si   |  |
| 图a | 图b |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为__________ ,N、O、S元素的原子对键合电子吸引力最大的是___________ 。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN−中含有的π键的数目为__________ 。与CN−互为等电子体的离子或分子有__________ (写出一种即可)。
(3)[Cu(NH3)4]2+中,提供孤对电子的是___________ 。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是___________ (填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是___________ 。(填“平面正方形”或“正四面体”)
(4)NH3中N原子的杂化方式是___________ ,硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为___________ 。
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是___________ 。若该晶体结构为长方体,其参数如图,阿伏加 德罗常数为NA,则该氧化物的密度为___________ g/cm3。
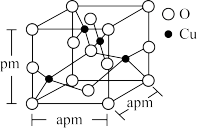
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN−中含有的π键的数目为
(3)[Cu(NH3)4]2+中,提供孤对电子的是
(4)NH3中N原子的杂化方式是
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】工业上常采用堆浸-反萃取-电积法从低品位锌矿(主要成分为ZnS,含有FeS2、CuS、NiS、SiO2等杂质)中获得锌,其流程如图1所示。
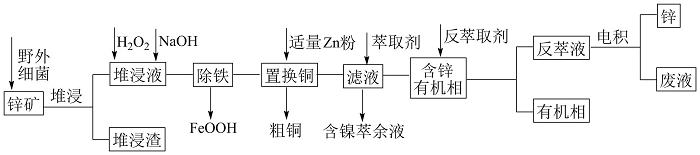
已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH过高时,氢氧化氧铁沉淀为胶状。
回答下列问题:
(1)“堆浸”时为了提高反应速率,可以采取的措施为___________ (填标号)。
a.大幅升温 b.将锌矿粉碎 c.将锌矿充分暴露
(2)“堆浸”时FeS2发生反应的化学方程式为___________ 。
(3)“除铁”时发生反应的总离子方程式为___________ 。“除铁”时,pH对不同金属离子沉淀率的影响如图2所示。“除铁”时最合理的pH约为___________ 。事实上Zn2+、Cu2+、Ni2+在pH≤6时难以沉淀,但是有铁离子存在时,pH升高,Zn2+、Cu2+、Ni2+的沉淀率均升高,原因可能为___________ 。

(4)“置换镍”时用锌粉直接置换速率极小,目前采用“锑盐净化法”置换,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为___________ 。已知Ni的熔点为1455℃,Sb的熔点为630.5℃,则该合金的熔点范围为___________ (填“高于1455℃”“在630.5℃和1455℃之间”或“低于630.5℃”)。
(5)电积时反萃取pH应控制在一定范围内,pH不能太高也不能太低,原因为___________ 。

已知:①“堆浸”时金属硫化物均转化为硫酸盐;②pH过高时,氢氧化氧铁沉淀为胶状。
回答下列问题:
(1)“堆浸”时为了提高反应速率,可以采取的措施为
a.大幅升温 b.将锌矿粉碎 c.将锌矿充分暴露
(2)“堆浸”时FeS2发生反应的化学方程式为
(3)“除铁”时发生反应的总离子方程式为

(4)“置换镍”时用锌粉直接置换速率极小,目前采用“锑盐净化法”置换,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,可得到合金NiSb,该反应的离子方程式为
(5)电积时反萃取pH应控制在一定范围内,pH不能太高也不能太低,原因为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】工业上常利用含硫废水生产Na2S2O3•5H2O,原理是S+Na2SO3 Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。
Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。
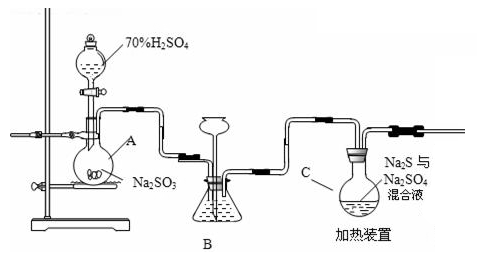
(1)仪器A中产生气体的化学方程式为______________________ 。
(2)装置B的作用是________________________________________ 。
(3)实验中,为使SO2缓慢进入装置C,采用的操作是____________________ ,装置C中制备反应结束的现象是_________________________________ 。
(4)装置C中的溶液,一般控制在碱性环境,否则产品发黄,用离子反应方程式表示其原因________________________________________________ ;为减少装置C中常可能出现的Na2SO4杂质,在不改变原有装置的基础上应采取的操作是___________________ ;反应结束后,过滤C中的混合物,滤液经________ (填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
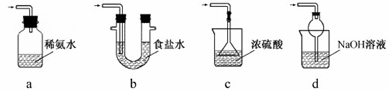
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______ (填序号)。
 Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。
Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。
(1)仪器A中产生气体的化学方程式为
(2)装置B的作用是
(3)实验中,为使SO2缓慢进入装置C,采用的操作是
(4)装置C中的溶液,一般控制在碱性环境,否则产品发黄,用离子反应方程式表示其原因
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
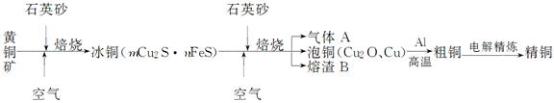
(1)气体A中的大气污染物可选用下列试剂中的________ 吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在________ (填离子符号),检验溶液中还存在Fe2+需要加入的试剂是___________ 。
(3)由泡铜冶炼粗铜的化学反应方程式为_________________ 。
(4)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_______________ 。

(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在
(3)由泡铜冶炼粗铜的化学反应方程式为
(4)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为
您最近一年使用:0次



