锂在电池领域的消费量最大,被称为“21世纪的能源金属”。
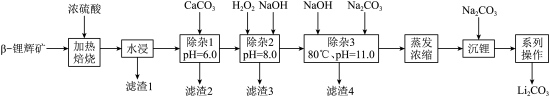
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
1.滤渣2的主要成分是_____ ,“除杂2”步骤中氧化剂和还原剂的理论物质的量之比是_____ 。
已知Li2CO3和CaCO3在不同温度下的Ksp:
2.“除杂3”步骤中,原溶液中Ca2+和Li+浓度分别为4.0×10-4mol·L-1和5.0mol·L-1.通过列式计算说明不损失Li+的情况下,Ca2+是否能除尽(工业离子除尽要求是浓度小于1.0×10-6mol·L-1)_____ 。
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为_____ 。
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.2 | 3.7 | 7.5 | 9.6 | 13.37 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 3.2 | 4.7 | 9.0 | 11.0 | — |
已知Li2CO3和CaCO3在不同温度下的Ksp:
| 20℃ | Ksp(Li2CO3)=2.5×10-2 | Ksp (CaCO3)=2.8×10-9 |
| 80℃ | Ksp (Li2CO3)=6.0×10-3 | Ksp (CaCO3)=4.0×10-9 |
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为
更新时间:2024-04-17 20:20:32
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氯及其化合物在化学生活中有广泛的应用。ClO2是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,其杀菌、漂白能力均优于Cl2,ClO2易与碱反应。
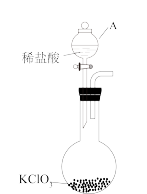
(1)某实验小组采用如图实验装置制取氯气,仪器A的名称为___________ ,写出利用该原理制备氯气的化学方程式:___________ 。其中氧化剂与还原剂的物质的量之比为:___________
(2)工业上可以用稍潮湿的KClO3与草酸(H2C2O4)在60℃时反应制取ClO2.某实验小组用如图所示装置制取并收集ClO2,回答下列问题:

①为了保证实验成功,对A装置进行的反应条件控制方式是___________ ;
②B装置要放置在冰水中,原因是___________ ;
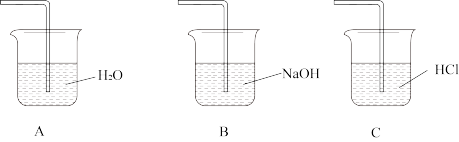
③从下图中选出最佳尾气吸收装置___________ 。
(3)亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,可利用ClO2与H2O2在氢氧化钠溶液中反应制得,此反应的氧化产物是___________ 。(写化学式)

(1)某实验小组采用如图实验装置制取氯气,仪器A的名称为
(2)工业上可以用稍潮湿的KClO3与草酸(H2C2O4)在60℃时反应制取ClO2.某实验小组用如图所示装置制取并收集ClO2,回答下列问题:

①为了保证实验成功,对A装置进行的反应条件控制方式是
②B装置要放置在冰水中,原因是
③从下图中选出最佳尾气吸收装置

(3)亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,可利用ClO2与H2O2在氢氧化钠溶液中反应制得,此反应的氧化产物是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】 可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以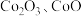 的形式存在,还含有
的形式存在,还含有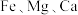 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: 常用作食品抗氧化剂。
常用作食品抗氧化剂。
②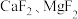 难溶于水。
难溶于水。
③部分金属阳离子形成氢氧化物沉淀的 如表所示:
如表所示:
回答下列问题:
(1)“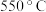 焙烧”的目的是
焙烧”的目的是__________________ 。
(2)“浸取”的过程中, 的主要作用是
的主要作用是__________________ (用离子方程式表示)。若用盐酸代替 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因__________________ 。
(3)“滤液1”中加入 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为_________ 。
(4)“滤渣2”的主要成分为_________ (填化学式)。
(5)已知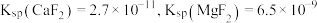 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中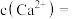
_________ (保留3位有效数字)。
(6)钴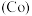 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的_________ 极(填“a”或“b”)。
②电解过程中Ⅱ室溶液 变小,则离子交换膜2为
变小,则离子交换膜2为_________ (填“阴”或“阳”)离子交换膜。
 可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以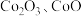 的形式存在,还含有
的形式存在,还含有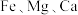 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: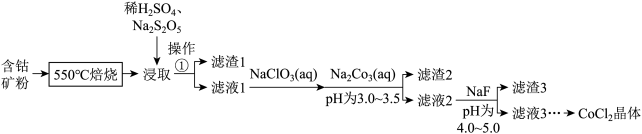
 常用作食品抗氧化剂。
常用作食品抗氧化剂。②
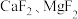 难溶于水。
难溶于水。③部分金属阳离子形成氢氧化物沉淀的
 如表所示:
如表所示:
|
|
|
|
| |
开始沉淀 | 0.3 | 2.7 | 7.2 | 7.6 | 9.6 |
完全沉淀 | 1.1 | 3.2 | 9.2 | 9.6 | 11.1 |
(1)“
 焙烧”的目的是
焙烧”的目的是(2)“浸取”的过程中,
 的主要作用是
的主要作用是 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因(3)“滤液1”中加入
 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为(4)“滤渣2”的主要成分为
(5)已知
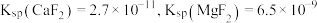 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中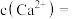
(6)钴
 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。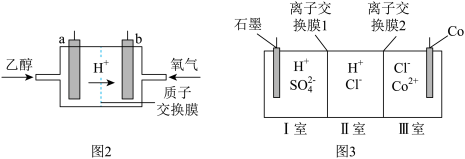
 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的②电解过程中Ⅱ室溶液
 变小,则离子交换膜2为
变小,则离子交换膜2为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】实验室制取氯气方法很多,通常有如下三种:
(1)用二氧化锰与浓盐酸共热制取氯气。如果将过量二氧化锰与20 mL 12 mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。产生该结果的主要原因是:①______________________________ ,②___________________________ 。
(2)高锰酸钾与浓盐酸反应可制取氯气,其反应的化学方程式为:_____________________________ 。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量为________ mol。
(3)现按如下操作进行有关氯气的制备及性质实验:在一片下衬白纸的圆形玻璃片上(如下图),A点滴一滴0.1 mol/L KI溶液(含淀粉溶液),B点滴一滴FeSO4(含KSCN)溶液,C点滴一滴NaOH(含酚酞)溶液,O点放少量KClO3晶体。向KClO3晶体滴加一滴浓盐酸,立即用表面皿盖好。试回答下列问题:

①A点反应的离子方程式为____________________________________ ;
②B点的现象为______________________________________________ ;
③C点的溶液由红色变为无色,是因为中和褪色还是漂白而褪色,请你设计实验证明之。____________________________________________________________________ 。
(1)用二氧化锰与浓盐酸共热制取氯气。如果将过量二氧化锰与20 mL 12 mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。产生该结果的主要原因是:①
(2)高锰酸钾与浓盐酸反应可制取氯气,其反应的化学方程式为:
(3)现按如下操作进行有关氯气的制备及性质实验:在一片下衬白纸的圆形玻璃片上(如下图),A点滴一滴0.1 mol/L KI溶液(含淀粉溶液),B点滴一滴FeSO4(含KSCN)溶液,C点滴一滴NaOH(含酚酞)溶液,O点放少量KClO3晶体。向KClO3晶体滴加一滴浓盐酸,立即用表面皿盖好。试回答下列问题:

①A点反应的离子方程式为
②B点的现象为
③C点的溶液由红色变为无色,是因为中和褪色还是漂白而褪色,请你设计实验证明之。
您最近一年使用:0次
【推荐1】废弃的锌猛干电池对环境污染很大,工业上可用如下工艺回收正极材料中的金属(部分条件未给出):
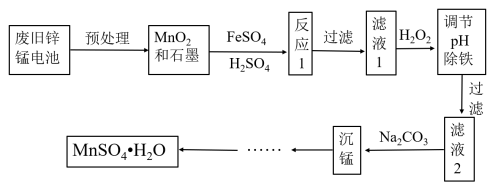
(1)MnO(OH)中Mn的化合价为______ ;实验室保存FeSO4溶液时为防止被氧化需加入______ ;实验室保存Fe2(SO4)3溶液时为抑制其水解应当加入______ ;原因为_______ 。(用必要的离子方程式和文字表示)
(2)加入H2O2的目的是将Fe2+氧化成Fe3+,则用离子方程式表示为________ 。
(3)该工艺流程中多次用到过滤,实验室中过滤所需要的玻璃仪器除烧杯外还有________ 。
(4)已知:25℃时,已知Ksp[Fe(OH)3]=1×10-38,当Fe3+浓度为1×10-5 mol·L-1时,认为Fe3+沉淀完全,滤液1中加入NaOH溶液至pH=_____ 时Fe3+沉淀完全。

(1)MnO(OH)中Mn的化合价为
(2)加入H2O2的目的是将Fe2+氧化成Fe3+,则用离子方程式表示为
(3)该工艺流程中多次用到过滤,实验室中过滤所需要的玻璃仪器除烧杯外还有
(4)已知:25℃时,已知Ksp[Fe(OH)3]=1×10-38,当Fe3+浓度为1×10-5 mol·L-1时,认为Fe3+沉淀完全,滤液1中加入NaOH溶液至pH=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】 钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

根据以上工艺流程图,回答下列问题:
(1)提高焙烧效率的方法有______________________________ 。(写任意一种即可)
(2) “焙烧”时MoS2转化为MoO3,该反应的氧化产物是________ 。
(3) “碱浸”时生成CO2的电子式为________ ,“碱浸”时含钼化合物发生的主要反应的离子方程式为____________________________ 。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为__________________ 。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO )=0.20 mol·L-1,c(SO
)=0.20 mol·L-1,c(SO )=0.01 mol·L-1。“结晶”前应先除去SO
)=0.01 mol·L-1。“结晶”前应先除去SO ,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO
,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO 的质量分数为
的质量分数为________ %。[已知Ksp(BaSO4)=1×10-10,Ksp(BaMoO4)=2.0×10-8]
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO 生成,该反应的离子方程式为
生成,该反应的离子方程式为__________________________ 。

根据以上工艺流程图,回答下列问题:
(1)提高焙烧效率的方法有
(2) “焙烧”时MoS2转化为MoO3,该反应的氧化产物是
(3) “碱浸”时生成CO2的电子式为
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为
(5)测得“除重金属离子”中部分离子的浓度:c(MoO
 )=0.20 mol·L-1,c(SO
)=0.20 mol·L-1,c(SO )=0.01 mol·L-1。“结晶”前应先除去SO
)=0.01 mol·L-1。“结晶”前应先除去SO ,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO
,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO 的质量分数为
的质量分数为(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO
 生成,该反应的离子方程式为
生成,该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为 ,含少量
,含少量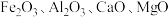 、碳及有机物)制取
、碳及有机物)制取 的工艺流程如图所示:
的工艺流程如图所示: 。
。
(1)“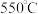 焙烧”的目的是
焙烧”的目的是_______ ,提高焙烧速率的措施有_______ 。
(2)“碱浸”过程中发生反应的离子方程式是_______ 。
(3)基态 原子的价电子排布式是
原子的价电子排布式是_______ ;“钴浸出”过程中,不能用盐酸代替硫酸,原因是_______ 。
(4)“净化除杂1”过程中,先在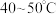 加入
加入 的作用是
的作用是_______ ;再升温至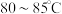 ,加入
,加入 溶液,调
溶液,调 至4.5沉铁,该反应的离子方程式为
至4.5沉铁,该反应的离子方程式为_______ 。
(5)“净化除杂2”过程中,加入 以除去原溶液中的
以除去原溶液中的 (浓度为
(浓度为 )和
)和 ,若控制溶液中
,若控制溶液中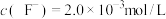 ,则
,则 的去除率准确值为
的去除率准确值为_______ 。[已知某温度下,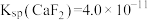 ]
]
 ,含少量
,含少量 、碳及有机物)制取
、碳及有机物)制取 的工艺流程如图所示:
的工艺流程如图所示: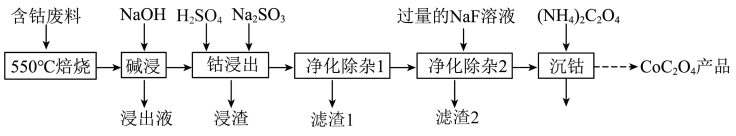
 。
。(1)“
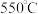 焙烧”的目的是
焙烧”的目的是(2)“碱浸”过程中发生反应的离子方程式是
(3)基态
 原子的价电子排布式是
原子的价电子排布式是(4)“净化除杂1”过程中,先在
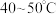 加入
加入 的作用是
的作用是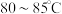 ,加入
,加入 溶液,调
溶液,调 至4.5沉铁,该反应的离子方程式为
至4.5沉铁,该反应的离子方程式为(5)“净化除杂2”过程中,加入
 以除去原溶液中的
以除去原溶液中的 (浓度为
(浓度为 )和
)和 ,若控制溶液中
,若控制溶液中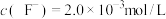 ,则
,则 的去除率准确值为
的去除率准确值为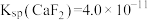 ]
]
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】Ⅰ.甲同学用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)并测量其结晶水含量。已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。制取流程如下:

请回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为________ (填编号)。
①KMnO4 ②K3[Fe(CN)6] ③NaOH ④KSCN
(2)试剂①是________ ,试剂②是________ 。(填化学式)
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:
称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得黑色固体的质量为n g。沉淀洗涤的操作方法是________ ,根据实验数据测得x=________ (用含m、n的代数式表示)。
Ⅱ.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。

(4)所选仪器接口的连接顺序是A接________ ,________接________;B接________,________接________。
(5)若装入的饱和食盐水为75 mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4 mL(已转换成标准状况下的体积)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为________ 。

请回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为
①KMnO4 ②K3[Fe(CN)6] ③NaOH ④KSCN
(2)试剂①是
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:
称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得黑色固体的质量为n g。沉淀洗涤的操作方法是
Ⅱ.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。

(4)所选仪器接口的连接顺序是A接
(5)若装入的饱和食盐水为75 mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4 mL(已转换成标准状况下的体积)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】“一酸两浸,两碱联合”法是实现粉煤灰(含SiO2、Al2O3、Fe2O3、CaO、MgO等)综合利用的新工艺。工业流程如图:

回答下列问题:
(1)聚合氯化铝铁(PAFC)化学式为[Al2(OH)nCl6-n]m•[Fe2(OH)xCl6-x]y,是一种新型高效的净水剂,PAFC中铁元素的化合价为____ 。
(2)实际工业做酸浸”、“碱浸”均不能充分反应,滤渣A中主要含有SiO2、Al2O3。“纯碱混合焙烧”中,它们分别发生反应的化学方程式为____ 、___ 。
(3)“滤液B”的主要溶质有___ (填化学式)。滤液混合后“蒸发"的作用是___ 。
(4)为测定粗盐溶液中Ca2+的质量分数,用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Ca2++H2Y2-=CaY2-+H2+。测定前,先称取10.0g粗盐配成30mL溶液,然后采用沉淀等措施除去Mg2+等干扰性杂质,取清液,用0.0500mol·L-1的EDTA标准溶液滴定至终点。平行测定三次,分别消耗EDTA标准溶液24.50mL、25.50mL、20.50mL,则测得粗盐溶液中Ca2+的质量分数是___ (以质量百分比表示)。
(5)以“氯碱工业”阴极所得溶液为电解质溶液,制作出电池式氧传感器,其原理构造如图。该装置可测定O2的含量,工作时铅极表面会逐渐附着Pb(OH)2。Pt电极上发生___ (填“氧化”或“还原”)反应,Pb电极反应方程式是___ 。随着该传感器的使用,电解质溶液的pH会__ (填“升高”或“降低”)。


回答下列问题:
(1)聚合氯化铝铁(PAFC)化学式为[Al2(OH)nCl6-n]m•[Fe2(OH)xCl6-x]y,是一种新型高效的净水剂,PAFC中铁元素的化合价为
(2)实际工业做酸浸”、“碱浸”均不能充分反应,滤渣A中主要含有SiO2、Al2O3。“纯碱混合焙烧”中,它们分别发生反应的化学方程式为
(3)“滤液B”的主要溶质有
(4)为测定粗盐溶液中Ca2+的质量分数,用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Ca2++H2Y2-=CaY2-+H2+。测定前,先称取10.0g粗盐配成30mL溶液,然后采用沉淀等措施除去Mg2+等干扰性杂质,取清液,用0.0500mol·L-1的EDTA标准溶液滴定至终点。平行测定三次,分别消耗EDTA标准溶液24.50mL、25.50mL、20.50mL,则测得粗盐溶液中Ca2+的质量分数是
(5)以“氯碱工业”阴极所得溶液为电解质溶液,制作出电池式氧传感器,其原理构造如图。该装置可测定O2的含量,工作时铅极表面会逐渐附着Pb(OH)2。Pt电极上发生

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】从粗产品硫酸锌固体除去铁、铜、镉等可溶性硫酸盐,从而得到纯净的硫酸锌,实验流程如下:

部分阳离子以氢氧化物形式完全沉淀时溶液的pH参见下表,请回答下列问题:
(1)“酸浸”步骤中,为提高锌的浸出率,可采取的措施有_______ 。“酸浸”时适当补充少量水的原因是_______ 。
(2)滤液I加入酸性KMnO4所发生反应的离子方程式为_______ 。加入ZnO的原因是_______ 。
(3)滤渣III的成份主要是_______ 。
(4)从滤液III得到晶体的操作过程为_______ 、冷却结晶、过滤洗涤、小心干燥。

部分阳离子以氢氧化物形式完全沉淀时溶液的pH参见下表,请回答下列问题:
| 沉淀物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Cd(OH)2 | Mn(OH)2 |
| pH | 8.0 | 9.7 | 3.2 | 6.7 | 9.4 | 10.4 |
(2)滤液I加入酸性KMnO4所发生反应的离子方程式为
(3)滤渣III的成份主要是
(4)从滤液III得到晶体的操作过程为
您最近一年使用:0次






