解题方法
1 . 写出下列反应的方程式
(1)硫代硫酸钠与稀盐酸混合,生成有刺激性气味的气体_______
(2)氯酸钾、硫酸锰与氢氧化钾共熔,生成绿色物质_______
(3)在重铬酸钾溶液中加入少量银离子,生成砖红色沉淀_______
(4)金溶解在王水中_______
(1)硫代硫酸钠与稀盐酸混合,生成有刺激性气味的气体
(2)氯酸钾、硫酸锰与氢氧化钾共熔,生成绿色物质
(3)在重铬酸钾溶液中加入少量银离子,生成砖红色沉淀
(4)金溶解在王水中
您最近一年使用:0次
解题方法
2 . 钢中加入微量钒可起到脱氧和脱氮的作用,改善钢的性能。测定钢中钒含量的步骤如下:钢试样用硫磷混合酸分解,钒以四价形式存在。再用KMnO4将其氧化为五价,过量的KMnO4用NaNO2除去,过量的NaNO2用尿素除去。五价钒与N-苯甲酰-N-苯基羟胺在3.5 mol/L~5 mol/L盐酸介质中以1:2形成紫红色单核电中性配合物,比色测定。
回答如下问题:
(1)高价钒在酸性溶液中通常以含氧阳离子的形式存在。写出钒与浓硫酸作用的反应方程式_________ 。
(2)以反应方程式表示上述测定过程中KMnO4、NaNO2和尿素的作用_________ 。
(3)写出紫红色配合物的结构式_________ 。
回答如下问题:
(1)高价钒在酸性溶液中通常以含氧阳离子的形式存在。写出钒与浓硫酸作用的反应方程式
(2)以反应方程式表示上述测定过程中KMnO4、NaNO2和尿素的作用
(3)写出紫红色配合物的结构式
您最近一年使用:0次
解题方法
3 . 化合物A俗称“吊白块”,年产量上万吨,主要用于染色工艺,具还原性和漂白性,对热不稳定,有毒。近年报道,我国一些不法商人违章地将A添加到米、面、腐竹、食糖等食品中增白,导致多起严重食物中毒事件,如某地曾发生五所学校400余名学生食用含A食品一次性中毒事件。
已知:固体A·2H2O的摩尔质量为154g/mol;
①A的晶体结构及其水溶液的电导证实A是钠盐,每摩尔A含1摩尔钠离子。
②A在水中的溶解度极大,20℃饱和溶液A的质量分数达45%。
③A的制备方法之一是,在NaOH溶液中分甲醛与Na2S2O4(连二亚硫酸钠)反应(摩尔比1:1),反应产物为A和亚硫酸钠。
④A在化学上属于亚磺酸的衍生物,亚磺酸的通式为RSO2H,R为有机基团。
(1)画出A的阴离子的结构(简)式___________ 。
(2)写出上述制备A的“分子方程式”_____________ 。
(3)给出A的化学名称_______________ 。
已知:固体A·2H2O的摩尔质量为154g/mol;
①A的晶体结构及其水溶液的电导证实A是钠盐,每摩尔A含1摩尔钠离子。
②A在水中的溶解度极大,20℃饱和溶液A的质量分数达45%。
③A的制备方法之一是,在NaOH溶液中分甲醛与Na2S2O4(连二亚硫酸钠)反应(摩尔比1:1),反应产物为A和亚硫酸钠。
④A在化学上属于亚磺酸的衍生物,亚磺酸的通式为RSO2H,R为有机基团。
(1)画出A的阴离子的结构(简)式
(2)写出上述制备A的“分子方程式”
(3)给出A的化学名称
您最近一年使用:0次
20-21高三上·浙江绍兴·期中
解题方法
4 . I.由三种元素组成的化合物A,其相对分子质量小于200,按如下流程进行实验。气体B为红棕色混合物,气体D能使带火星的木条复燃,溶液E为蓝色,固体C为混合物,固体F为紫红色。
(1)组成A的三种元素是_______ 。(填元素符号),A的化学式是________ 。
(2)固体A加热分解的化学方程式是________ 。
(3)若固体G的组成与A类似,且隔绝空气加热后红棕色气体与带火星木条复燃气体的物质的量为8:1,该反应的化学方程式是。___________ 。
II.某兴趣小组为制取并验证二氧化硫的性质进行相关实验,实验装置如图所示。请回答:___________ 。
(2)写出烧杯中过量的NaClO溶液吸收SO2的离子反应方程式___________ 。

(1)组成A的三种元素是
(2)固体A加热分解的化学方程式是
(3)若固体G的组成与A类似,且隔绝空气加热后红棕色气体与带火星木条复燃气体的物质的量为8:1,该反应的化学方程式是。
II.某兴趣小组为制取并验证二氧化硫的性质进行相关实验,实验装置如图所示。请回答:
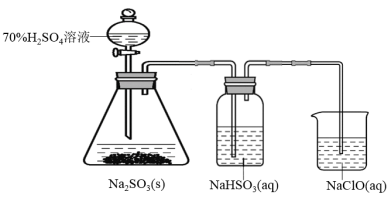
(2)写出烧杯中过量的NaClO溶液吸收SO2的离子反应方程式
您最近一年使用:0次
名校
解题方法
5 . 2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢(HCN)气体。氰化氢的沸点只有26 ℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题:
(1)写出氰化钠遇水产生氰化氢气体的离子方程式_________________________
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式________________________________ 。
(3)爆炸残留在废水中的CN-可以用Cr2O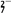 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
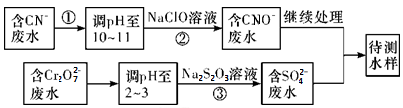
①上述处理废水流程中主要使用的方法是____________
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为_________________ ;
③步骤③中,每处理0.4 mol Cr2O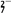 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式_________ ;
(1)写出氰化钠遇水产生氰化氢气体的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式
(3)爆炸残留在废水中的CN-可以用Cr2O
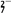 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
①上述处理废水流程中主要使用的方法是
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为
③步骤③中,每处理0.4 mol Cr2O
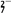 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式
您最近一年使用:0次
2017-12-13更新
|
623次组卷
|
2卷引用:湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题
解题方法
6 . 铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要____________________ 。
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________ 。此液体具有的性质是 _______ (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b. 将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是_________ (填化学式)。写出以上过程中涉及到的化学反应方程式,如果是离子反应,用离子反应方程式表示_________ 。
(4)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为______________________ 。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
______ Cu2S+______ Fe3++____ H2O
_____ Cu2++______ Fe2++______ ( ) +______ SO42- 。
(5)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是_____________________ 。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是
a.光束通过该液体时形成光亮的“通路”
b. 将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是
(4)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:

(5)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是
您最近一年使用:0次
2016-12-09更新
|
808次组卷
|
2卷引用:2016届山东省邹城市第一中学高三上学期10月月考化学试卷



