名校
解题方法
1 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_________ (填序号)。
甲. 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_________ ;②加入_________ 。
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_________ 。
(4)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等物质的量的四种氧化剂分别与足量 作用,得到
作用,得到 最多的是
最多的是___________ 。
(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为 ),可用如图转化方式除去。
),可用如图转化方式除去。
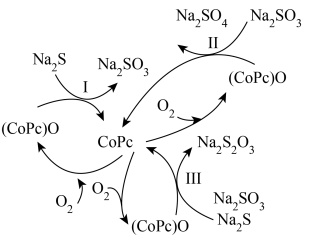
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为___________ 。
②在废水处理整个过程中,催化剂为___________ ,氧化剂为___________ 。
③反应Ⅲ中 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式_________________ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
电位值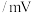 | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
甲.
 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于
 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为
 ),可用如图转化方式除去。
),可用如图转化方式除去。
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为
②在废水处理整个过程中,催化剂为
③反应Ⅲ中
 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式
您最近半年使用:0次
2023-12-04更新
|
374次组卷
|
2卷引用:山东省青岛市莱西市2023-2024学年高一上学期11月期中考试化学试题
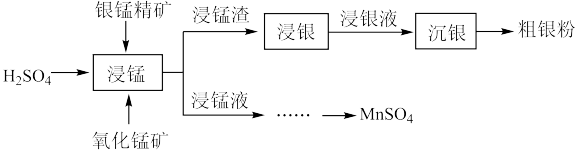
2 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:I.酸性条件下, 的氧化性强于
的氧化性强于 ;Ⅱ.
;Ⅱ. 。
。
(1)“浸锰”过程中, 溶液可浸出矿石中的锰元素,同时去除
溶液可浸出矿石中的锰元素,同时去除 ,有利于后续银的浸出,使矿石中的银以
,有利于后续银的浸出,使矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
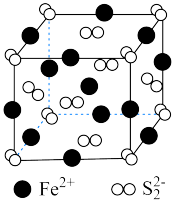
① 晶胞如图所示,阴、阳离子的个数比为
晶胞如图所示,阴、阳离子的个数比为___________ 。
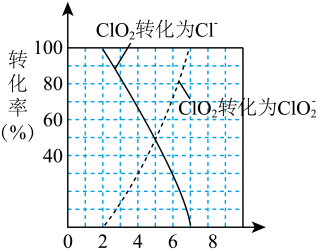
②锰元素浸出时,发生反应: ,其平衡常数K与
,其平衡常数K与 、
、 、
、 的代数关系式为
的代数关系式为
___________ 。
③去除 时,
时, 与
与 转化为铁盐和硫酸盐,则发生反应的离子方程式为
转化为铁盐和硫酸盐,则发生反应的离子方程式为___________ 。
(2)“浸银”过程中,使用过量 、HCl和
、HCl和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出,反应为
形式浸出,反应为 。结合平衡移动原理,分析浸出剂中
。结合平衡移动原理,分析浸出剂中 和
和 的作用为
的作用为___________ 。
(3)“沉银”过程中,需要加入过量的铁粉。
①使用过量的铁粉的作用是___________ 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。amin后,Ag的沉淀率逐渐减小的原因是___________ 。

 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:I.酸性条件下,
 的氧化性强于
的氧化性强于 ;Ⅱ.
;Ⅱ. 。
。(1)“浸锰”过程中,
 溶液可浸出矿石中的锰元素,同时去除
溶液可浸出矿石中的锰元素,同时去除 ,有利于后续银的浸出,使矿石中的银以
,有利于后续银的浸出,使矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①
 晶胞如图所示,阴、阳离子的个数比为
晶胞如图所示,阴、阳离子的个数比为
②锰元素浸出时,发生反应:
 ,其平衡常数K与
,其平衡常数K与 、
、 、
、 的代数关系式为
的代数关系式为
③去除
 时,
时, 与
与 转化为铁盐和硫酸盐,则发生反应的离子方程式为
转化为铁盐和硫酸盐,则发生反应的离子方程式为(2)“浸银”过程中,使用过量
 、HCl和
、HCl和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出,反应为
形式浸出,反应为 。结合平衡移动原理,分析浸出剂中
。结合平衡移动原理,分析浸出剂中 和
和 的作用为
的作用为(3)“沉银”过程中,需要加入过量的铁粉。
①使用过量的铁粉的作用是
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。amin后,Ag的沉淀率逐渐减小的原因是

您最近半年使用:0次
名校
解题方法
3 . 虽然化学反应分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系,回答下列问题:
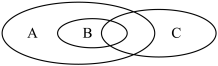
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是______ (填字母)。
(2)配平化学方程式,并用单线桥法标出电子转移方向和数目________ 。
______H2O+_____Fe(NO3)3+_____SO2=___FeSO4+_____N2O+_____H2SO4
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是_______ (填写化学式)。
(4)配平化学方程式(化学计量数可含x)________ 。
_____Na2Sx+______NaClO+______NaOH=____Na2SO4+_____NaCl+_____H2O
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(2)配平化学方程式,并用单线桥法标出电子转移方向和数目
______H2O+_____Fe(NO3)3+_____SO2=___FeSO4+_____N2O+_____H2SO4
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是
(4)配平化学方程式(化学计量数可含x)
_____Na2Sx+______NaClO+______NaOH=____Na2SO4+_____NaCl+_____H2O
您最近半年使用:0次
解题方法
4 . 以 固体为原料制备纯
固体为原料制备纯 ,其部分实验过程如下:
,其部分实验过程如下:

已知:① ;
;
② ,
, 有两性,
有两性, ;
;
③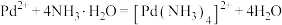 ,
,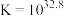 。
。
(1) 为二元强酸,写出“氧化”时发生的主要反应的离子方程式:
为二元强酸,写出“氧化”时发生的主要反应的离子方程式:___________ 。
(2)“氧化”时易产生一种有毒气体,该气体的化学式为___________ 。
(3)若“氧化”不充分,“沉钯”时所得 的产率降低,其原因是
的产率降低,其原因是___________ ;氧化液中Pd的浓度一定,为提高 的产率,“沉钯”时需控制的条件有反应的温度、
的产率,“沉钯”时需控制的条件有反应的温度、___________ 。
(4)CO可将 溶液还原得到金属Pd,写出反应的化学方程式:
溶液还原得到金属Pd,写出反应的化学方程式:___________ 。标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为 ,Pd的相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式:
,Pd的相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式:___________ 。若用 代替CO进行热还原,消耗
代替CO进行热还原,消耗 的质量比理论值略高,其原因是
的质量比理论值略高,其原因是___________ 。
 固体为原料制备纯
固体为原料制备纯 ,其部分实验过程如下:
,其部分实验过程如下:
已知:①
 ;
;②
 ,
, 有两性,
有两性, ;
;③
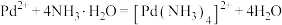 ,
,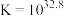 。
。(1)
 为二元强酸,写出“氧化”时发生的主要反应的离子方程式:
为二元强酸,写出“氧化”时发生的主要反应的离子方程式:(2)“氧化”时易产生一种有毒气体,该气体的化学式为
(3)若“氧化”不充分,“沉钯”时所得
 的产率降低,其原因是
的产率降低,其原因是 的产率,“沉钯”时需控制的条件有反应的温度、
的产率,“沉钯”时需控制的条件有反应的温度、(4)CO可将
 溶液还原得到金属Pd,写出反应的化学方程式:
溶液还原得到金属Pd,写出反应的化学方程式: ,Pd的相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式:
,Pd的相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式: 代替CO进行热还原,消耗
代替CO进行热还原,消耗 的质量比理论值略高,其原因是
的质量比理论值略高,其原因是
您最近半年使用:0次
名校
解题方法
5 . 化学让生活更美好,各类水处理剂能让水质得到提升达到饮用水的标准。生活中较常见的水处理剂有:氯气、次氯酸钠、漂白粉(主要成分为次氯酸钙)、二氧化氯、明矾、硫酸铁、高铁酸钠等等。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:___________ 。
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:___________ 。
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
(4)近年来有科学家提出,氯气消毒时,会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此,人们已开始研究并试用新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。ClO2被世界卫生组织(WHO)列为A级高效、安全灭菌消毒剂,将逐渐取代Cl2成为自来水的消毒剂。ClO2气体具有强氧化性,其还原产物ClO 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:___________ 。某工厂污水中含CN﹣amg/L,现用ClO2将CN﹣氧化,生成了两种无毒无害的气体,处理50m3这种污水,至少需要ClO2___________ mol。
(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是___________ 。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
| A.将自来水煮沸烧开后再饮用更健康、因为能除去残留的Cl2及溶于其中的Cl﹣ |
| B.自来水用于洗涤后得到的含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中 |
| C.煤、石油的燃烧和汽车排放的尾气都会引起大气污染,且会出现酸雨等环境问题 |
| D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 |
 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是

您最近半年使用:0次
名校
6 . 具有十八面体结构的 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
I.配位-沉淀法制备 高效光催化剂
高效光催化剂

已知:ⅰ. 难溶于水,可溶于硝酸;
难溶于水,可溶于硝酸;
ⅱ. 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
ⅲ.银氨溶液中存在: 。
。
(1)配制银氨溶液时的反应现象是_______ 。
(2)加入 制备
制备 的离子反应方程式是
的离子反应方程式是_______ 。
(3) 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因:
固体光催化性能极差。从速率角度解释其原因:_______ 。
Ⅱ. 光催化剂的使用和再生
光催化剂的使用和再生
已知: 晶体在光照条件下发挥催化作用时,首先引发以下反应。
晶体在光照条件下发挥催化作用时,首先引发以下反应。
a.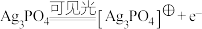
(4) 光催化
光催化 制备甲醇可实现“碳中和”,a的后续反应如下。
制备甲醇可实现“碳中和”,a的后续反应如下。
 ,
,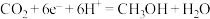
则由 制备甲醇的总反应的化学方程式为
制备甲醇的总反应的化学方程式为_______ 。
(5) 光催化降解
光催化降解 (代表有机污染物),
(代表有机污染物), 被氧化成
被氧化成 和
和 。a的后续反应如下。
。a的后续反应如下。
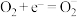 ,
,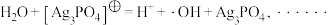
注: 在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
用 依次降解三份相同的废水,测得3次降解过程中
依次降解三份相同的废水,测得3次降解过程中 的残留率(
的残留率(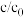 ,即时浓度与起始浓度之比)随时间变化的曲线如图。
,即时浓度与起始浓度之比)随时间变化的曲线如图。

①下列说法正确的是_______ (填字母序号)。
a. 和
和 是降解
是降解 的重要氧化剂
的重要氧化剂
b.第1次使用后 的光催化性能降低
的光催化性能降低
c.该实验条件下, 使用两次即基本失效
使用两次即基本失效
②第1次光降解时, 内的反应速率为
内的反应速率为_______  。(废水中
。(废水中 初始浓度
初始浓度 为
为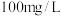 ,
, 的摩尔质量为
的摩尔质量为 )
)
 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。I.配位-沉淀法制备
 高效光催化剂
高效光催化剂
已知:ⅰ.
 难溶于水,可溶于硝酸;
难溶于水,可溶于硝酸;ⅱ.
 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;ⅲ.银氨溶液中存在:
 。
。(1)配制银氨溶液时的反应现象是
(2)加入
 制备
制备 的离子反应方程式是
的离子反应方程式是(3)
 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因:
固体光催化性能极差。从速率角度解释其原因:Ⅱ.
 光催化剂的使用和再生
光催化剂的使用和再生已知:
 晶体在光照条件下发挥催化作用时,首先引发以下反应。
晶体在光照条件下发挥催化作用时,首先引发以下反应。a.
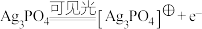
(4)
 光催化
光催化 制备甲醇可实现“碳中和”,a的后续反应如下。
制备甲醇可实现“碳中和”,a的后续反应如下。 ,
,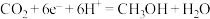
则由
 制备甲醇的总反应的化学方程式为
制备甲醇的总反应的化学方程式为(5)
 光催化降解
光催化降解 (代表有机污染物),
(代表有机污染物), 被氧化成
被氧化成 和
和 。a的后续反应如下。
。a的后续反应如下。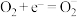 ,
,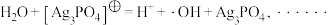
注:
 在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。用
 依次降解三份相同的废水,测得3次降解过程中
依次降解三份相同的废水,测得3次降解过程中 的残留率(
的残留率(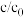 ,即时浓度与起始浓度之比)随时间变化的曲线如图。
,即时浓度与起始浓度之比)随时间变化的曲线如图。
①下列说法正确的是
a.
 和
和 是降解
是降解 的重要氧化剂
的重要氧化剂b.第1次使用后
 的光催化性能降低
的光催化性能降低c.该实验条件下,
 使用两次即基本失效
使用两次即基本失效②第1次光降解时,
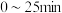 内的反应速率为
内的反应速率为 。(废水中
。(废水中 初始浓度
初始浓度 为
为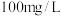 ,
, 的摩尔质量为
的摩尔质量为 )
)
您最近半年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
7 . 化学一直都在发展……
①利用非水体系中的化学反应,可以用来制备无水盐,工业上原来制备无水硝酸铜的过程如下(步骤I得到的是硝酸铜溶液),据此回答:
CuO Cu(NO3)2
Cu(NO3)2 Cu(NO3)2·n H2O
Cu(NO3)2·n H2O Cu(NO3)2(无水)
Cu(NO3)2(无水)
已知:步骤III的气体产物仅有两种,均呈酸性,其中一种分子量为64
(1)步骤I中加入的物质1(aq)为_______ (填写化学式),步骤III中加入SOCl2的作用是_______ ,写出步骤III发生的化学反应的化学方程式_______ 。
(2)已知若步骤III中不加入SOCl2,直接加热含结晶水的硝酸铜,会生成碱式硝酸铜[Cu(NO3)2·3Cu(OH)2],其原因是硝酸铜发生了_______ (填反应类型),其反应的化学方程式为_______ 。
②现如今化学家们发明了另一种制备方法:
Cu(s) Cu(NO3)2·n N2O4
Cu(NO3)2·n N2O4 Cu(NO3)2
Cu(NO3)2
已知:在液态N2O4中存在一下自耦电离平衡:N2O4 NO++
NO++ ,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
(3)试写出步骤I与步骤II的方程式:步骤I_______ ;步骤II_______ 。
(4)该反应的优点(写出一条即可):_______ 。
①利用非水体系中的化学反应,可以用来制备无水盐,工业上原来制备无水硝酸铜的过程如下(步骤I得到的是硝酸铜溶液),据此回答:
CuO
 Cu(NO3)2
Cu(NO3)2 Cu(NO3)2·n H2O
Cu(NO3)2·n H2O Cu(NO3)2(无水)
Cu(NO3)2(无水)已知:步骤III的气体产物仅有两种,均呈酸性,其中一种分子量为64
(1)步骤I中加入的物质1(aq)为
(2)已知若步骤III中不加入SOCl2,直接加热含结晶水的硝酸铜,会生成碱式硝酸铜[Cu(NO3)2·3Cu(OH)2],其原因是硝酸铜发生了
②现如今化学家们发明了另一种制备方法:
Cu(s)
 Cu(NO3)2·n N2O4
Cu(NO3)2·n N2O4 Cu(NO3)2
Cu(NO3)2已知:在液态N2O4中存在一下自耦电离平衡:N2O4
 NO++
NO++ ,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分
,步骤I,II均放出有毒气体,两者均为汽车尾气的主要成分(3)试写出步骤I与步骤II的方程式:步骤I
(4)该反应的优点(写出一条即可):
您最近半年使用:0次
名校
8 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:

回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为___________ 。
(2)滤渣I的主要成分是___________ (填化学式)。
(3)工序③中发生反应的离子方程式为___________ 。
(4)热解工序产生的混合气体最适宜返回工序___________ (填“①”或“②”或“③”或“④”)参与内循环。
(5)工序③也可以利用电解法制 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的___________ 极相连,制备 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重___________ g。
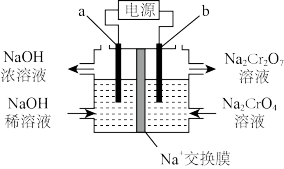
(6)工序④溶液中的铝元素恰好完全转化为沉淀的 为
为___________ 。(通常认为溶液中离子浓度等于 为恰好沉淀完全;已知
为恰好沉淀完全;已知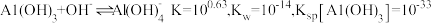 )
)
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)热解工序产生的混合气体最适宜返回工序
(5)工序③也可以利用电解法制
 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的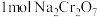 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重
(6)工序④溶液中的铝元素恰好完全转化为沉淀的
 为
为 为恰好沉淀完全;已知
为恰好沉淀完全;已知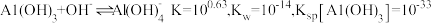 )
)
您最近半年使用:0次
名校
解题方法
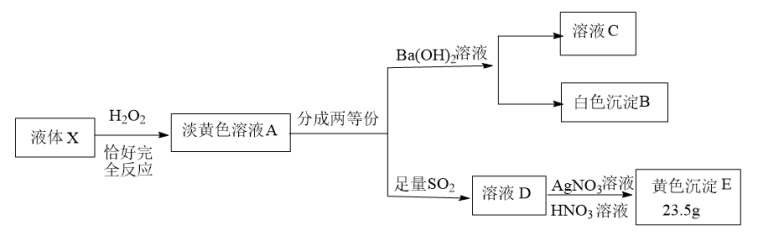
9 . X由4种元素组成的化合物,按如下流程进行实验。已知:液体X被H2O2氧化的过程中转移电子数为1.8NA。当加入适量Ba(OH)2溶液时,使溶液C成中性(不考虑盐类水解的影响),产生81.55g沉淀B,继续滴加过量Ba(OH)2溶液,沉淀B增加至93.2g;溶液C焰色反应透过蓝色钴玻璃观察火焰呈紫色。
请回答:
(1)X组成元素:O和___________ (元素符号),化学式___________ ;
(2)写出X和双氧水反应的化学方程式___________ ;
(3)写出SO2和淡黄色溶液A反应的离子方程式___________ ;
(4)实验中溶液A呈淡黄色原因是含有某种物质,简述如何从溶液A中分离出该物质:___________ 。

请回答:
(1)X组成元素:O和
(2)写出X和双氧水反应的化学方程式
(3)写出SO2和淡黄色溶液A反应的离子方程式
(4)实验中溶液A呈淡黄色原因是含有某种物质,简述如何从溶液A中分离出该物质:
您最近半年使用:0次
2021-11-03更新
|
584次组卷
|
2卷引用:浙江省诸暨市2020-2021学年高二下学期期末考试化学试题
解题方法
10 . 卡尔-费休(Karl-Fischer) 法是测定有机溶剂中的微量水含量的经典方法。所用试剂由碘、二氧化硫、吡啶(C5H5N,有机碱,与H+反应生成C5H5NH+)和无水甲醇按一定比例配制而成。该试剂与待测溶剂中的水反应后,产物的含量用库仑滴定法来测定。
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为___________ 。
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是___________ 。
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:___________ 。。
(4)测定20.0 mL有机溶剂含水量____ 。库仑滴定时,以24.8 mA恒定电流通电302s时达到反应终点(电极反应: 2I-- 2e = I2)。求该有机溶剂的含水量(mg·L-1) ____ 。已知: 1 mol电子的电量为9.65× 104C,电量计算公式Q=It
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:
(4)测定20.0 mL有机溶剂含水量
您最近半年使用:0次



