化学让生活更美好,各类水处理剂能让水质得到提升达到饮用水的标准。生活中较常见的水处理剂有:氯气、次氯酸钠、漂白粉(主要成分为次氯酸钙)、二氧化氯、明矾、硫酸铁、高铁酸钠等等。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:___________ 。
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:___________ 。
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
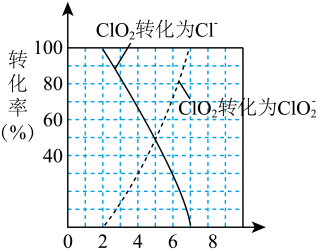
(4)近年来有科学家提出,氯气消毒时,会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此,人们已开始研究并试用新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。ClO2被世界卫生组织(WHO)列为A级高效、安全灭菌消毒剂,将逐渐取代Cl2成为自来水的消毒剂。ClO2气体具有强氧化性,其还原产物ClO 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:___________ 。某工厂污水中含CN﹣amg/L,现用ClO2将CN﹣氧化,生成了两种无毒无害的气体,处理50m3这种污水,至少需要ClO2___________ mol。
(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是___________ 。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
| A.将自来水煮沸烧开后再饮用更健康、因为能除去残留的Cl2及溶于其中的Cl﹣ |
| B.自来水用于洗涤后得到的含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中 |
| C.煤、石油的燃烧和汽车排放的尾气都会引起大气污染,且会出现酸雨等环境问题 |
| D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 |
 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是

更新时间:2023-03-22 10:43:48
|
相似题推荐
填空题
|
困难
(0.15)
【推荐1】亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液pH
用pH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是__________ (用离子方程式解释),NaNO2溶液中c(HNO2)=__________ (用溶液中其它离子的浓度关系式表示)。
(2)沉淀法
取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两支试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。该温度下Ksp(AgNO2)=2×10-8 (mol•L-1)2; Ksp(AgCl)=1.8×10-10(mol•L-1)2,则反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=__________ (计算结果写成分数)。
(二)实验室可用如下装置(略去部分夹持仪器)备亚硝酸钠。
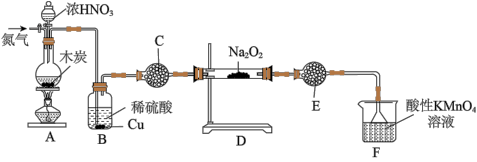
已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(3)加热装置A前,先通一段时间N2,目的是__________ 。
(4)装置A中发生反应的化学方程式为__________ ,装置B的作用是__________ 。
(5)仪器C的名称为__________ ,其中盛放的药品为__________ (填名称)。
㈠鉴别NaCl和NaNO2
(1)测定溶液pH
用pH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是
(2)沉淀法
取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两支试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。该温度下Ksp(AgNO2)=2×10-8 (mol•L-1)2; Ksp(AgCl)=1.8×10-10(mol•L-1)2,则反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=
(二)实验室可用如下装置(略去部分夹持仪器)备亚硝酸钠。

已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(3)加热装置A前,先通一段时间N2,目的是
(4)装置A中发生反应的化学方程式为
(5)仪器C的名称为
您最近一年使用:0次
填空题
|
困难
(0.15)
【推荐2】氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:
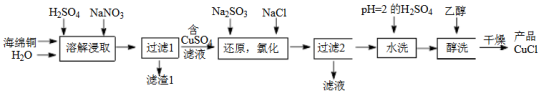
(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是___________ 。
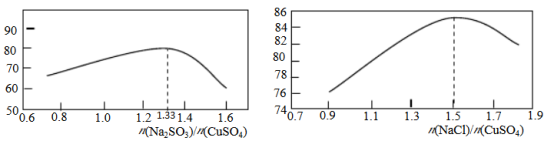
(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___________ 。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___________ 。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是___________ 。
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响___________ 。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为______________________ 。
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为______________________ 。

(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是

(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为
您最近一年使用:0次
填空题
|
困难
(0.15)
【推荐3】水合肼 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是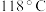 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。

回答下列问题:
(1) 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:___________ 。
(2)已知次氯酸钠与盐酸混合能够生成 ,说明氧化性
,说明氧化性
___________  (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与___________ 有关。
(3) 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为___________ 。
(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是___________ 。
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:___________ 。
(6)电化学方法制备 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。

①双极膜中产生的___________ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②若电路中转移2mol电子,理论上负极区溶液增重___________ g。
 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是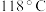 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。
回答下列问题:
(1)
 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:(2)已知次氯酸钠与盐酸混合能够生成
 ,说明氧化性
,说明氧化性
 (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与(3)
 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:
(6)电化学方法制备
 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②若电路中转移2mol电子,理论上负极区溶液增重
您最近一年使用:0次
填空题
|
困难
(0.15)
名校
【推荐1】如图为实验室制备乙炔并进行性质验证的装置(夹持仪器已略去)。
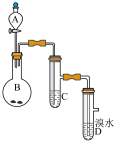
(1)实验开始前,首先进行的操作是___ ;
(2)实验室制备乙炔的方程式为___ ;
(3)仪器A在安装前必须进行的操作是___ ,为防止气体生成的速率过快,由A滴入B的试剂为___ 。
(4)装置C可选用的试剂为___ (写出一种即可),其作用为___ ;
(5)反应开始后,D中的现象为___ ,所发生反应的反应类型为___ ;
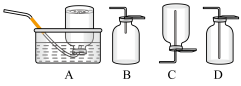
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___ 。

(1)实验开始前,首先进行的操作是
(2)实验室制备乙炔的方程式为
(3)仪器A在安装前必须进行的操作是
(4)装置C可选用的试剂为
(5)反应开始后,D中的现象为
(6)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是

您最近一年使用:0次




