名校
解题方法
1 . 肼(N2H4)是一种强还原剂,用 与
与 反应可用于生产肼(N2H4),其反应的化学方程式为:
反应可用于生产肼(N2H4),其反应的化学方程式为: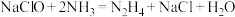 。工业碱性
。工业碱性 溶液中含有
溶液中含有 会影响所得肼的产品质量。测定碱性
会影响所得肼的产品质量。测定碱性 溶液中的
溶液中的 含量的方法如下:取
含量的方法如下:取 碱性
碱性 溶液试样,加入过量
溶液试样,加入过量 ,将
,将 完全还原
完全还原 (
( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,除去过量的
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,除去过量的 ,冷却至室温,加入稀硫酸至酸性,再加入
,冷却至室温,加入稀硫酸至酸性,再加入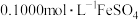 溶液
溶液 ,充分反应,将
,充分反应,将 完全还原
完全还原 ,再用
,再用 酸性
酸性 溶液氧化多余的
溶液氧化多余的 (
( 被还原为
被还原为 ),消耗酸性
),消耗酸性 溶液
溶液 。
。
(1) 与次氯酸钠反应的离子方程式为
与次氯酸钠反应的离子方程式为_______ 。
(2)通常不选用盐酸酸化 的原因是
的原因是_______ 。
(3)计算样品中 的含量(以g/L表示),写出计算过程。
的含量(以g/L表示),写出计算过程。_______ 。
 与
与 反应可用于生产肼(N2H4),其反应的化学方程式为:
反应可用于生产肼(N2H4),其反应的化学方程式为: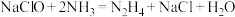 。工业碱性
。工业碱性 溶液中含有
溶液中含有 会影响所得肼的产品质量。测定碱性
会影响所得肼的产品质量。测定碱性 溶液中的
溶液中的 含量的方法如下:取
含量的方法如下:取 碱性
碱性 溶液试样,加入过量
溶液试样,加入过量 ,将
,将 完全还原
完全还原 (
( 在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,除去过量的
在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,除去过量的 ,冷却至室温,加入稀硫酸至酸性,再加入
,冷却至室温,加入稀硫酸至酸性,再加入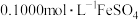 溶液
溶液 ,充分反应,将
,充分反应,将 完全还原
完全还原 ,再用
,再用 酸性
酸性 溶液氧化多余的
溶液氧化多余的 (
( 被还原为
被还原为 ),消耗酸性
),消耗酸性 溶液
溶液 。
。(1)
 与次氯酸钠反应的离子方程式为
与次氯酸钠反应的离子方程式为(2)通常不选用盐酸酸化
 的原因是
的原因是(3)计算样品中
 的含量(以g/L表示),写出计算过程。
的含量(以g/L表示),写出计算过程。
您最近一年使用:0次
解题方法
2 . 请回答下列问题:
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。试写出氨气和二氧化氮在一定条件下反应的化学方程式:_______ ,反应中氧化剂是_______ ,还原剂是_____ 。
(2)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下: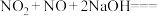
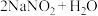 、
、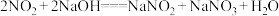 。现有
。现有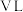 某NaOH溶液,能完全吸收由
某NaOH溶液,能完全吸收由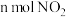 和
和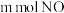 组成的大气污染物。
组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为______  。
。
②若所得溶液中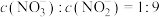 ,则原混合气体中
,则原混合气体中 和NO的物质的量之比
和NO的物质的量之比
_______ 。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。试写出氨气和二氧化氮在一定条件下反应的化学方程式:
(2)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
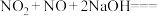
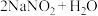 、
、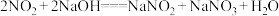 。现有
。现有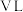 某NaOH溶液,能完全吸收由
某NaOH溶液,能完全吸收由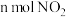 和
和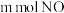 组成的大气污染物。
组成的大气污染物。①所用烧碱溶液的物质的量浓度至少为
 。
。②若所得溶液中
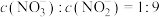 ,则原混合气体中
,则原混合气体中 和NO的物质的量之比
和NO的物质的量之比
您最近一年使用:0次
20-21高一上·浙江绍兴·阶段练习
解题方法
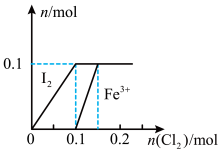
3 . 已知5Cl2+I2+6H2O=10HCl+2HIO3,HIO3不与Cl2继续反应。向200 mLFeI2溶液中缓慢通入Cl2,其中I2、Fe3+的物质的量随n(Cl2)的变化如图所示,请回答下列问题:______ 。
(2)当n(Cl2)=0.12 mol时,溶液中的离子主要为______ ,从开始通入Cl2到n(Cl2)=0.12 mol时的总反应的离子方程式为______ 。
(3)在图中画出IO 的物质的量随n(Cl2)的变化曲线
的物质的量随n(Cl2)的变化曲线______ 。
(4)当溶液中n(Cl-):n(IO )=8:1时,通入的氯气在标准状况下的体积为
)=8:1时,通入的氯气在标准状况下的体积为______ 。
(2)当n(Cl2)=0.12 mol时,溶液中的离子主要为
(3)在图中画出IO
 的物质的量随n(Cl2)的变化曲线
的物质的量随n(Cl2)的变化曲线(4)当溶液中n(Cl-):n(IO
 )=8:1时,通入的氯气在标准状况下的体积为
)=8:1时,通入的氯气在标准状况下的体积为
您最近一年使用:0次
解题方法
4 . 亚硝酸钠有咸味,有毒,暴露于空气中会与氧气反应生成硝酸钠。
已知: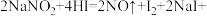 _______。
_______。
(1)上述方程式中横线处应填的是_______ 。
(2)上述反应的还原剂为_______ (填化学式);若反应中有 (标准状况下)气体生成则反应中转移电子的物质的量为
(标准状况下)气体生成则反应中转移电子的物质的量为_______  。
。
(3)在酸性条件下,高锰酸钾可将 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:_______ 。
(4) 加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式
加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式_______ 。反应中被氧化的元素和被还原的元素的物质的量之比为_______ 。
(5)某厂废液中,含有2%~5%的 ,直接排放会造成污染,
,直接排放会造成污染, 能使
能使 转化为
转化为 ,则反应中氧化剂和还原剂的质量之比为
,则反应中氧化剂和还原剂的质量之比为_______ 。
已知:
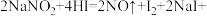 _______。
_______。(1)上述方程式中横线处应填的是
(2)上述反应的还原剂为
 (标准状况下)气体生成则反应中转移电子的物质的量为
(标准状况下)气体生成则反应中转移电子的物质的量为 。
。(3)在酸性条件下,高锰酸钾可将
 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:(4)
 加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式
加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式(5)某厂废液中,含有2%~5%的
 ,直接排放会造成污染,
,直接排放会造成污染, 能使
能使 转化为
转化为 ,则反应中氧化剂和还原剂的质量之比为
,则反应中氧化剂和还原剂的质量之比为
您最近一年使用:0次
解题方法
5 . 完成下列问题:
(1)1.000g铝黄铜合金(设只含铜、锌、铝)与0.100mol·dm-3硫酸反应,在25℃和101.325kPa下测得放出的气体的体积为149.3cm3,将相同质量的该合金溶于足量热浓硫酸,在相同温度和压强下测得放出的气体的体积为411.1cm3,计算此铝黄铜合金中各组分的质量分数_____ 。
(2)向[Cu(NH3)4]SO4水溶液中通入SO2气体至溶液呈微酸性,析出白色沉淀CuNH4SO3,CuNH4SO3与足量的硫酸混合并微热,得到金属Cu等物质,本法制得的Cu呈超细粉末状,有重要用途。
①写出生成CuNH4SO3的反应方程式______ 。
②写出CuNH4SO3与H2SO4作用的反应方程式_____ ,若反应在敞开反应器中进行,计算反应物中的Cu元素变成超细粉末Cu的转化率______ 。
③若反应在密闭容器中进行,且酸量充足,计算反应物中的Cu元素变成超细粉末Cu的转化率_____ 。并对此做出解释______ 。
(1)1.000g铝黄铜合金(设只含铜、锌、铝)与0.100mol·dm-3硫酸反应,在25℃和101.325kPa下测得放出的气体的体积为149.3cm3,将相同质量的该合金溶于足量热浓硫酸,在相同温度和压强下测得放出的气体的体积为411.1cm3,计算此铝黄铜合金中各组分的质量分数
(2)向[Cu(NH3)4]SO4水溶液中通入SO2气体至溶液呈微酸性,析出白色沉淀CuNH4SO3,CuNH4SO3与足量的硫酸混合并微热,得到金属Cu等物质,本法制得的Cu呈超细粉末状,有重要用途。
①写出生成CuNH4SO3的反应方程式
②写出CuNH4SO3与H2SO4作用的反应方程式
③若反应在密闭容器中进行,且酸量充足,计算反应物中的Cu元素变成超细粉末Cu的转化率
您最近一年使用:0次
解题方法
6 . 纳米级Cu2O可以作为太阳光分解水的催化剂,有这重要的应用前景。在加热的条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时生成N2,写出该反应的化学方程式_______ 。当收集的N2体积为3.36L(标准状况),计算制得纳米Cu2O的质量_______ 和转移电子数_______ 。
您最近一年使用:0次
解题方法
7 . 氧化还原反应是一类重要的化学反应,在工农生产科学技术和日常生活中都有广泛的应用。
(1)①“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:___________ 。
② 毒性较强,常用NaHSO3处理工业废水中的
毒性较强,常用NaHSO3处理工业废水中的 ,请配平该反应
,请配平该反应___________ 。□H++□ +□
+□ =口Cr3++□
=口Cr3++□ +□H2O
+□H2O
(2)①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为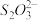 +4Cl2 +5H2O=2
+4Cl2 +5H2O=2 + 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为
+ 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为______ 。
②用HI和淀粉溶液可以检验加碘盐中是否存在KIO3,原理为KIO3+6HI=3I2+ KI +3H2O,氧化剂和还原剂的物质的量之比为_______________ 。
③钙元素是人体必须的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3 mol/L。现抽取某人血样10 mL,稀释后用草酸铵[ (NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0 mL5.0×10-3 mol/LKMnO4溶液与溶解得到的草酸恰好完全反应。则此人血液中Ca2+的浓度____ ,判断其 血液含钙量__________ (填“正常”或“不正常”)。(已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)
(1)①“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:
②
 毒性较强,常用NaHSO3处理工业废水中的
毒性较强,常用NaHSO3处理工业废水中的 ,请配平该反应
,请配平该反应 +□
+□ =口Cr3++□
=口Cr3++□ +□H2O
+□H2O(2)①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为
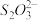 +4Cl2 +5H2O=2
+4Cl2 +5H2O=2 + 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为
+ 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为②用HI和淀粉溶液可以检验加碘盐中是否存在KIO3,原理为KIO3+6HI=3I2+ KI +3H2O,氧化剂和还原剂的物质的量之比为
③钙元素是人体必须的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3 mol/L。现抽取某人血样10 mL,稀释后用草酸铵[ (NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0 mL5.0×10-3 mol/LKMnO4溶液与溶解得到的草酸恰好完全反应。则此人血液中Ca2+的浓度
您最近一年使用:0次
名校
解题方法
8 . 2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消 毒剂在生产生活中有着广泛的用途。
I.NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用,请回答下列问题。
(1)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:_____ 。(已知酸性:H2 CO3 >HClO>HCO )
)
(2)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是_____ 。
II.ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌及烟气的脱硫 脱硝。回答下列问题:
(3)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备 ClO2,该反应中氧化剂和还原剂的物质的量之比为_____ 。
(4)为研究 ClO2脱硝的适宜条件,在 1L200 mg•L-1 ClO2溶液中加 NaOH 溶液调节 pH,通入 NO 气体并测定 NO 的去除率,脱硝后 N 元素以 NO 形式存在,其关系如下图所示:
形式存在,其关系如下图所示:

①实验中使用的 C1O2溶液的物质的量浓度为_____ (保留一位有效数字);要使 NO 的去除率更高,应控制的条件是_______ 。
②NaClO2吸收 NO 的效率高于 C1O2,请写出碱性条件下 NaClO2脱除 NO 反应的离子方程式:_____ 。
I.NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用,请回答下列问题。
(1)浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:
 )
) (2)若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是
II.ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌及烟气的脱硫 脱硝。回答下列问题:
(3)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备 ClO2,该反应中氧化剂和还原剂的物质的量之比为
(4)为研究 ClO2脱硝的适宜条件,在 1L200 mg•L-1 ClO2溶液中加 NaOH 溶液调节 pH,通入 NO 气体并测定 NO 的去除率,脱硝后 N 元素以 NO
 形式存在,其关系如下图所示:
形式存在,其关系如下图所示:
①实验中使用的 C1O2溶液的物质的量浓度为
②NaClO2吸收 NO 的效率高于 C1O2,请写出碱性条件下 NaClO2脱除 NO 反应的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 双氧水是重要的化学试剂。
(1)一定条件下,O2得电子转化为超氧自由基(·O ),并实现如下图所示的转化:
),并实现如下图所示的转化:
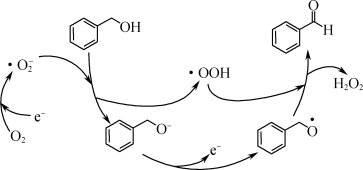
① 是
是________ (填“氧化”或“还原”)反应。
②写出图示转化总反应的化学方程式:________ 。
(2) K2Cr2O7酸性条件下与H2O2反应生成CrO5,反应为非氧化还原反应。据此分析,CrO5中-2价O与-1价O的数目比为________ 。
(3) H2O2可用于测定酒精饮料中乙醇的含量。现有20.00 mL某鸡尾酒,将其中CH3CH2OH蒸出并通入17.0 mL 0.200 0 mol·L-1 K2Cr2O7溶液(H2SO4酸化)中,发生反应:K2Cr2O7+C2H5OH+H2SO4―→Cr2(SO4)3+CH3COOH+K2SO4+H2O(未配平)
再用0.400 0 mol·L-1的双氧水滴定反应后所得的混合液,用去19.00 mL双氧水,滴定过程中发生如下反应:
反应1:4H2O2+K2Cr2O7+H2SO4===K2SO4+2CrO5+5H2O
反应2:H2O2+CH3COOH===CH3COOOH+H2O
则该鸡尾酒中CH3CH2OH的物质的量浓度为________ mol·L-1(写出计算过程)。
(1)一定条件下,O2得电子转化为超氧自由基(·O
 ),并实现如下图所示的转化:
),并实现如下图所示的转化:
①
 是
是②写出图示转化总反应的化学方程式:
(2) K2Cr2O7酸性条件下与H2O2反应生成CrO5,反应为非氧化还原反应。据此分析,CrO5中-2价O与-1价O的数目比为
(3) H2O2可用于测定酒精饮料中乙醇的含量。现有20.00 mL某鸡尾酒,将其中CH3CH2OH蒸出并通入17.0 mL 0.200 0 mol·L-1 K2Cr2O7溶液(H2SO4酸化)中,发生反应:K2Cr2O7+C2H5OH+H2SO4―→Cr2(SO4)3+CH3COOH+K2SO4+H2O(未配平)
再用0.400 0 mol·L-1的双氧水滴定反应后所得的混合液,用去19.00 mL双氧水,滴定过程中发生如下反应:
反应1:4H2O2+K2Cr2O7+H2SO4===K2SO4+2CrO5+5H2O
反应2:H2O2+CH3COOH===CH3COOOH+H2O
则该鸡尾酒中CH3CH2OH的物质的量浓度为
您最近一年使用:0次
2020-05-21更新
|
362次组卷
|
3卷引用:江苏省泰州市2020届高三第二次模拟考试(5月) 化学试题
10 . 在900°C的空气中合成出一种含镧、钙和锰(摩尔比2:2:1)的复合氧化物,其中锰可能以+2、+3、 +4或者混合价态存在。为确定该复合氧化物的化学式,进行如下分析:
(1)准确移取25.00 mL 0.05301 kJ·mol1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5mL6 kJ·mol1的HNO3溶液,微热至60~70°C,用KMnO4溶液滴定,消耗27.75mL。写出滴定过程发生的反应的方程式___________ ;计算KMnO4溶液的浓度。___________
(2)准确称取0.4460g复合氧化物样品,放入锥形瓶中,加25.00mL上述草酸钠溶液和30mL6 kJ ·mol-1的HNO3溶液,在60~70°C 下充分摇动,约半小时后得到无色透明溶液。用上述KMnO4溶液滴定,消耗10.02 mL。根据实验结果推算复合氧化物中锰的价态___________ ,给出该复合氧化物的化学式___________ ,写出样品溶解过程的反应方程式___________ 。已知La的原子量为138.9。
(1)准确移取25.00 mL 0.05301 kJ·mol1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5mL6 kJ·mol1的HNO3溶液,微热至60~70°C,用KMnO4溶液滴定,消耗27.75mL。写出滴定过程发生的反应的方程式
(2)准确称取0.4460g复合氧化物样品,放入锥形瓶中,加25.00mL上述草酸钠溶液和30mL6 kJ ·mol-1的HNO3溶液,在60~70°C 下充分摇动,约半小时后得到无色透明溶液。用上述KMnO4溶液滴定,消耗10.02 mL。根据实验结果推算复合氧化物中锰的价态
您最近一年使用:0次



