解题方法
1 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①饱和氨水的浓度约为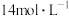
② 为浅青色沉淀
为浅青色沉淀
③ 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)有研究认为蓝色沉淀中还有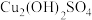 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。___________ ,c=___________ 。
②实验现象是___________ 。
(5)从平衡移动角度,结合化学用语,解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(6)针对实验ii未能成功配制 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:___________ 。
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、___________ 。
| 实验序号 | 操作 | 现象 | |
实验i: 的配制 的配制 | 实验i-a | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的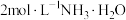 | 产生蓝色沉淀,加入 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的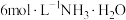 | 产生蓝色沉淀,加入 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的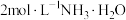 | 产生蓝色沉淀,加入 后沉淀完全溶解,得到澄清的深蓝色溶液。 后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
实验ii: 的配制 的配制 | 实验ii-a | 在试管内混合 溶液和过量 溶液和过量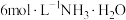 | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合 溶液和过量 溶液和过量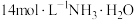 | 得到浅青色沉淀,沉淀未见明显溶解。 | |
实验iii: 的配制 的配制 | 实验iii | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的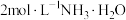 | 产生白色沉淀,加入 后沉淀完全溶解,得到无色溶液。 后沉淀完全溶解,得到无色溶液。 |
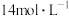
②
 为浅青色沉淀
为浅青色沉淀③
 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)有研究认为蓝色沉淀中还有
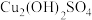 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测
 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。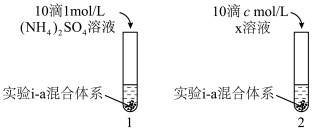
②实验现象是
(5)从平衡移动角度,结合化学用语,解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(6)针对实验ii未能成功配制
 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、
您最近一年使用:0次
2 . 某含氰废水中氰主要以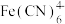 和少量
和少量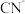 形式存在,对该废水进行除氰处理的步骤如下。
形式存在,对该废水进行除氰处理的步骤如下。
Ⅰ.取一定量处理好的铁屑和活性炭混合物(按照一定的体积比混合);
Ⅱ.加入一定体积的含氰废水,调节 值为3.5,控制曝气(即通入空气)时间,静置,反应一段时间后过滤,得滤液
值为3.5,控制曝气(即通入空气)时间,静置,反应一段时间后过滤,得滤液 ,总氰去除率接近
,总氰去除率接近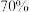 ;
;
Ⅲ.调节滤液 的
的 ,加入一定量的
,加入一定量的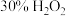 溶液,反应一段时间后过滤,得滤液
溶液,反应一段时间后过滤,得滤液 ,总氰去除率可达
,总氰去除率可达 以上;
以上;
Ⅳ.向滤液 中加入
中加入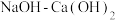 调节
调节 至
至 ,混凝沉淀,经过滤,总氰去除率接近
,混凝沉淀,经过滤,总氰去除率接近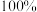 ,得到符合排放标准的废水。
,得到符合排放标准的废水。
(1)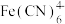 的中心离子是
的中心离子是_______ 。
(2)Ⅰ中,处理过程需用稀硫酸除去铁屑表面的氧化铁,反应的离子方程式是_______ 。
(3)步骤Ⅱ中,生成沉淀的主要成分是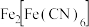 。
。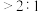 时,随着铁炭体积比增加,相同时间内总氰去除率降低,原因是:
时,随着铁炭体积比增加,相同时间内总氰去除率降低,原因是: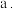 活性炭的吸附性减弱;
活性炭的吸附性减弱;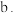
_______ 。
②反应过程中,会有部分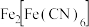 转化为
转化为 ,补全反应的离子方程式
,补全反应的离子方程式_______ 。
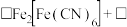 _______
_______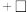 _______
_______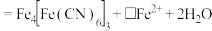
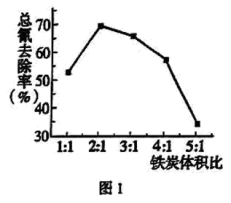
(4)步骤Ⅲ中,其他条件不变,研究 不同对滤液
不同对滤液 中总氰去除效果的影响,结果如图2所示,依据实验结果确定应调节滤液
中总氰去除效果的影响,结果如图2所示,依据实验结果确定应调节滤液 的
的 为4左右。
为4左右。 可将
可将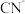 氧化为
氧化为 和
和 ,反应的离子方程式是
,反应的离子方程式是_______ 。
②当 时,随
时,随 增大,总氰去除率下降,可能的原因是
增大,总氰去除率下降,可能的原因是_______ 。
(5)在步骤Ⅳ中产生了胶体,使水中的氰经聚沉而除去。证明有胶体产生的方法是_______ 。
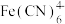 和少量
和少量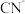 形式存在,对该废水进行除氰处理的步骤如下。
形式存在,对该废水进行除氰处理的步骤如下。Ⅰ.取一定量处理好的铁屑和活性炭混合物(按照一定的体积比混合);
Ⅱ.加入一定体积的含氰废水,调节
 值为3.5,控制曝气(即通入空气)时间,静置,反应一段时间后过滤,得滤液
值为3.5,控制曝气(即通入空气)时间,静置,反应一段时间后过滤,得滤液 ,总氰去除率接近
,总氰去除率接近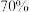 ;
;Ⅲ.调节滤液
 的
的 ,加入一定量的
,加入一定量的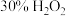 溶液,反应一段时间后过滤,得滤液
溶液,反应一段时间后过滤,得滤液 ,总氰去除率可达
,总氰去除率可达 以上;
以上;Ⅳ.向滤液
 中加入
中加入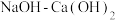 调节
调节 至
至 ,混凝沉淀,经过滤,总氰去除率接近
,混凝沉淀,经过滤,总氰去除率接近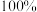 ,得到符合排放标准的废水。
,得到符合排放标准的废水。(1)
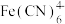 的中心离子是
的中心离子是(2)Ⅰ中,处理过程需用稀硫酸除去铁屑表面的氧化铁,反应的离子方程式是
(3)步骤Ⅱ中,生成沉淀的主要成分是
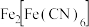 。
。
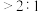 时,随着铁炭体积比增加,相同时间内总氰去除率降低,原因是:
时,随着铁炭体积比增加,相同时间内总氰去除率降低,原因是: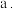 活性炭的吸附性减弱;
活性炭的吸附性减弱;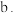
②反应过程中,会有部分
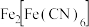 转化为
转化为 ,补全反应的离子方程式
,补全反应的离子方程式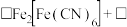 _______
_______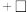 _______
_______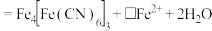
(4)步骤Ⅲ中,其他条件不变,研究
 不同对滤液
不同对滤液 中总氰去除效果的影响,结果如图2所示,依据实验结果确定应调节滤液
中总氰去除效果的影响,结果如图2所示,依据实验结果确定应调节滤液 的
的 为4左右。
为4左右。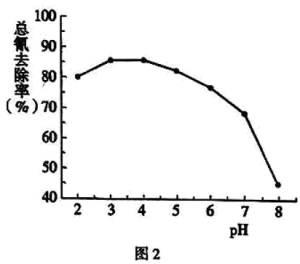
 可将
可将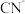 氧化为
氧化为 和
和 ,反应的离子方程式是
,反应的离子方程式是②当
 时,随
时,随 增大,总氰去除率下降,可能的原因是
增大,总氰去除率下降,可能的原因是(5)在步骤Ⅳ中产生了胶体,使水中的氰经聚沉而除去。证明有胶体产生的方法是
您最近一年使用:0次
3 . 从高铁炉渣(含 、
、 、
、 、
、 、
、 、
、 、
、 等)中回收
等)中回收 及制得
及制得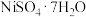 的工艺流程如下图1所示.
的工艺流程如下图1所示. )
)
回答下列问题:
(1)为提高酸浸效率,可以采取的措施为__________ (答出一条即可)。
(2)除铁外,滤渣2的主要成分为__________ ; 的作用为
的作用为__________ 。
(3)观察图2,常温下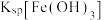
_____ (填“>”“<”或“=”) ;
; 时,溶液中
时,溶液中 的浓度为
的浓度为__________ 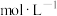 。
。__________ ;煅烧时发生反应的化学方程式为__________ 。
(5)镍能形成多种不同的化合物.图3是镍的一种螯合物(含有多个配位原子的配体与同一中心离子通过螯合配位成环而形成的配合物为螯合物)的结构示意图,图3是一种镍的氧化物的晶胞示意图. 该配合物通过螯合作用形成的配位键为
该配合物通过螯合作用形成的配位键为__________  。
。
②图4所示晶胞的化学式为__________ ;与 配位的
配位的 形成的空间构型为
形成的空间构型为__________ .若晶胞参数 ,该晶体的密度为
,该晶体的密度为__________  (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
 、
、 、
、 、
、 、
、 、
、 、
、 等)中回收
等)中回收 及制得
及制得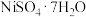 的工艺流程如下图1所示.
的工艺流程如下图1所示.
 )
)回答下列问题:
(1)为提高酸浸效率,可以采取的措施为
(2)除铁外,滤渣2的主要成分为
 的作用为
的作用为(3)观察图2,常温下
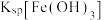
 ;
; 时,溶液中
时,溶液中 的浓度为
的浓度为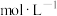 。
。
(5)镍能形成多种不同的化合物.图3是镍的一种螯合物(含有多个配位原子的配体与同一中心离子通过螯合配位成环而形成的配合物为螯合物)的结构示意图,图3是一种镍的氧化物的晶胞示意图.

 该配合物通过螯合作用形成的配位键为
该配合物通过螯合作用形成的配位键为 。
。②图4所示晶胞的化学式为
 配位的
配位的 形成的空间构型为
形成的空间构型为 ,该晶体的密度为
,该晶体的密度为 (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
您最近一年使用:0次
名校
解题方法
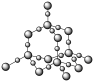
4 . 观察下列结构示意图并结合相关信息,判断有关说法不正确的是
| 玛瑙 |  | 18-冠-6 |  |
|
|
|
|
A.玛瑙,又名马脑、码瑙或马瑙,属于共价晶体,且两种原子个数比为 |
B.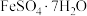 结构中键角1、2、3由大到小的顺序: 结构中键角1、2、3由大到小的顺序: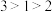 |
C.18-冠-6中O(灰球)电负性大,带负电荷,通过离子键与 作用,体现了超分子“分子识别”的特征 作用,体现了超分子“分子识别”的特征 |
D.固态硫 中S原子均为 中S原子均为 杂化 杂化 |
您最近一年使用:0次
名校
解题方法
5 . 我国学者最近研发出一种以铝为负极、石墨烯薄膜( )为正极的新型铝-石墨烯电池,
)为正极的新型铝-石墨烯电池,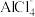 可在石墨烯薄膜上嵌入或脱嵌,离子液体
可在石墨烯薄膜上嵌入或脱嵌,离子液体 作电解质,阴离子有
作电解质,阴离子有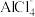 、
、 ,阳离子为
,阳离子为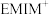 (
(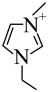 ),放电机理如图所示。下列说法错误的是
),放电机理如图所示。下列说法错误的是

A.放电时正极的电极反应: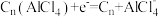 |
B.该离子液体可用于钢制品上电镀铝,阴极的电极反应为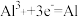 |
C.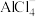 中存在配位键 中存在配位键 |
D.离子液体中的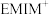 不参与反应,只起传递离子的作用 不参与反应,只起传递离子的作用 |
您最近一年使用:0次
解题方法
6 . 请按要求完成填空:
(1)完成下表中的空白:
(2)配合物[Cu(NH3)4]SO4的中心离子是___________ 、配体是___________ 、配位原子是___________ 、配位数是___________ 。
(1)完成下表中的空白:
| 粒子 | 中心原子孤电子对数 | 中心原子的杂化轨道类型 | VSEPR模型 | 空间结构 |
| CO2 | ① | ② | ③ | ④ |
SO | ⑤ | ⑥ | ⑦ | ⑧ |
您最近一年使用:0次
名校
7 . 近年来,光催化剂的研究是材料领域的热点方向。如图一种Ru配合物复合光催化剂,可将 转化为
转化为 。下列说法错误的是
。下列说法错误的是
 转化为
转化为 。下列说法错误的是
。下列说法错误的是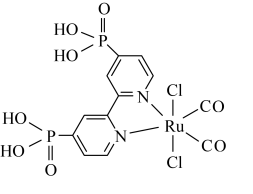
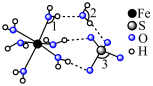
A.该配合物中Ru的配位数是6,中心离子为 |
B.Ru配合物中第二周期元素的形成的简单氢化物的沸点 |
C.已知吡啶( )中所有原子共平面、则吡啶中存在 )中所有原子共平面、则吡啶中存在 大 大 键 键 |
D. 的沸点比 的沸点比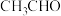 高,主要原因是 高,主要原因是 分子间存在范德华力和氢键,而 分子间存在范德华力和氢键,而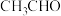 分子间只有范德华力 分子间只有范德华力 |
您最近一年使用:0次
8 . 金属镍及其化合物在工业、科研等领域应用广泛。回答下列问题:
(1)基态Ni²⁺的价层电子轨道表示式为___________ ,与Ni同周期且基态原子未成对电子数相同的有___________ (填元素符号)。
(2)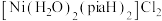 是一种重要的配合物,其中“piaH”是吡啶—2—甲酰胺的缩写,结构如图,为双螯配体。该配合物中
是一种重要的配合物,其中“piaH”是吡啶—2—甲酰胺的缩写,结构如图,为双螯配体。该配合物中 的配位数为
的配位数为___________ ,在配合物中,两个“piaH”与 分别螯合形成两个五元环,则五元环中提供孤电子对的原子可能的组合是
分别螯合形成两个五元环,则五元环中提供孤电子对的原子可能的组合是___________ (用“α”“β”“γ”表示)。 被氧化为
被氧化为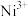 ,成为
,成为 。已知
。已知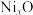 的摩尔质量为69.1 g⋅mol
的摩尔质量为69.1 g⋅mol ,则标明Ni价态的化学式为
,则标明Ni价态的化学式为___________ (示例: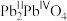 ),
),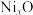 晶体中镍离子的占有率为
晶体中镍离子的占有率为___________ 。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。NiAs晶体结构如图甲所示,其晶胞俯视图如图乙所示。A点原子的分数坐标为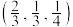 ,则B点原子的分数坐标为
,则B点原子的分数坐标为___________ ,A、B两点间距离为___________ pm。
(1)基态Ni²⁺的价层电子轨道表示式为
(2)
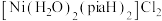 是一种重要的配合物,其中“piaH”是吡啶—2—甲酰胺的缩写,结构如图,为双螯配体。该配合物中
是一种重要的配合物,其中“piaH”是吡啶—2—甲酰胺的缩写,结构如图,为双螯配体。该配合物中 的配位数为
的配位数为 分别螯合形成两个五元环,则五元环中提供孤电子对的原子可能的组合是
分别螯合形成两个五元环,则五元环中提供孤电子对的原子可能的组合是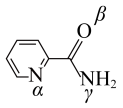
 被氧化为
被氧化为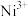 ,成为
,成为 。已知
。已知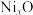 的摩尔质量为69.1 g⋅mol
的摩尔质量为69.1 g⋅mol ,则标明Ni价态的化学式为
,则标明Ni价态的化学式为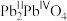 ),
),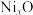 晶体中镍离子的占有率为
晶体中镍离子的占有率为(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。NiAs晶体结构如图甲所示,其晶胞俯视图如图乙所示。A点原子的分数坐标为
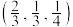 ,则B点原子的分数坐标为
,则B点原子的分数坐标为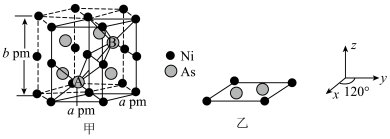
您最近一年使用:0次
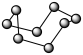
9 . 上海有机化学研究所施世良课题组以Ni(cod)2为催化剂实现了叔醇的手性合成。
(1)Ni在元素周期表中的位置是___________ ,写出其基态原子的最外层电子排布图:___________ 。
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。___________ 种。
②Ni(cod)2分子内存在的作用力有___________ (填序号)。
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(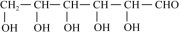 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 ___________ 。
(4)红银矿NiAs晶体结构如图所示:___________ 。
②两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和___________ 。
③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为___________ mol-1(用含m、n和p的代数式表示)。
(1)Ni在元素周期表中的位置是
(2)Ni(cod)2是指双-(1,5-环辛二烯)镍,其结构如图所示。
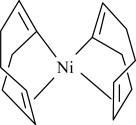
②Ni(cod)2分子内存在的作用力有
a.配位键 b.金属键 c.极性键 d.非极性键 e.氢键
(3)葡萄糖(
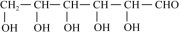 )分子中,手性碳原子个数为
)分子中,手性碳原子个数为 (4)红银矿NiAs晶体结构如图所示:
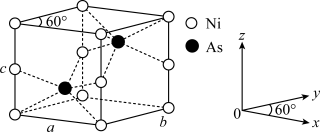
②两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和③已知晶体密度为pg·cm-3,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则阿伏加德罗常数NA可表示为
您最近一年使用:0次
10 . 过渡元素镍钛在分子捕捉、量子材料等方向日益重要。回答下列问题:
(1)某Ni离子与 、
、 形成的晶体能捕捉苯分子,结构如图甲所示。该晶体中非金属元素电负性由大到小的顺序为
形成的晶体能捕捉苯分子,结构如图甲所示。该晶体中非金属元素电负性由大到小的顺序为______ ,Ni的化合价为______ ,杂化轨道数为______ 。 与Ni离子形成配位键时的配位原子为
与Ni离子形成配位键时的配位原子为______ ,键角∠H-N-H______ (填“>”或“<”)107.3°。
(2)部分钛酸锶晶胞结构如图乙。晶体Ⅰ的化学式为Ⅰ_____ ,该系列晶体的化学式可表示为_____ (用含n的式子表示,n为Ti原子个数),当 时,晶体化学式为
时,晶体化学式为______ 。
(1)某Ni离子与
 、
、 形成的晶体能捕捉苯分子,结构如图甲所示。该晶体中非金属元素电负性由大到小的顺序为
形成的晶体能捕捉苯分子,结构如图甲所示。该晶体中非金属元素电负性由大到小的顺序为 与Ni离子形成配位键时的配位原子为
与Ni离子形成配位键时的配位原子为(2)部分钛酸锶晶胞结构如图乙。晶体Ⅰ的化学式为Ⅰ
 时,晶体化学式为
时,晶体化学式为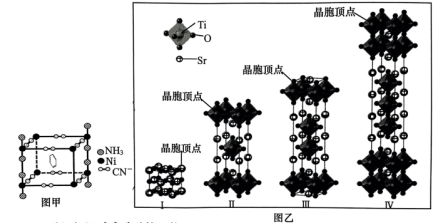
您最近一年使用:0次