1 . 碘元素是人体必需的微量元素之一。某学习小组在实验室进行海带提碘的探究,实验过程如下:
Ⅰ.海带中碘元素的确定
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入_______ (填仪器名称)中灼烧至海带完全成灰烬,然后继续进行下列流程。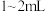 ,加入
,加入 稀硫酸、
稀硫酸、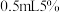 的
的 溶液,然后再加入
溶液,然后再加入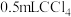 ,振荡后静置,若观察到
,振荡后静置,若观察到_______ (填实验现象),则证明海带中含有碘元素,上述过程中涉及的离子反应方程式为_______ 。
Ⅱ.海带提碘 中,可采取的操作是
中,可采取的操作是_______ 。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需经过蒸馏,指出图实验装置中存在的错误之处_______ 。
Ⅲ.人体碘的重要来源之一是食用加碘食盐(含 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验: 食盐样品,加适量蒸馏水使其完全溶解;
食盐样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入足量 溶液,使
溶液,使 与
与 反应完全生成
反应完全生成 ;
;
③向②中混合液逐滴加入浓度为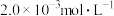 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液
溶液 。(已知:
。(已知: )
)
(5)写出步骤②中发生反应的离子方程式_______ 。
(6)上述实验样品中碘元素的含量为_______ 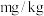 (用含w的代数式表示)。
(用含w的代数式表示)。
Ⅰ.海带中碘元素的确定
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入

 ,加入
,加入 稀硫酸、
稀硫酸、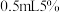 的
的 溶液,然后再加入
溶液,然后再加入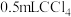 ,振荡后静置,若观察到
,振荡后静置,若观察到Ⅱ.海带提碘

 中,可采取的操作是
中,可采取的操作是(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需经过蒸馏,指出图实验装置中存在的错误之处
Ⅲ.人体碘的重要来源之一是食用加碘食盐(含
 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验: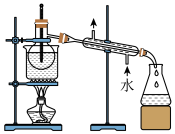
 食盐样品,加适量蒸馏水使其完全溶解;
食盐样品,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量
 溶液,使
溶液,使 与
与 反应完全生成
反应完全生成 ;
;③向②中混合液逐滴加入浓度为
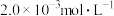 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液
溶液 。(已知:
。(已知: )
)(5)写出步骤②中发生反应的离子方程式
(6)上述实验样品中碘元素的含量为
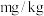 (用含w的代数式表示)。
(用含w的代数式表示)。
您最近一年使用:0次
2024-02-20更新
|
197次组卷
|
2卷引用:陕西省咸阳市实验中学2021-2022学年高一下学期阶段性检测(一)化学试题
名校
解题方法
2 . 海水是巨大的资源宝库,可以进行综合利用。请根据要求回答问题。
I.海水提溴过程如下:
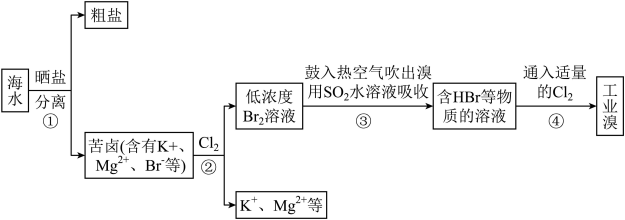
(1)“吹出法”提溴是利用了溴的___________ 性;第②步获得 反应的离子方程式是
反应的离子方程式是___________ 。
(2)工业上进行第③步操作的目的是___________ ;其反应的化学方程式为___________ 。
(3)根据上述反应可判断出 、
、 、
、 三种物质氧化性由强到弱的顺序是
三种物质氧化性由强到弱的顺序是___________ 。
(4)若步骤③通入960g ,则理论上可产出
,则理论上可产出___________ mol ,实际产出
,实际产出 的质量为1920g,则
的质量为1920g,则 的产率为
的产率为___________ (产率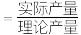 ×100%)。
×100%)。
II.从海洋植物海带中提取碘的实验过程如图所示:
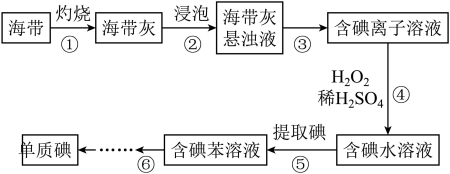
(5)步骤②是加入蒸馏水浸泡,浸泡时应将海带灰放入___________ (填仪器名称)中;步骤⑤提取碘后的水溶液中通常还含有少量碘单质,检验碘单质存在的方法和现象为___________ 。
I.海水提溴过程如下:

(1)“吹出法”提溴是利用了溴的
 反应的离子方程式是
反应的离子方程式是(2)工业上进行第③步操作的目的是
(3)根据上述反应可判断出
 、
、 、
、 三种物质氧化性由强到弱的顺序是
三种物质氧化性由强到弱的顺序是(4)若步骤③通入960g
 ,则理论上可产出
,则理论上可产出 ,实际产出
,实际产出 的质量为1920g,则
的质量为1920g,则 的产率为
的产率为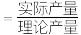 ×100%)。
×100%)。II.从海洋植物海带中提取碘的实验过程如图所示:

(5)步骤②是加入蒸馏水浸泡,浸泡时应将海带灰放入
您最近一年使用:0次
解题方法
3 . 食盐是生活必需品,也是一种工业原料。粗盐含有 、
、 、
、 等杂质。
等杂质。
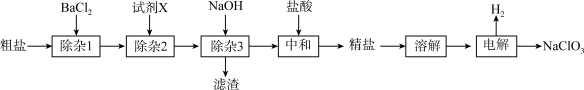
回答下列问题:
(1)“粗盐→精盐”过程:
①“除杂1”中反应的离子方程式为____ 。
②试剂X为____ (填化学式)。
③该过程中不涉及的实验操作是____ (填标号)。
A.溶解 B.过滤 C.蒸发 D.渗析
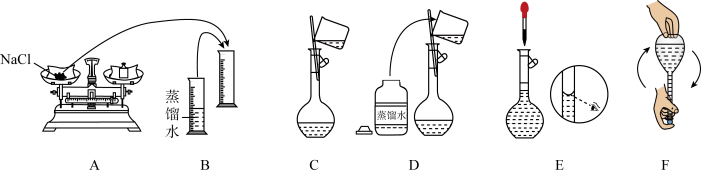
(2)用精盐配制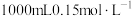 生理盐水的过程:
生理盐水的过程:
①用托盘天平称取 固体的质量为
固体的质量为____ g。
②下列关于配制溶液过程中操作不正确的是_______ (填标号)。
(3)“精盐→ ”过程:
”过程:
①将电解过程发生反应的化学方程式补充完整:______ ,__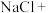 ___
___ __
__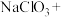 __
__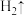 。
。
②在一定条件下 与盐酸反应生成消毒剂
与盐酸反应生成消毒剂 。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。则
的氧化能力。则 的有效氯含量为
的有效氯含量为______ g。
 、
、 、
、 等杂质。
等杂质。
回答下列问题:
(1)“粗盐→精盐”过程:
①“除杂1”中反应的离子方程式为
②试剂X为
③该过程中不涉及的实验操作是
A.溶解 B.过滤 C.蒸发 D.渗析
(2)用精盐配制
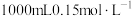 生理盐水的过程:
生理盐水的过程:①用托盘天平称取
 固体的质量为
固体的质量为②下列关于配制溶液过程中操作不正确的是

(3)“精盐→
 ”过程:
”过程:①将电解过程发生反应的化学方程式补充完整:
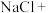 ___
___ __
__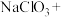 __
__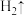 。
。②在一定条件下
 与盐酸反应生成消毒剂
与盐酸反应生成消毒剂 。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。则
的氧化能力。则 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
4 . 磷精矿主要成分为Ca5F(PO4)3,含少量REPO4、FeO、Fe2O3、SiO2,其中RE代表稀土元素。从磷精矿分离稀土元素的工业流程如下:

(1)RE属于ⅢB族,其中Sc的基态原子核外电子排布式为_______ 。
(2)“酸浸”过程HNO3与Ca5F(PO4)3反应生成两种酸,写出其化学方程式_______ 。
(3)“萃取”的目的是富集RE,但其余元素也会按一定比例进入萃取剂中。通过3ROH+POCl3⇌(RO)3PO+3HCl制得有机磷萃取剂(RO)3PO,其中−R代表烃基,其对(RO)3PO产率的影响如下表。
由表可知,随着碳原子数增加,烃基_______ (填“推电子”或“吸电子”)能力增强,O−H键更难断裂,(RO)3PO产率降低。
(4)“反萃取”的目的是分离RE和Fe元素。向“萃取液”中通入NH3,Fe2+、Fe3+、Re3+的沉淀率随pH变化如图。
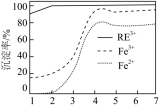
①试剂X为_______ (填“Na2SO3”或“NaClO”),应调节pH为_______ 。
②通入NH3得到REPO4沉淀的过程为:i.H3PO4+3NH3=(NH4)3PO4
ii._______ (写出该过程的离子方程式)
(5)若略去“净化”过程,则制得的草酸稀土会混有_______ 杂质(填化学式)。
(6)在整个工艺中,可从副产物中提取_______ 、_______ (填名称),用于生产氮肥。

(1)RE属于ⅢB族,其中Sc的基态原子核外电子排布式为
(2)“酸浸”过程HNO3与Ca5F(PO4)3反应生成两种酸,写出其化学方程式
(3)“萃取”的目的是富集RE,但其余元素也会按一定比例进入萃取剂中。通过3ROH+POCl3⇌(RO)3PO+3HCl制得有机磷萃取剂(RO)3PO,其中−R代表烃基,其对(RO)3PO产率的影响如下表。
| −R | −CH2CH3 | −CH2CH2CH3 | −CH2CH2CH2CH3 |
| (RO)3PO产率/% | 82 | 62 | 20 |
(4)“反萃取”的目的是分离RE和Fe元素。向“萃取液”中通入NH3,Fe2+、Fe3+、Re3+的沉淀率随pH变化如图。

①试剂X为
②通入NH3得到REPO4沉淀的过程为:i.H3PO4+3NH3=(NH4)3PO4
ii.
(5)若略去“净化”过程,则制得的草酸稀土会混有
(6)在整个工艺中,可从副产物中提取
您最近一年使用:0次
名校
解题方法
5 . 某化工厂的工业废液中含有大量的 、
、 ,为减少环境污染,设计了如下回收流程:
,为减少环境污染,设计了如下回收流程:
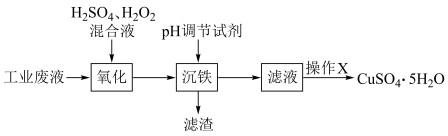
该工艺条件下,相关金属离子形成氢氧化物沉淀的 范围如表:
范围如表:
(1)“沉铁”过滤得到滤液,实验室过滤操作用到的玻璃仪器有:烧杯、漏斗、______ 。
(2)“氧化”过程可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是:______ 。“氧化”过程所涉及的离子方程式为:______ 。
(3) 调节试剂可通过调节
调节试剂可通过调节 除去
除去 ,操作时需控制
,操作时需控制 值的范围为
值的范围为______ 。下列物质最合适做 调节试剂的是
调节试剂的是______ (单选)。
A. B.
B. C.
C.
(4)滤液经过操作 可得到
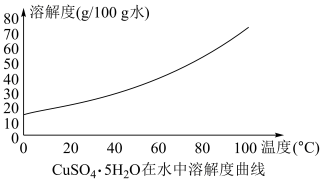
可得到 ,根据其在水中溶解度曲线,操作
,根据其在水中溶解度曲线,操作 为:
为:______ 、______ 、过滤、洗涤、干燥。
(5)某实验室欲用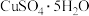 晶体配制480mL0.1mol/L
晶体配制480mL0.1mol/L 溶液,需要用托盘天平称量
溶液,需要用托盘天平称量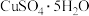 晶体的质量是
晶体的质量是______ g:以下实验操作会导致所配溶液浓度偏低的是______ 。
A.在容量瓶中定容时俯视刻度线
B.容量瓶中有少量蒸馏水
C.定容摇匀后,发现液面低于刻度线,继续加水到刻度线
D.用托盘天平称量晶体时,将砝码放在左盘,药品放在右盘
 、
、 ,为减少环境污染,设计了如下回收流程:
,为减少环境污染,设计了如下回收流程:
该工艺条件下,相关金属离子形成氢氧化物沉淀的
 范围如表:
范围如表:沉淀物 |
|
|
|
开始沉淀 | 2.7 | 7.5 | 4.4 |
完全沉淀 | 3.7 | 9.7 | 6.7 |
(1)“沉铁”过滤得到滤液,实验室过滤操作用到的玻璃仪器有:烧杯、漏斗、
(2)“氧化”过程可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是:
(3)
 调节试剂可通过调节
调节试剂可通过调节 除去
除去 ,操作时需控制
,操作时需控制 值的范围为
值的范围为 调节试剂的是
调节试剂的是A.
 B.
B. C.
C.
(4)滤液经过操作
 可得到
可得到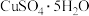 ,根据其在水中溶解度曲线,操作
,根据其在水中溶解度曲线,操作 为:
为:
(5)某实验室欲用
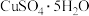 晶体配制480mL0.1mol/L
晶体配制480mL0.1mol/L 溶液,需要用托盘天平称量
溶液,需要用托盘天平称量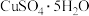 晶体的质量是
晶体的质量是A.在容量瓶中定容时俯视刻度线
B.容量瓶中有少量蒸馏水
C.定容摇匀后,发现液面低于刻度线,继续加水到刻度线
D.用托盘天平称量晶体时,将砝码放在左盘,药品放在右盘
您最近一年使用:0次
2024-02-12更新
|
173次组卷
|
2卷引用:广西南宁市2023-2024学年高一上学期教学质量调研(期末)考试化学试题
6 . 绿矾(FeSO4·7H2O)具有补血消积、燥湿杀虫功效。工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等杂质)制备绿矾的工业流程如图所示:
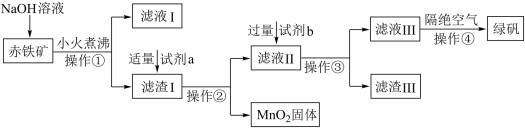
已知:Al2O3可溶于强碱溶液
(1)操作①的名称是___________ ,该操作要用到玻璃棒,其作用为___________ 。
(2)试剂a为稀硫酸,试剂b为铁粉,加入过量试剂b后金属元素之间发生反应的离子方程式为___________ 、___________ 。
(3)滤渣Ⅲ含有___________ ,将其快速分离的方法是___________ 。
(4)操作④隔绝空气的目的是___________ 。

已知:Al2O3可溶于强碱溶液
(1)操作①的名称是
(2)试剂a为稀硫酸,试剂b为铁粉,加入过量试剂b后金属元素之间发生反应的离子方程式为
(3)滤渣Ⅲ含有
(4)操作④隔绝空气的目的是
您最近一年使用:0次
7 . 铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
(1)某补铁口服液中含有 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加_______ ,若_______ ,则说明其已变质。
(2)工业盐的主要成分是 ,曾多次发生过因误食
,曾多次发生过因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力。以上事实说明
结合的能力。以上事实说明 具有
具有_______ 。下列不能实现上述转化的物质是_______ (填字母)。
A. B.
B. C.
C. D.
D.
(3) 常用作杀菌消毒剂,生产
常用作杀菌消毒剂,生产 的反应原理是:
的反应原理是: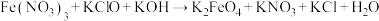 (未配平),则该反应中氧化剂与还原剂的物质的量之比为
(未配平),则该反应中氧化剂与还原剂的物质的量之比为_______ 。
(4)从制造印刷电路板的废液中回收铜,并重新获得 溶液的工艺流程如下,某工程师为了从使用过的腐蚀废液中回收铜,并重新获得
溶液的工艺流程如下,某工程师为了从使用过的腐蚀废液中回收铜,并重新获得 溶液,准备采用下列步骤:
溶液,准备采用下列步骤:

请写出上述流程中加入①和④的有关物质的化学式:①_______ ,④_______ 。请写出通入⑥反应的离子方程式_______ 。
(1)某补铁口服液中含有
 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加(2)工业盐的主要成分是
 ,曾多次发生过因误食
,曾多次发生过因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力。以上事实说明
结合的能力。以上事实说明 具有
具有A.
 B.
B. C.
C. D.
D.
(3)
 常用作杀菌消毒剂,生产
常用作杀菌消毒剂,生产 的反应原理是:
的反应原理是: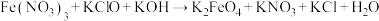 (未配平),则该反应中氧化剂与还原剂的物质的量之比为
(未配平),则该反应中氧化剂与还原剂的物质的量之比为(4)从制造印刷电路板的废液中回收铜,并重新获得
 溶液的工艺流程如下,某工程师为了从使用过的腐蚀废液中回收铜,并重新获得
溶液的工艺流程如下,某工程师为了从使用过的腐蚀废液中回收铜,并重新获得 溶液,准备采用下列步骤:
溶液,准备采用下列步骤:
请写出上述流程中加入①和④的有关物质的化学式:①
您最近一年使用:0次
8 . 某企业排放的废水中含有 和
和 。为了变废为宝,技术人员计划从该废水中回收
。为了变废为宝,技术人员计划从该废水中回收 和金属Cu,工艺流程如图所示。回答下列问题:
和金属Cu,工艺流程如图所示。回答下列问题:
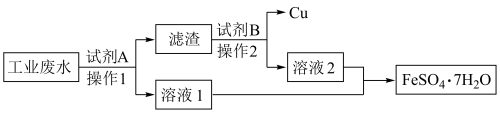
(1)“操作2”的名称为__________ ,在实验室中进行该操作时,所需要的玻璃仪器除烧杯外,还有__________ 。
(2)加入试剂A的目的是将 全部转化为Cu,以便回收铜单质,发生反应的离子方程式为
全部转化为Cu,以便回收铜单质,发生反应的离子方程式为__________ 。
(3)合并溶液1、溶液2后,使溶液析出 晶体的实验操作是
晶体的实验操作是__________ 。
(4)A小组同学要鉴别“溶液2”中的金属阳离子,所需实验操作及实验现象是__________ 。
(5)B小组同学设计如下实验,研究亚铁盐与 溶液的反应。
溶液的反应。
试剂:酸化的 溶液1和5%
溶液1和5% 溶液
溶液
①上述实验中 溶液与溶液1反应的离子方程式是
溶液与溶液1反应的离子方程式是__________ 。
②请结合相关反应解释“稍后,产生气泡”的原因是__________ 。
 和
和 。为了变废为宝,技术人员计划从该废水中回收
。为了变废为宝,技术人员计划从该废水中回收 和金属Cu,工艺流程如图所示。回答下列问题:
和金属Cu,工艺流程如图所示。回答下列问题:
(1)“操作2”的名称为
(2)加入试剂A的目的是将
 全部转化为Cu,以便回收铜单质,发生反应的离子方程式为
全部转化为Cu,以便回收铜单质,发生反应的离子方程式为(3)合并溶液1、溶液2后,使溶液析出
 晶体的实验操作是
晶体的实验操作是(4)A小组同学要鉴别“溶液2”中的金属阳离子,所需实验操作及实验现象是
(5)B小组同学设计如下实验,研究亚铁盐与
 溶液的反应。
溶液的反应。试剂:酸化的
 溶液1和5%
溶液1和5% 溶液
溶液操作 | 现象 |
取 酸化的溶液1于试管中,加入5滴5% 酸化的溶液1于试管中,加入5滴5% 溶液 溶液 | 溶液立即变为棕黄色,稍后,产生气泡 |
向反应后的溶液中加入 溶液 溶液 | 溶液变红 |
 溶液与溶液1反应的离子方程式是
溶液与溶液1反应的离子方程式是②请结合相关反应解释“稍后,产生气泡”的原因是
您最近一年使用:0次
名校
解题方法
9 . 某研究性学习小组查阅资料:氯气与硫在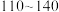 ℃直接化合生成二氯化二硫(
℃直接化合生成二氯化二硫( )。他们利用如下仪器和药品制取纯净的氯气与硫反应来制备
)。他们利用如下仪器和药品制取纯净的氯气与硫反应来制备 。
。
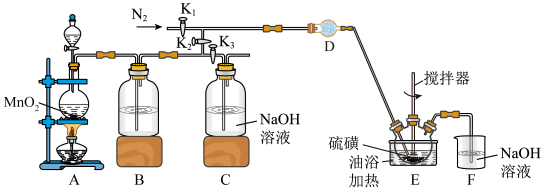
已知:有关物质的部分性质如下表:
回答下列问题:
(1)写出A中发生反应的化学方程式:___________ 。
(2)D中所装试剂为___________ (填化学式)。
(3)实验前向装置中通入 的目的是
的目的是___________ ,反应后向装置中通入 的目的是
的目的是___________ 。
(4)若要清洗附着在烧瓶内壁的硫单质,可以选用___________ 试剂(填字母)。
a. 溶液(浓、热) b.
溶液(浓、热) b. c.酒精 d.
c.酒精 d. (二硫化碳)
(二硫化碳)
(5)若加热温度过高, 粗品中可能混有的杂质是
粗品中可能混有的杂质是___________ (填化学式,填写两种)。
(6)已知 中各原子均满足8电子结构,则分子中含有的共价键类型为
中各原子均满足8电子结构,则分子中含有的共价键类型为___________ 。
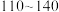 ℃直接化合生成二氯化二硫(
℃直接化合生成二氯化二硫( )。他们利用如下仪器和药品制取纯净的氯气与硫反应来制备
)。他们利用如下仪器和药品制取纯净的氯气与硫反应来制备 。
。
已知:有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
 |  | 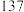 | ①遇水生成 、 、 、 、 ②温度超  以上完全分解生成硫和氯气 以上完全分解生成硫和氯气③ 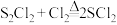 |
(1)写出A中发生反应的化学方程式:
(2)D中所装试剂为
(3)实验前向装置中通入
 的目的是
的目的是 的目的是
的目的是(4)若要清洗附着在烧瓶内壁的硫单质,可以选用
a.
 溶液(浓、热) b.
溶液(浓、热) b. c.酒精 d.
c.酒精 d. (二硫化碳)
(二硫化碳)(5)若加热温度过高,
 粗品中可能混有的杂质是
粗品中可能混有的杂质是(6)已知
 中各原子均满足8电子结构,则分子中含有的共价键类型为
中各原子均满足8电子结构,则分子中含有的共价键类型为
您最近一年使用:0次
解题方法
10 . 化学实验需要纯度很高的化学试剂,是不纯的物质经过一系列净化过程获得。实验者需根据主要成分和杂质的性质差异,选用合适的分离提纯方法。以下是化学实验中用于混合物的分离和提纯装置,根据装置回答下列问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置______ (填字母,下同)。
(2)用自来水制取蒸馏水,选择装置______ 。
(3)除去氯化钙溶液中少量碳酸钙,选择装置______ 。
氯碱厂电解饱和食盐水溶液制取氢氧化钠的工艺流程示意图如下:

依据上图(除杂试剂 和盐酸未列出),完成下列填空:
和盐酸未列出),完成下列填空:
(4)粗盐中混有 、
、 、
、 等杂质,精制过程中加入的四种试剂的先后顺序为______。
等杂质,精制过程中加入的四种试剂的先后顺序为______。
(5)滤渣的成分是泥沙、 、
、 、
、 和
和______ 。
(6)脱盐工序中利用氢氧化钠和氯化钠在溶解度上的差异,通过______ (填操作名称,下同)、冷却、______ 、除去氯化钠(提示:氢氧化钠的溶解度远大于氯化钠)。
实验室需用:250mL1mol·L 的稀盐酸,现用11.9mol/L的浓盐酸配制。
的稀盐酸,现用11.9mol/L的浓盐酸配制。
(7)经计算需要______ mL浓盐酸(精确至小数点后一位),在量取浓盐酸时宜选用下列规格的量筒______ 。
A.5mL B.10mL C.25mL D.50mL
(8)在量取浓盐酸后,进行了下列操作:
a、稀释后的盐酸冷却至室温后,沿玻璃棒注入250mL容量瓶中。
b、往容量瓶中小心加蒸馏水至液面接近刻度线2~3cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的刻度线相切。
c、在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
d、用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是______ 。
(9)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度______ (填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是______ (填“偏高”“偏低”或“无影响”)。

(1)从氯化钾溶液中得到氯化钾固体,选择装置
(2)用自来水制取蒸馏水,选择装置
(3)除去氯化钙溶液中少量碳酸钙,选择装置
氯碱厂电解饱和食盐水溶液制取氢氧化钠的工艺流程示意图如下:

依据上图(除杂试剂
 和盐酸未列出),完成下列填空:
和盐酸未列出),完成下列填空:(4)粗盐中混有
 、
、 、
、 等杂质,精制过程中加入的四种试剂的先后顺序为______。
等杂质,精制过程中加入的四种试剂的先后顺序为______。A. 、 、 、NaOH、HCl 、NaOH、HCl |
B. 、 、 、HCl、NaOH 、HCl、NaOH |
C.HCl、 、 、 、NaOH 、NaOH |
D. 、NaOH、 、NaOH、 、HCl 、HCl |
(5)滤渣的成分是泥沙、
 、
、 、
、 和
和(6)脱盐工序中利用氢氧化钠和氯化钠在溶解度上的差异,通过
实验室需用:250mL1mol·L
 的稀盐酸,现用11.9mol/L的浓盐酸配制。
的稀盐酸,现用11.9mol/L的浓盐酸配制。(7)经计算需要
A.5mL B.10mL C.25mL D.50mL
(8)在量取浓盐酸后,进行了下列操作:
a、稀释后的盐酸冷却至室温后,沿玻璃棒注入250mL容量瓶中。
b、往容量瓶中小心加蒸馏水至液面接近刻度线2~3cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的刻度线相切。
c、在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
d、用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是
(9)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度
您最近一年使用:0次






